Сборник лаб. раб по общей химии new. Методические указания по выполнению лабораторных работ и организации самостоятельной работы для студентов всех форм обучения
 Скачать 1.56 Mb. Скачать 1.56 Mb.
|
|
3.4. Исследование влияния изменения температуры на смещение равновесия При действии йода на крахмал образуется непрочное адсорбционное вещество, окрашенное в синий цвет. Эта реакция является экзотермической, и ее можно условно изобразить уравнением: Крахмал + Йод  Окрашенное вещество ΔН < О. Окрашенное вещество ΔН < О.Налить в две пробирки по 2–3 мл раствора крахмала и добавить по 2–3 капли йодной воды. Наблюдать появление синей окраски. Нагреть одну из пробирок. Что наблюдается? Сделать вывод о направлении смещения равновесия в этой реакции при повышении температуры. 4. Задачи для самостоятельной работы 1. Для следующих реакций написать уравнение скорости реакции и определить, как изменится скорость, если концентрацию первого вещества увеличить в 2 раза:
2. Написать выражение константы равновесия для следующих реакций:
3. Во сколько раз увеличится скорость химической реакции при повышении температуры на 30°, если 1) γ = 2; 2) γ = 3; 3) γ = 2,5; 4) γ = 3,2; 5) γ = 2,9. На сколько градусов следует повысить температуру системы, чтобы скорость протекающей в ней реакции увеличилась в 20 раз, если 6) γ = 2; 7) γ = 3; 8) γ = 3,5; 9) γ = 2,8; 10) γ = 4. Скорость реакции при 0°С равна единице, ее температурный коэффициент равен трем. Чему равна скорость этой реакции при 11) 50°С; 12) 100°С; 13) 200°С. Скорость реакции при 100°С равна единице, ее температурный коэффициент равен двум. Во сколько раз медленнее протекает эта реакция при 14) 20°С; 15) 50°С. Как и во сколько раз изменится скорость химической реакции при повышении температуры от 100С до 300С, если: 16) γ = 2; 17) γ = 3; 18) γ = 2,5; 19) γ = 3,2; 20) γ = 2,9. 4. Куда сместится равновесие обратимой реакции, если изменить а) концентрацию, б) давление, в) температуру так, как указано в таблице 4. Таблица 4
Лабораторная работа № 4 Ионно-обменные реакции Введение Электролиты являются составной частью жидкостей и плотных тканей живых организмов. Ионы натрия Na+, калия К+, кальция Са2+, магния Mg2+, водорода Н+, анионы ОН-, Cl-, SO42-, НСО3- имеют большое значение для физиологических и биохимических процессов. Концентрация различных ионов в организме человека различна. Концентрация водородных ионов Н+ и гидроксид-ионов ОН- очень мала, но они играют большую роль в жизненных процессах. Водородные ионы Н+ способствуют нормальному функционированию ферментов, обмену веществ, перевариванию пиши и т. д. Концентрация ионов натрия Na+ и хлорид-ионов Cl- в нашем организме большая. Эти ионы человек получает ежедневно, используя в пищу поваренную соль NaCl. В медицине применяется 0,85%-й раствор хлорида натрия в качестве физиологического раствора при большой потере жидкости организмом. 1. Цели и задачи 1.1. Приобрести системные знания о теории электролитической диссоциации, изучить условия протекания реакций обмена в водных растворах электролитов. 1.2. Уметь составлять уравнения диссоциации кислот, оснований и солей в водных растворах. 2. Теоретическая часть 2.1. Электролитическая диссоциация. Диссоциация кислот, оснований, амфотерных гидроксидов и солей в водных растворах Согласно теории электролитической диссоциации все электролиты диссоциируют на положительно заряженные катионы и отрицательно заряженные анионы. Так, кислоты в водных растворах диссоциируют на катионы водорода и анионы кислотного остатка. Например: HCl = H+ + Cl-; CH3COOH = CH3COO- + H+. Многоосновные кислоты диссоциируют ступенчато: H3РО4 = H+ + H2PO H2PO4- = H+ + HPO42- Н 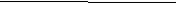 РО42- = Н+ + РО43- РО42- = Н+ + РО43-H3РО4 = ЗH+ +РО43- Диссоциация многоосновной кислоты протекает главным образом по первой ступени, в меньшей степени – по второй и лишь в незначительной степени – по третьей. Основания диссоциируют на анионы гидроксо-групп OH- и катионы металлов. Например: NaOH = Na+ + OH-; CsOH = Cs+ + OH-. Многокислотные основания диссоциируют ступенчато: Ba(ОН)2 = BaОН+ + ОН- Ba(ОН)+ = Ba2+ + ОН- 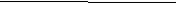 Ba(ОН)2 = Ba2+ + 2OН- Амфотерные гидроксиды могут в зависимости от условий при диссоциации давать как ионы Н+, так и ОН-, так как у них в равной степени выражены как основные так и кислотные свойства: 2ОН- +Zn+2 + 2H2O ↔ Zn(OH)2 + Н2О ↔ [Zn(OH)4]2- + 2H+. Соли в водных растворах диссоциируют на катионы металлов и анионы кислотных остатков: Nа2SO4=2Na+ +SO Na3РО4 = 3Na+ + PO Са(HСО3)2 =Ca2+ +2НСО MgOHCl = MgOH+ + Сl- 2.2.Степень диссоциации. Сильные и слабые электролиты Поскольку электрическая диссоциация – процесс обратимый, то в растворах электролитов наряду с ионами присутствуют и молекулы. Поэтому электролиты характеризуются степенью диссоциации α. Степень диссоциации определяется отношением числа распавшихся на ионы молекул n к общему числу растворенных молекул N. Если α = 0, то диссоциация отсутствует, а если α = 1 или 100%, то электролит распадается на ионы полностью. Если α = 30%, значит, из 100 молекул электролита распалось на ионы только 30. Различные электролиты имеют разную степень диссоциации. Опыт показывает, что она зависит от концентрации электролита и температуры. К сильным электролитам относятся:
H2SO4; HNO3; НСl; HBr; HI; HMnO4; НСlО3; НСlO4; 3) гидроксиды щелочных и растворимые гидроксиды щелочноземельных металлов. К слабым электролитам откосятся:
H2CO3; H2S; HNO2; HClO; H2SiO3; H3PO4; H2SO3 и др.;
К слабым электролитам относится также H2О. Слабые электролиты не могут дать большой концентрации ионов в растворе. |

 СO2 + H2;
СO2 + H2;