Сборник лаб. раб по общей химии new. Методические указания по выполнению лабораторных работ и организации самостоятельной работы для студентов всех форм обучения
 Скачать 1.56 Mb. Скачать 1.56 Mb.
|
|
2.3 Константа диссоциации Для характеристики слабых электролитов применяют константу диссоциации КД. Вследствие того, что слабые электролиты диссоциируют на ионы не полностью, в их растворах при диссоциации устанавливается динамическое равновесие между недиссоциированными молекулами и ионами. Для слабого электролита общей формулы АnВm уравнение диссоциации имеет вид АnВm Применяя закон действия масс, запишем выражение константы равновесия: 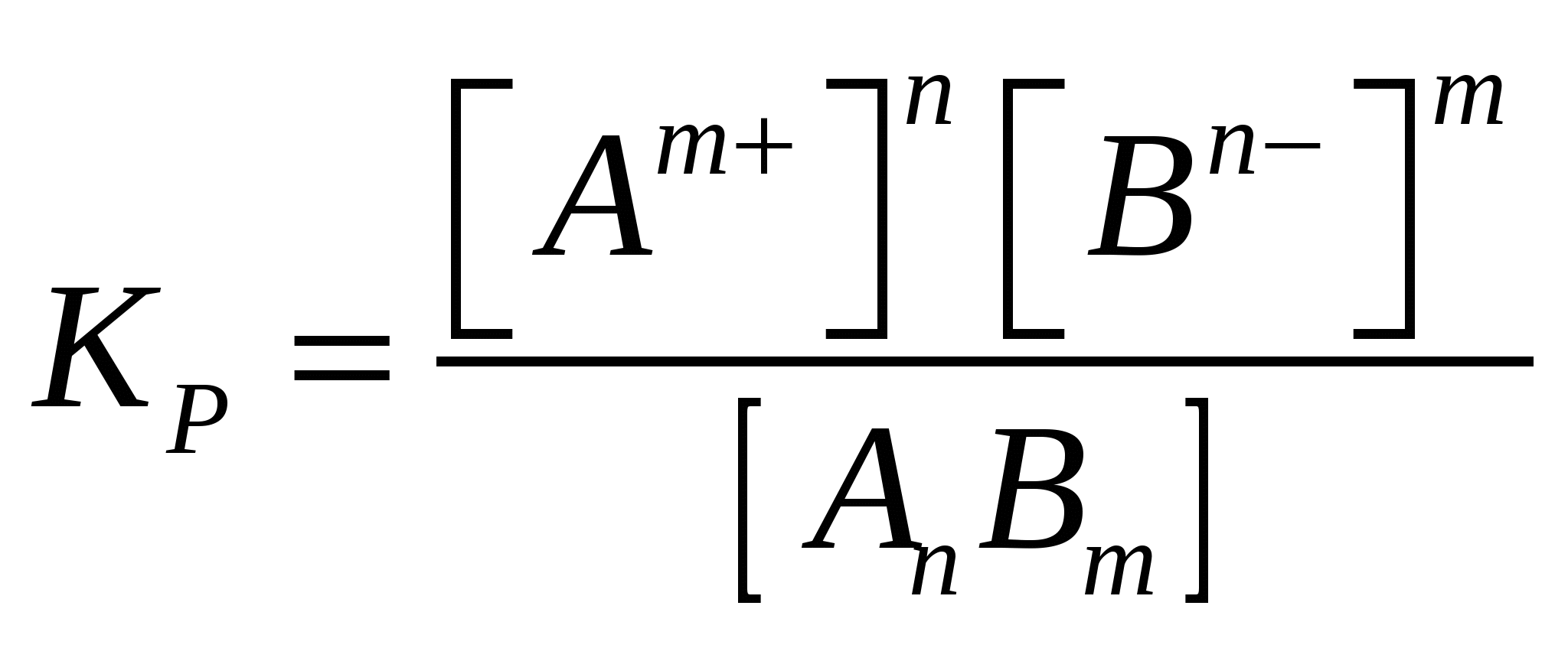 , ,где [Am+], [Вn-] – равновесные концентрации ионов Аm+ и Вn-, [АnВm] – равновесная концентрация недиссоциированных молекул АnВm. Константу равновесия в этом случае называют константой диссоциации (КД) или константой ионизации. Константа ионизации характеризует способность электролита диссоциировать на ионы. Чем больше константа диссоциации, тем легче электролит распадается на ионы, тем больше ионов в его растворе, тем сильнее электролит. Например: 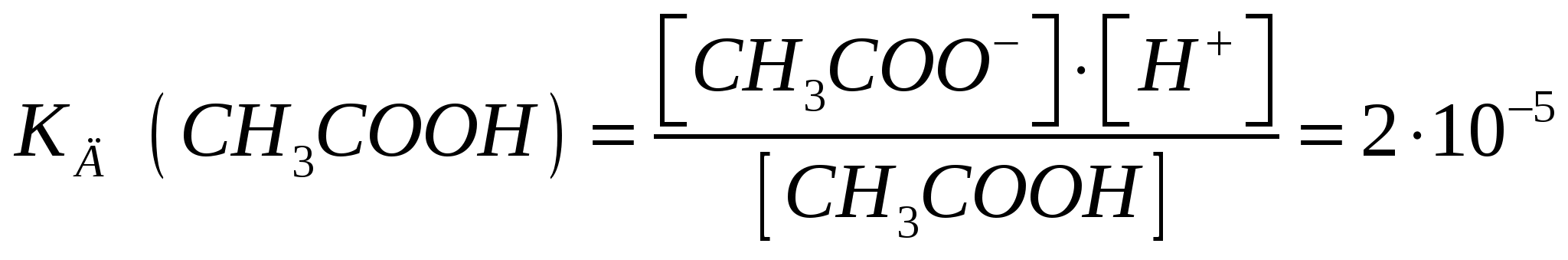 Следовательно, уксусная кислота СН3СООН более сильный электролит, чем циановодородная кислота HCN. Для слабого электролита константа диссоциации постоянная величина при данной температуре, которая не зависит от концентрации раствора. Константа диссоциации зависит от природы электролита, природы растворителя и температуры. 2.4. Реакции обмена в водных растворах электролитов. Ионные реакции и уравнения Согласно теории электролитической диссоциации все реакции в водных растворах электролитов являются реакциями между ионами. Они называются ионными реакциями, а уравнения этих реакций – ионными уравнениями. При составлении ионных уравнений реакций следует руководствоваться тем, что вещества мало диссоциированные, малорастворимые (выпадающие в осадок) и газообразные записываются в молекулярной форме. Сильные электролиты, как полностью диссоцированные, записывают в виде ионов. Сумма электрических зарядов левой части уравнения должна быть равна сумме электрических зарядов правой части. Ионными уравнениями могут быть изображены любые реакции, протекающие в растворах между электролитами. I. Реакция, идущая с образованием осадка. а) NiCl2 + NaOH = Ni(OH)2 + 2HСl – молекулярное уравнение реакции; б) Ni2+ + 2Сl- + 2Na+ + 2OH- = Ni(OH)2 + 2H+ +2Сl- – ионное уравнение реакции; в) Ni2+ +2OH- = Ni(OH)2 – сокращенное ионное уравнение реакции. II. Реакции, идущие с образованием газа: а) Na2S + 2НСl = H2S↑ + 2NaCl; б) 2Na+ + S2- + 2Н+ + 2Сl- = H2S + 2Na+ + 2Cl-; в) S2-+ 2H+ = H2S. III. Реакции, идущие с образованием слабых кислот слабых оснований: а) CH3COONa + HNO3 = СН3СООН + NaNO3; б) СН3СОО- + Na+ + H+ + NO3- = СН3СООН + Na+ + NO3-; в) СН3СОО- + Н+ = СН3СООН. IV. Реакции, идущие между сильными и слабыми электролитами: 1. а) ↓CaСO3 +2НСl = СaСl2 + H2СО3 б) ↓СаСО3 + 2Н+ + 2Сl- = Ca2+ + 2Сl- + СО2↑+ H2О; в) CaСО3 + 2H+ = Ca2+ + СО2 + H2O. 2. a)↑H2S + 2NaOH = Na2S + 2H2O; б)↑H2S + 2Na+ + 2ОH- = 2Na+ + S2- + 2H2О; в) H2S + 2OH- = 2H2О + S2-. 2.5. Изменение энергии Гиббса и направленность химических процессов Изменение энергии Гиббса ΔG позволяет решить вопрос о направлении самопроизвольного процесса, протекающего при постоянном давлении и температуре. Если ΔG < 0, процесс протекает самопроизвольно в прямом направлении. Если ΔG > 0, то процесс идет в обратном направлении. Если ΔG = 0, то в системе устанавливается химическое равновесие. ΔG при стандартных условиях (Т= 298 К, Р= 0, 101 МПа) вычисляется по формуле Значение энергии Гиббса, кДж/(моль.К)
Примеры решения задач 1. Написать в молекулярной полной и сокращенной ионной формах уравнения реакций между хлоридом алюминия и нитратом серебра, гидроксидом натрия и сероводородом. Решение. Составляем уравнение реакции в молекулярной форме: AlCl3 + 3AgNO3 = 3AgCl↓+ A1(NO3)3 Составляем ионное уравнение реакции. Диссоциацию осадков, газообразных веществ, слабых электролитов в ионных реакциях не показывают. Так как АlСl3, AgNO3 и Al(NO3)3 – сильные электролиты, то уравнение имеет вид: Аl3+ + ЗСl- + 3Ag+ + 3NO3- = 3AgCl↓ + Аl3+ + 3NO3- Исключаем из обеих частей равенства одинак овые ионы, т.е. не участвующие в реакции: 3Ag+ + ЗСl- = 3AgCl↓ Ag+ + Сl- = AgCl↓ С точки зрения теории электролитической диссоциации сущность реакции, отражаемая сокращенным ионным уравнением, сводится к взаимодействию ионов серебра с хлорид-ионами. Остальные ионы в реакции участия не принимают. Для второго уравнения: 2NaOH + H2S = Na2S + 2Н2O H2S и Н2O - слабые электролиты. Ионное уравнение: 2Na+ + 2ОН- + H2S = 2Na+ + S2- + 2H2O 2OH- +H2S = S2- + 2H2O 2. Написать ионно-молекулярные уравнения реакций взаимодействия между водными растворами следующих веществ: а) НСl и NaOH; б) Pb(NO3)2 и Na2S; в) NaClO и HNO3; г) К2СО3 и H2SO4; д) СН3СООН и NaOH. Решение. Запишем уравнения указанных веществ в молекулярном виде: a) HCI + NaOH = NaCl + Н2О; б) Pb(NO3)2 + Na2S = PbS + 2NaNO3; в) NaClO + HNO3 = NaNO3 + НСlO, г) K2CO3 + H2SO4 = K2SO4 + CO2 + H2O; д) CH3COOH + NaOH = CH3COONa + H2O. Отметим, что взаимодействие этих веществ возможно, т.к. в результате происходит связывание ионов с образованием слабых электролитов (Н2О, НСlO), осадка (РbS), газа (СО2). В реакции "д" два слабых электролита, но т.к. реакции идут в сторону большего связывания ионов и вода – более слабый электролит, чем уксусная кислота, то равновесие реакции смещено в сторону образования воды. Исключив одинаковые ионы из обеих частей равенства a) Na+ и Сl-; б) Na+ и NO3-; в) Na+ и NO3-; г) К+ и SO42-; д) Na+, получим ионно-молекулярные уравнения соответствующих реакций: а) H+ + OH- = H2O; б) Pb2+ + S2- = PbS; в) ClO- + H+ = HClO; г) СО32- + 2Н+ = СO2 + Н2O; д) СН3СООН + OH- = СН3СОО - + Н2О. 3. Составьте молекулярные уравнения реакций, которым соответствуют следующие ионно-молекулярные уравнения: а) SO32- + 2Н+ = SO2 + Н2O; б) Рb2+ + CrO42- = PbCrO4; в) HCO3- + ОН- = СО32- + Н2O; г) ZnOH+ + Н+ = Zn2+ + Н2О. Решение. В левой части данных ионно-молекулярных уравнений указаны свободные ионы, которые образуются при диссоциации растворимых сильных электролитов, следовательно, при составлении молекулярных уравнений следует исходить из соответствующих растворимых сильных электролитов. Например: а) Na2SO3 + 2HCl = 2NaCl + SO2 + Н2О; б) Pb(NO3)2 + K2CrO4 = РbСrO4 + 2KNO3; в) КНСО3 + КОН = К2СО3 + Н2О; г) ZnOHCl + НСl = ZnCl2 + Н2О. 3. Экспериментальная часть 3.1. Получение малорастворимых оснований
3.2. Получение малорастворимых кислот
3.3. Реакции со слабыми электролитами 3.3.1.Реакция со слабой кислотой:
3.3.2. Реакция со слабым основанием.
3.4. Получение малорастворимых солей
4. Задачи для самостоятельной работы
7) HCOOK +HNO3 15) CuSO4 + NaOH 8) NH4Cl + Ca(OH)2 16) Fe(OH)3 и H2SO4; 17) Na2SiO3 и HNO3; 18) K2SO3 и HNO3; 19) CdBr2 и BaS; 20) MnI2 и K3PO4.
7) Ag+ +Cl- = AgCl↓ 15) 2H+ + S2+ = H2S↑ 8) NH+ 4 +OH- = NH3 + H2O 20) Cu2+ + 2OH- = Cu(OH)2. 16) 2H+ + SiO32- = H2SiO3; 19) Pb2+ + SO42- = PbSO4; 17) 2H+ + S2- = H2S; 18) Ni2+ + S2- = NiS;
|
