Сборник лаб. раб по общей химии new. Методические указания по выполнению лабораторных работ и организации самостоятельной работы для студентов всех форм обучения
 Скачать 1.56 Mb. Скачать 1.56 Mb.
|
|
Лабораторная работа № 3 Скорость химических реакций и химическое равновесие Введение Химической кинетикой называется учение о скорости химических реакций и зависимости ее от различных факторов – концентрации реагирующих веществ, температуры, влияния катализаторов и проч. Изучение кинетики реакций представляет большой практический и теоретический интерес. При использовании любой химической реакции всегда очень важно, чтобы она происходила с требуемой скоростью. Известно, что одни химические реакции, как, например, реакции разложения взрывчатых веществ, протекают в течение десятитысячных долей секунды; другие продолжаются минутами, часами, сутками, а некоторые процессы, происходящие в земной коре, длятся десятки, сотни и тысячи лет. Теоретическое значение изучения скорости химических реакций заключается, прежде всего в том, что оно дает возможность выяснить многие детали химического взаимодействия и глубже понять механизм химического процесса. 1. Цели и задачи 1.1. Познакомиться с экспериментальными основами теории химической кинетики. 1.2. Изучить зависимость скорости химических реакций от концентраций реагирующих веществ и температуры. 1.3. Изучить влияние концентраций реагентов и температуры на смещение химического равновесия. 2. Теоретическая часть Химическая реакция – это процесс, при котором происходит превращение одних веществ в другие. В этом процессе происходит обмен атомами между различными веществами, перераспределение электронов между атомами, разрушение одних химических связей и образование других. Вещества, вступающие в реакцию, называются исходными веществами. Получающиеся в результате реакции соединения называются продуктами реакции. Все принимающие участие в реакции вещества называются реагирующими веществами. Химические реакции могут быть гомогенными и гетерогенными. Гомогенные (однородные) реакции протекают в одной фазе, например, реакции между газами или растворенными веществами. В гетерогенных (разнородных) реакциях участвуют вещества, находящиеся в разных фазах, например, твердое – газ, твердое – жидкость. Гомогенная реакция протекает во всем объеме, а гетерогенная может протекать только на поверхности раздела фаз, где соприкасаются реагирующие вещества. Скорость химической реакции измеряется количеством вещества, вступившего в реакцию или образовавшегося в результате реакции за единицу времени в единице объема (для гомогенной реакции) или на единице площади поверхности раздела фаз (для гетерогенной реакции). Отношение количества вещества к единице объема, в котором проходит реакция, называется концентрацией. Поэтому в случае гомогенной реакции, протекающей в постоянном объеме, средняя скорость реакции измеряется изменением концентрации какого-либо из реагирующих веществ в единицу времени и может быть определена по формуле (1) V = где V – скорость, моль/л с; ΔС – изменение концентрации, моль/л; Δt – время, с. Скорость реакции зависит от природы реагирующих веществ, их концентрации, температуры, присутствия катализатора. Зависимость скорости реакции от концентрации определяется законом действия масс: при постоянной температуре скорость химической реакции пропорциональна произведению концентраций реагирующих веществ, взятых в степенях их стехиометрических коэффициентов. Математическое выражение закона действия масс для реакции, представленной уравнением в общем виде mA + nB = dD + fF записывается следующим образом: (2) V = k . САm . СBm или V = k . [A]m . [B]n, где V – скорость реакции; СА, СВ или [А], [В] – концентрации реагирующих веществ, моль/л; m, n – стехиометрические коэффициенты; k - константа скорости реакции. Константа скорости реакции – постоянная для данной реакции величина, которая зависит от природы реагирующих веществ, температуры, катализатора, но не зависит от концентрации реагирующих веществ. Физический смысл k заключается в том, что k – это скорость химической реакции, когда концентрации реагирующих веществ равны 1 моль/л. Гетерогенная реакция протекает на поверхности твердого вещества, поэтому концентрация твердого вещества в целом не влияет на скорость реакции. Скорость гетерогенной реакции зависит от площади поверхности твердого вещества и пропорциональна только концентрации веществ, находящихся в газовой или жидкой фазах. Например, для гетерогенной реакции С(Т) + О2(Г) = СО2(Г) закон действия масс имеет вид: (3) V = k[02]. Зависимость скорости реакции от температуры определяется правилом Вант-Гоффа, согласно которому при повышении температуры на каждые 10°, скорость реакции возрастает примерно в 2 – 4 раза (4) где Vt1 – скорость при начальной температуре; Vt2 – скорость при конечной температуре; γ – температурный коэффициент, показывающий, во сколько раз изменяется скорость реакции при нагревании системы на 10°. Химические реакции – это процессы превращения одних веществ в другие. В основе этих превращений лежит разрушение связей в молекулах исходных веществ и образование новых связей между частицами, приводящее к образованию молекул продуктов реакции. Для того чтобы произошла химическая реакция, сначала необходимо, чтобы молекулы реагентов столкнулись. Однако не все столкновения заканчиваются актом химического превращения, т.е. не все соударения эффективны. Число эффективных соударений очень мало по сравнению с числом реальных столкновений (если бы все столкновения были эффективны, то реакции протекали бы мгновенно). Реагируют при столкновении только те молекулы, которые обладают достаточно высокой энергией, т.е. активные молекулы. Активными могут быть молекулы, обладающие повышенной кинетической энергией движения, или возбужденные молекулы. В возбужденных молекулах один или несколько электронов могут находиться на более высоких энергетических уровнях; расстояния между ядрами в молекуле отличаются от наиболее устойчивого состояния, а также наблюдается более сильные колебания атомов в молекуле. С ростом температуры увеличивается число активных молекул. Активные молекулы при своем столкновении вначале образуют активный комплекс. Активный комплекс – это промежуточное состояние вещества, когда ослабляются связи между атомами в реагирующих молекулах и начинаются образовываться новые связи между атомами, приводящие к образованию продуктов реакции. Активный комплекс обладает повышенной энергией. Та минимальная избыточная энергия, по сравнению со всей энергией, которой должны обладать молекулы, чтобы столкновение между ними было эффективным и чтобы активный комплекс мог превратиться в продукты реакции, называется энергией активации. С 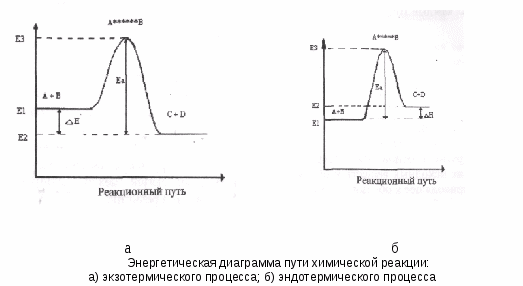 хематически переход от исходных веществ А и В к продуктам реакции С и D через состояние активного комплекса А****В представлен на рисунке. хематически переход от исходных веществ А и В к продуктам реакции С и D через состояние активного комплекса А****В представлен на рисунке.На приведенной диаграмме Е1 – средняя энергия молекул исходных веществ А и В, а Е2 – средняя энергия молекул продуктов реакции. Энергия промежуточного активного комплекса – Е3. Разность Е3 - E4 будет выражать энергию активации данной реакции Еа. Энергия системы в переходном состоянии Е3, максимальна, а это значит, что активный комплекс крайне неустойчив. По ходу реакции он превращается в продукты взаимодействия С и D. Если Е2 больше Е1, то реакция протекает с поглощением энергии, ΔH > 0, и является эндотермической. Если E2 меньше E1, то энергия выделяется при протекании реакции, ΔН < 0, и реакция – экзотермическая. Функциональная зависимость константы скорости химической реакции от температуры выражается уравнением Аррениуса (5) lg k = 2,3 lg k0 – Ea / RT, где k – константа скорости реакции; k0 – предэкспоненциальный множитель; Еа – энергия активации; Т – абсолютная температура; R – универсальная газовая постоянная. Из этого уравнения видно, что чем больше энергия активации, тем меньше скорость реакции. Уравнение Аррениуса позволяет проводить расчеты изменения скорости реакции с увеличением температуры. Так, если температура увеличилась от Т1 до Т2, то отношение скоростей реакции V1 и V2,будет (6) 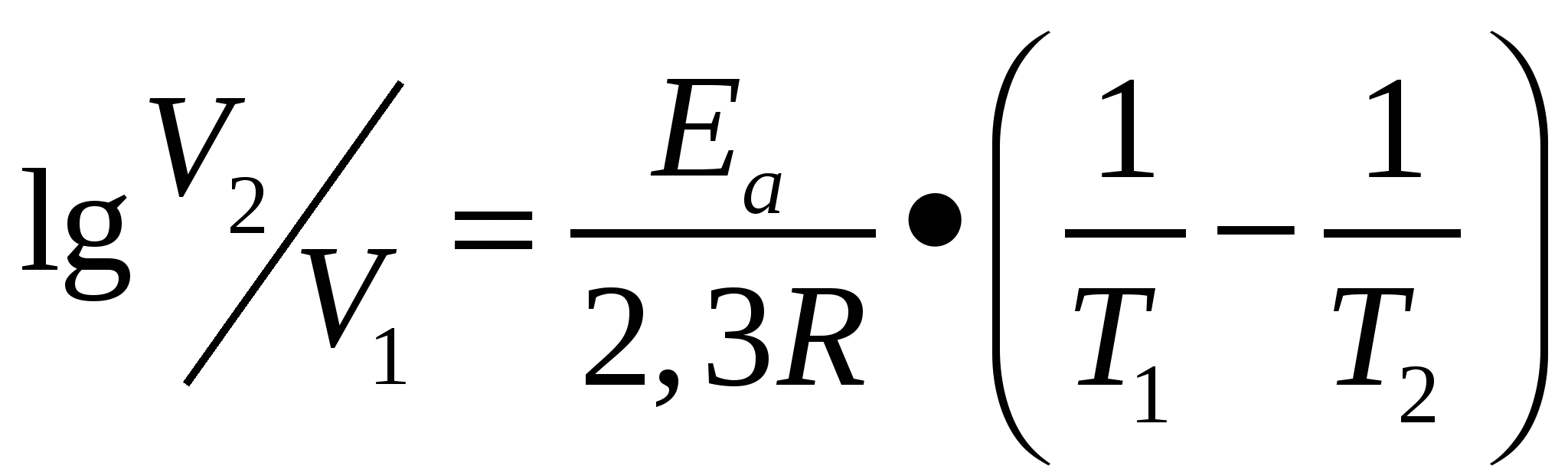 . .Все химические реакции можно разделить на два типа: необратимые и обратимые. Если реакция протекает до конца, т.е. до полного израсходования одного из реагирующих веществ, она называется необратимой. Обратимой называется реакция, которая может протекать одновременно в противоположных направлениях. Примером такого процесса может служить реакция 2HI  Н2 + I2. Н2 + I2.В обратимой реакции ни одно из реагирующих веществ не расходуется полностью. Когда скорость прямой реакции становится равной скорости обратной реакции, в системе устанавливается химическое равновесие и дальнейшего изменения концентраций участвующих в реакции веществ не происходит. Каждое химическое равновесие характеризуется своей константой равновесия. Вывод константы равновесия приведен для обратимой реакции, представленной в общем виде уравнением mА + nВ  dD + fF. dD + fF.Согласно основному закону химической кинетики (закону действия масс), скорость прямой реакции равна: (7) V1 = k1 . [А]m . [В]n; скорость обратной реакции: V2 = k2 . [D]d . [F]f. (8) Через определенный промежуток времени наступает момент, когда V1 = V2, т.е. устанавливается химическое равновесие, которое с течением времени не изменяется при условии сохранения постоянства условий. Концентрации реагирующих веществ, установившиеся при химическом равновесии, называются равновесными. При равенстве левых частей уравнений [7] и [8] равны и их правые части: k1 . [А]m . [В]n = k2 . [D]d . [F]f, или Отношение констант скоростей прямой и обратной реакций будет величиной постоянной, которая называется константой химического равновесия и обозначается К. Следовательно, где К – константа химического равновесия, не зависящая от концентрации реагирующих веществ, но изменяющаяся с изменением температуры. Таким образом, при химическом равновесии отношение произведения концентраций получающихся веществ к произведению концентраций веществ, вступающих в реакцию, есть величина постоянная для данной реакции при данной температуре. Изменяя условия (концентрацию, температуру, давление и др.), можно сместить равновесие в желаемом направлении. Смещение равновесия подчиняется правилу Ле Шателье: если изменить хотя бы одно из условий, при котором система находится в состоянии химического равновесия, то равновесие сместится в направлении той реакции, которая противодействуют оказанному изменению, т.е. ослабляет его. 3. Экспериментальная часть 3.1. Исследование зависимости скорости гомогенной реакции от концентрации Указанную зависимость необходимо изучить для реакции взаимодействия тиосульфата натрия с серной кислотой, которая выражается уравнением Na2S2O3 + H2SO4 = S↓+ SO2 + H2O + Na2SO4. При протекании этой реакции образуется нерастворимая в воде сера, которая вызывает опалесценцию (помутнение) раствора. Скорость реакции определяется по времени τ с момента сливания растворов до появления заметной опалесценции раствора. Скорость является величиной обратной времени: Приготовить в трех пробирках равные объемы растворов различной концентрации, смешав тиосульфат натрия и воду так, как указано в таблице 1. Таблица 1
Последней в каждую пробирку необходимо добавлять каплю серной кислоты, встряхивать пробирку и сразу же включать секундомер. По секундомеру определить время с момента добавления кислоты до появления помутнения раствора. Полученные данные записать в табл. 1 и рассчитать скорость реакции. По полученным данным построить график зависимости скорости реакции (ось ординат) от концентрации (ось абсцисс). Сделать вывод об изучаемой зависимости. Какой линией выражается найденная зависимость? Должна ли линия проходить через начало координат? 3.2. Исследование зависимости скорости гомогенной реакции от температуры В одну пробирку налить 10 капель 1н раствора Na2S2O3, а в другую 2-3 капли H2SO4 (разб.). Отметить температуру воздуха в лаборатории. Затем раствор тиосульфата натрия прилить к раствору серной кислоты и включить секундомер. Отметить время появления заметной опалесценции. В две другие пробирки налить те же растворы. Приготовить водяную баню, смешивая горячую и холодную воду, с температурой на 10° выше, чем в предыдущем опыте. Пробирки с растворами поместить в водяную баню и выдержать 1-2 мин. Слить содержимое пробирок вместе и, не вынимая пробирку, в которой проходит реакция из воды, замерить время появления мути. Повторить тот же опыт, повысив температуру еще на 10°. Результаты опытов записать в таблице 2. Таблица 2
По полученным данным построить график зависимости скорости реакции (ось ординат) от температуры (ось абсцисс). Сделать вывод о зависимости скорости химической реакции от температуры. Какое значение принимает γ для большинства химических реакций? 3.3. Исследование влияния изменения концентрации на смещение равновесия В четыре пробирки внести по 5-10 капель разбавленных растворов Fe(N03)3 и NH4CNS. Легким встряхиванием размешать растворы. В смеси растворов протекает обратимая реакция Fe(NO3)3 + 3NH4CNS 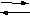 Fe(CNS)3 + 3NH4NO3. Fe(CNS)3 + 3NH4NO3.Окраску растворам в пробирках придает Fe(CNS)3, и чем его больше, тем интенсивность окраски будет выше. В одну из пробирок добавить 2–3 капли концентрированного раствора Fe(NO3)3, во вторую пробирку – 2–3 капли концентрированного раствора NH4CNS. В третью пробирку насыпать несколько кристаллов NH4NO3 и встряхнуть ее для перемешивания. Сравнить окраски растворов в этих трех пробирках с окраской контрольного раствора в четвертой пробирке. Как изменилась концентрация Fe(CNS)3 в каждой из трех пробирок? Исходя из изменения интенсивности окраски, определить направление смещения равновесия. Написать уравнение константы для данной реакции. Все наблюдения записать в таблице 3. Таблица 3
|
