Сборник лаб. раб по общей химии new. Методические указания по выполнению лабораторных работ и организации самостоятельной работы для студентов всех форм обучения
 Скачать 1.56 Mb. Скачать 1.56 Mb.
|
3. Экспериментальная часть3.1. Определение жесткости воды Для определения налейте по 50 мл исследуемой воды в 3 конические колбы при помощи цилиндра. В каждую колбу добавьте по 2-4 капли индикатора (метилоранжа). Одну колбу оставьте в качестве контрольной для сравнения окраски раствора при титровании. В приготовленную бюретку налейте 0,1 н раствор соляной кислоты. Установите уровень кислоты в бюретки на нуль. Прилейте по каплям кислоту в колбу с водой до тех пор, пока окраска раствора не измениться с желтой в оранжево-розовую (следить за изменением окраски сравнивая с эталоном). Окончив титрование, по нижнему мениску отметьте уровень соляной кислоты в бюретке и запишите ее объем, пошедший на титрование. Титрование повторить три раза. Расхождение в объеме кислоты, пошедшей на титрование, не должен превышать 0,01 мл. Из полученных данных рассчитать среднее значение объема соляной кислоты, пошедшей на титрование 50 мл исследуемой воды и вычислить жесткость исследуемой воды по формуле (1): Ж = где Ж – карбонатная жесткость, мэкв/л; VHCl – средний объем кислоты, пошедший на титрование, мл; VH2O – объем исследуемой воды, мл. Результаты опытов занесите в таблицу 1. Определите жесткость котловой, водопроводной, морской воды. Таблица 1.
3.2. Определение щелочности воды Метод определения щелочности основан на процессе нейтрализации 0,1 н раствором серной кислоты котловой воды, содержащей щелочи, окрашивающие фенолфталеин в малиново-красный цвет. Конец реакции устанавливают в момент добавления последней капли кислоты. Когда малиновая окраска исчезает, и вода принимает первоначальную окраску (до введения в нее фенолфталеина) В колбу налить 100 мл испытуемой воды; туда же ввести 2…3 капли индикатора (фенолфталеина). При наличии щелочи вода окрашивается в малиново-красный цвет. Затем осторожно, по каплям пробу воды титровать раствором серной кислоты из бюретки до исчезновения окраски. Щелочность котловой воды, выражается в мэкв/л. численно равняется количеству миллилитров кислоты, затраченной на титрование 100 мл воды. Также щелочность котловой воды выражается щелочным числом А. Щелочное число котловой воды равняется количеству миллилитров кислоты, затраченной на титрование 100 мл котловой воды, умноженному на 40. А = V H2SO4 · 40 A – щелочное число, V H2SO4 – объем серной кислоты, пошедший на титрование. Результаты опытов запишите в таблицу 2. Таблица 2
3.3. Определение водородного показателя Метод определения показателя концентрации водородных ионов рН основан на реакции универсального индикатора на ионы Н+, находящиеся в испытуемой воде. В колбу налить 100 мл котловой воды, туда же ввести 2…3 капли универсального индикатора. По изменению окраски определить рН воды. Интервал рН в зависимости от изменения цвета пробы приведен в таблице 3. Таблица 3
Химические анализы по определению рН воды должны быть проведены три раза. Результаты опытов запишите в таблицу 2. 4. Задачи для самостоятельной работы 1.1. Вычислить жесткость воды, зная, что в 500 л ее содержится 202,5 г Са(НСО3)2. Ответ: 5 мэкв/л. 1.2. Сколько граммов соды Nа2СО4 надо прибавить к 500 л воды, чтобы устранить ее жесткость, равную 5 мэкв/л.? Ответ: 132,5 г Nа2СО4. 1.3. Вычислить карбонатную жесткость воды, зная, что на титрование 100 мл этой воды, содержащей гидрокарбонат кальция, потребовалось 6,25 мл 0,08 н раствора HCl. Ответ: 5 мэкв/л. 1.4. Какую массу Na3PO4 надо прибавить к 500л воды, чтобы устранить ее карбонатную жесткость, равную 5мэкв? Ответ: 136,6 г. 1.5. В 1 л воды содержится ионов магния 36,47 мг и ионов кальция 50,1 мг. Чему равна жесткость этой воды? Ответ: 5,5 мэкв/л. 1.6. Вода, содержащая только сульфат магния, имеет жесткость 7 мэкв. Какая масса сульфата магния содержится в 300л этой воды? Ответ: 126,3 г. 1.7. Вычислите жесткость воды, зная, что в 600л содержится 65,7г гидрокарбоната магния и 61,2 сульфата кальция. Ответ: 3,2 мэкв/л. 1.8. В 220 л воды содержится 11г сульфата магния. Чему равна жесткость этой воды? Ответ: 0,83 мэкв/л. 1.9. В 1м3 воды содержится 140г сульфата магния. Вычислите жесткость этой воды. Ответ: 2,33 мэкв/л. 1.10. Чему равна жесткость воды, если для ее устранения к 50л воды потребовалось прибавить 21,2г карбоната натрия? Ответ: 8 мэкв/л. 1.11. Вода, содержащая только гидрокарбонат кальция, имеет жесткость 9 мэкв. Какая масса гидрокарбоната кальция содержится в 500л воды? Ответ: 364,5г. 1.12. Какую массу гидроксида кальция надо прибавить к 2,5 л воды, чтобы устранить ее жесткость, равную 4,43 мэкв/л? Ответ: 0,406г.
1.14. Какую массу гидроксида кальция надо прибавить к 275л воды, чтобы устранить ее карбонатную жесткость, равную 5,5 мэкв/л? Ответ: 56,06г. 1.15. Какую массу гидроксида кальция необходимо прибавить к 275 л воды, чтобы устранить ее карбонатную жесткость, равную 5,5 мэкв/л? Ответ:56,06 г Лабораторная работа № 11 Полимеры Введение Среди многочисленных веществ, встречающихся в природе, резко выделяется группа соединений, отличающихся от других особыми физическими свойствами, высокой вязкостью растворов, способностью образовывать волокна, пленки и т. д. Строение и природа этих соединений выяснена сравнительно недавно. После длительной научной полемики было установлено, что эти вещества состоят из молекул – гигантов, из макромолекул и получили общее название высокомолекулярных соединений (ВМС). ВМС (полимерами), называются сложные вещества с большими молекулярными массами и построенные из множества повторяющихся элементарных звеньев-мономеров путем химического соединения между собой. Полимерные вещества внедрились во все сферы человеческой деятельности - технику, здравоохранение, быт. Ежедневно мы сталкиваемся с различными пластмассами, резинами, синтетическими волокнами. Широкое внедрение полимеров в производство деталей устройств, механизмов и орудий лова требует от инженеров четких знаний и свойств полимеров для их грамотного, научно обоснованного использования в современной технологии. В соответствии с химическими законами свойства полимеров не зависят от метода их получения, а определяются только внутренним строением макромолекул, поэтому современный квалифицированный специалист должен знать физико-химические свойства полимеров и уметь использовать их на практике. 1. Цели и задачи лабораторной работы Формирование представления о строении и физико-химических свойствах высокомолекулярных соединений. В процессе подготовки и проведении учебно-исследовательской работы необходимо:
2.Теоретическая часть 2.1. История развития науки о полимерных материалов Первые упоминания о синтетических полимерах относятся к 1838 (поливинилхлорид) и 1839 (полистирол). Ряд полимеров, возможно, был получен еще в первой половине 19 века. Но в те времена химики пытались подавить полимеризацию и поликонденсацию, которые вели к “осмолению” продуктов основной химической реакции, т.е. к образованию полимеров (полимеры и сейчас часто называют “смолами”). В 1833 И.Берцелиусом для обозначения особого вида изомерии впервые был применен термин “полимерия”. В этой изомерии вещества (полимеры), имеющие одинаковый состав, обладали различной молекулярной массой, например этилен и бутилен, кислород и озон. Однако этот термин имел несколько другой смысл, чем современные представления о полимерах. “Истинные” синтетические полимеры к тому времени еще не были известны. А.М.Бутлеров изучал связь между строением и относительной устойчивостью молекул, проявляющейся в реакциях полимеризации. После создания А.М.Бутлеровым теории химического строения возникла химия полимеров. Наука о полимерах получила свое развитие главным образом благодаря интенсивным поискам способов синтеза каучука. В 30-х годах было доказано существование свободнорадикального и ионного механизмов полимеризации. С начала 20-х годов 20 века Г.Штаудингер стал автором принципиально нового представления о полимерах как о веществах, состоящих из макромолекул, частиц необычайно большой молекулярной массы. До этого предполагалось, что такие биополимеры, как целлюлоза, крахмал, каучук, белки, а также некоторые синтетические полимеры, сходные с ними по свойствам (например, полиизопрен), состоят из малых молекул, обладающих необычной способностью ассоциировать в растворе в комплексы коллоидной природы благодаря нековалентным связям (теория “малых блоков”). 2.2. Классификация полимерных соединений 1) По происхождению: Природные (белки, нуклеиновые кислоты, смолы природные); Модифицированные (целлулоид, ацетилцеллюлоза); Синтетическте (лавсан). 2) По строению цепи атомов в составе макромолекул полимеров: Линейные, разветвленные, сетчатые, пространственные. 3) По состоянию основной цепи: Карбоцепные (с углеродом), гетероцепные (с кислородом, серой, азотом), неорганические (не содержат органики), элементорганические СН3 СН3 - - О – Si – O – Si - n- CH3 CH3 4) По отношению к нагреву: Термопластичные – при нагревании переходят в вязкопластичное состояние, а при охлаждении затвердевают. Термореактивные – при нагревании цепи полностью разрушаются. 5) По типу реакции получения полимеров: Полимеризационные – при образовании которых не выделяется простых молекул; Поликонденсационные – при образовании которых выделяются простые молекулы (Н2О, НCl и др.) 2.3.Получение полимеров Синтетические полимеры получают в результате реакций полимеризации и поликонденсации. Полимеризация — это процесс соединения друг с другом большого числа молекул мономера за счет кратных связей (С = С, С = О и др.) или раскрытия циклов, содержащих гетероатомы (О, N, S). При полимеризации обычно не происходит образования низкомолекулярных побочных продуктов, вследствие чего полимер и мономер имеют один и тот же элементный состав, Для реакции полимеризации характерны три стадии: инициирование, рост цепи и обрыв цепи:
Полимеризация может инициироваться катионами или анионами (ионами). Ионная полимеризация включает те же стадии (инициирование, рост цепи, обрыв цепи). Инициаторами анионной полимеризации обычно служат электронодонорные соединения (щелочные металлы, их алкоголяты и т. д.). Инициаторами катионной полимеризации могут быть H+, неорганические апротонные кислоты SnCl4, AlCl3, металлоорганические соединения Al(C2H5)3. Полимеризацией получают полиэтилен, поливинилхлорид, полиизобутилен, полистирол, полиакрилаты и другие полимеры, широко применяемые в технологии строительных материалов. Различают цепную и ступенчатую полимеризацию. При цепной полимеризации образуемая макромолекула сразу же приобретает конечные размеры, т. е. не возрастает при увеличение длительности процесса. С увеличением продолжительности реакции растет лишь число макромолекул полимера, мономер расходуется постепенно. Реакцией цепной полимеризации получают такие полимеры, как полипропилен, полиэтилен, полистирол и т. д. Ступенчатая полимеризация осуществляется путем постепенного, ступенчатого присоединения молекул мономера, которое сопровождается перемещением какого-либо подвижного атома или группы атомов от одних молекул к другим. Реакцией ступенчатой полимеризации получают ограниченное число полимеров, таких как поликапроамид, полиформальдегид, полиуретаны и др. Поликонденсация — зто процесс соединения друг с другом молекул одного или нескольких мономеров, содержащих две и более функциональные группы (ОН, СО, СОС, NHS и др.) способные к химическому взаимодействию, при котором происходит отщепление низкомолекулярных продуктов. Полимеры, получаемые поликонденсационным способом, по элементному составу не соответствуют исходным мономерам. Типичная реакция поликонденсации лежит в основе получения фенолформальдегидных смол
или полиэфирных соединений Многие полимеры нельзя получить ни полимеризацией, ни поликонденсацией, поскольку или неизвестны исходные мономеры, или мономеры не образуют высокомолекулярных соединения, синтез таких полимеров осуществляют, исходя из высокомолекулярных соединений, макромолекулы которых содержат реакционноспособные функциональные группы. По этим группам полимеры вступают и те же реакции, что и содержащие такие группы низкомолекулярные соединения. Реакции в цепях полимера могут происходить без существенного изменения молекулярной массы полимера (так называемые полимер-аналогичные превращения), с увеличением молекулярной массы полимера (синтез привитых и блок сополимеров) или с уменьшением молекулярной массы (деструкция макромолекул). | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

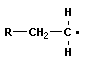
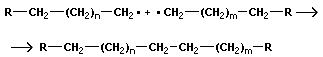
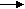 n СН2О
n СН2О + n Н2О
+ n Н2О