ппп. мироздание фурса. Мысли мудрецов востока
 Скачать 3.29 Mb. Скачать 3.29 Mb.
|
Атом: энергетические уровни, спектр Уже в XIX в. было известно, что спектр излучения атомарного водорода представляет собой серию резких, хорошо разрешённых линий. Затем благодаря работам Дж. Том со на, Резерфорда, Бора 344 стала ясна структура атомов. Установлено, что атом состоит нэ ядра, образованного положительно заряженными частицами (протонами) и нейтронами, которые окружены отрицательно заряженными частицами, электропамп. Простейшая такая система - атом водорода - состоит из одного протона и одного электрона. Электрон - волновой пакет, связан с ядром электрическими силами притяжения и локализуется в строго определённых зонах вокруг ядра, называемых орбпталямп. Формы орбиталей определены теоретически с помощью волновых уравнений Эрвина Шрёдингсра. Решение этих уравнении даёт вероятностную картину распределения электронной плотности в атоме, молекуле. Поменять орбпталь, перейти с одного энергетического уровня на другой электрон может, поглотив (или излучив) квант электромагнитной энергии; частота излучения должна соответствовать разности в энергии уровнен, участвующих в переходе, v = (£, -£,)//г. Наиболее устойчивое (основное) состояние (я = I) характеризуется минимальной энергией. Физическая природа этого явления такова, что, когда п увеличивается, электрон удаляется от ядра и становится менее прочно с ним связанным. В пределе п стремится к бесконечности, электрон становится свободным, а атом переходит в ионизированное состояние. В большинстве случаев для возбуждения атома необходима энергия в интервале от 300 до 750 кДж/моль; для такого возбуждения требуется видимый пли ультрафиолетовый свет. Как только атомы возвращаются в основное состояние, энергия излучается - наблюдаются т.н. эмиссионные спектры. Вероятности индуцированных переходов в обоих направлениях одинаковы, а число переходов с одного уровня на другой определяется вероятностью перехода, умноженной на число атомов, находящихся иа данном уровне. Система атомов, находящаяся в тепловом равновесии, всегда поглощает, наблюдаются т.н. спектры поглощения. Величина поглощаемой энергии пропорциональна разности населённостей уровней, участвующих в переходе. Переходы подчиняются правилам отбора; переходы есть разрешённые и запрещённые, точнее, имеющие большую или меньшую вероятность. А это значит, что переходы не могут происходить между любыми уровнями энергии в атоме (молекуле) даже если имеется излучение подходящей частоты. Таким образом, каждый атом имеет характерную для него систему энергетических уровней и определяемые правилами отбора липни поглощения и испускания, являющиеся своеобразными «папиллярными линиями» данного атома. По этим линиям 345  атом водорода, например, легко идентифицировать и в спектре, полученном в лаборатории на Земле, и в спектре излучения Солнца. атом водорода, например, легко идентифицировать и в спектре, полученном в лаборатории на Земле, и в спектре излучения Солнца.Атом водорода. На рис. 10 в качестве примера показаны энергетические уровни атомарного водорода. Водород - протон, «окутанный облаком» единственного электрона, - первый в ряду химических элементов, самый простом по физическому устройств у и самый распространённый элемент в мироздании. В молекуле водорода (Ы2) - два атома, спины электронов которых противоположно направлены (всё тот же принцип Паули) (см. рис. 5). Полный спиновый момент молекулы равен нулю. На самом простом элементе покажем, на какие частоты эВ ^„liiiiiiiiiiiiiiiiiiiiiiiiiiffliiiiiiiiiiiiiiiiiii о - 0,28 -0,38 -0,54 " " 0,85 --1,51 ...ш --3,40 £, т- £, .-13,63 Рис. !0. Энергетические уровни в спектре атомарного водорода. Для справки: h v = £,-£,; I эВ = 1,6-10"19 Дж. Для удаления электрона с низшей орбиты (п = 1) в бесконечность необходима энергия Е = —2,18- 10ч* Дж = —13,63 эВ 346 электромагнитного излучения извне будет откликаться атом водорода, а при определённых условиях - также излучать. Первое возбуждённое состояние атома водорода отстоит от основного состояния па 10 эВ. На самом деле основное состояние водорода не определяется одним значением энергии. У электрона и протона есть спины, и эти спины ответственны за сверхтонкую структуру основного состояния. Основное состояние оказывается расщеплённым на несколько почти одинаковых уровней. Когда мы говорим «основное состояние» водорода, мы имеем в виду «четыре основных состояния», а не просто самое низкое из них. Сверхтонкое расщепление вызывается взаимодействием магнитных моментов электрона и протона; оно приводит для каждого спинового состояния к слегка отличающимся магнитным энергиям. Эти сдвиги энергии составляют только около 10-миллионной части эВ, что действительно много меньше 10 эВ. Из-за столь большого разрыва в энергетическом спектре мы вправе считать основное состояние водорода «четырёхуровневой системой». При наложении внешнего электрического поля ничего интересного не происходит: все уровни сдвигаются на некоторую постоянную величину. Важно магнитное поле. Оно изменяет энергию электрона и протона пропорционально их магнитным моментам. А они разные: магнитный момент протона положительный (по отношению к полю) и почти в 1000 раз меньше магнитного момента электрона (отрицательный). Когда магнитного поля нет, то получается одна спектральная линия от сверхтонкой структуры водорода (рис. 11). Переходы между 4-м состоянием и любым из остальных трёх происходят с поглощением или испусканием фотона с частотой 1420 МГц. Излучение на этой частоте (длина волны 21 см) приходит к нам из Космоса: оно излучается (поглощается) атомарным водородом Галактики. Но в магнитном поле у атома линий получается больше. Могут происходить переходы между любыми из четырёх состояний. Значит, если мы имеем атомы во всех четырёх состояниях, то энергия может поглощаться (пли излучаться) в любом из шести переходов, показанных на рисунке вертикальными стрелками. Но для этого (об этом мы узнаем позднее), наряду с внешним магнитным полем, потребуется малое возмущающее поле, которое меняется во времени и представляет собой вращающееся (или осциллирующее) электромагнитное поле в плоскости, перпендикулярной направлению внешнего магнитного поля. 347 "-ЯГ  Н
Рис. II. Диаграмма ypOBEieii энергии основного состояния атомарного водорода: а) в отсутствие внешнего магнитного поля; б) в слабых магнитных полях; в) в сильных магнитных нолях. / = из/2к (142040575 1,800 + 0,0028) Гц Молекула: энергетические уровни, спектр Атомы ассоциируются в молекулы с помощью т.н. химических связен (ионных, ковалентных и др.). Все они имеют электромагнитную природу. Подобно атомам, у которых электронные облака - орбитали, благодаря своей пространственной организации электромагнитному взаимодействию, удерживают протоны и нейтроны, и организуют их в самостоятельные в физико-химическом отношении микроскопические элементы материи, в молекулах - электронные облака, главным образом внешние, валентные орбитали, участвующие в объединении атомов, перестраиваются и создают новые молекулярные орбитали, организуя атомы в качественно новые, более сложные образования. Так же, как и атомы, молекулы имеют характерную систему энергетических уровней, могут избирательно поглощать и испускать кванты электромагнитных волн, изменяя при этом энергетическое состояние молекулы. Спектр энергетических уровней сложнее за счёт вклада в энергетику колебательного и вращательного движении молекулы. В молекуле мы имеем дело с тремя видами переходов: электронными, колебатель- 348 нымн и вращательными, поэтому полная энергия системы рассматривается как сумма трёх независимых энергий: электронной, колебательной и вращательной. Рис. 12 и 13 дают представление о соотношении энергетических состояний двухатомной молекулы. Электронная, колебательная и вращательная системы уровней взаимодействуют с электрическим компонентом падающего электромагнитного излучения. Изменение в электронном состоянии молекулы происходит при возбуждении связывающего или несвязывающего электрона от основного состояния до вакантной молекулярной орбитали более высокого порядка. Энергии, необходимые для электронных переходов, обычно соответствуют дальнему ультрафполету, ультрафиолету, видимому и ближнему инфракрасному диапазонам спектра в зависимости от энергии молекулярных орбиталей в молекуле. Молекулам, содержащим только прочные а-связп (Н2О, СМ.,), для электронных переходов требуется энергия дальнего ультрафиолета. Для молекул, например, красителей, имеющих сопряжённые л-связп, требуется видимый свет. Первое возбужденное электронное состояние Колебательные состояния Основное электронное состояние ,: Вращательные состояния Рис. 12. Энергетическая диаграмма двухптомной молекулы: а, б— примеры переходов электронов из основного электронного состояния на колебательные уроним первого возбуждённого состояния 349  Первое возбужденное электронное состояние пние) Основное электронное состояние Колебательные состояния
(М щерн* Рис. 13. Диаграмма потенциальной энергии основного и одного из возбуждённых электронных состояний двухатомной молекулы; изображены также соответствующие колебательные уровни v0, vt, v±, i^ Электронные переходы обычно сопровождаются изменениями энергии колебании и вращении, в то время как электронная энергия системы при колебаниях ядер не меняется. В результате при электронных переходах обнаруживается (проявляется) тонкая колебательная структура. В колебательном спектре происходят переходы до различных вращательных уровней. Вращательная тонкая структура.при колебательных переходах обычно наблюдается в спектрах газов, а иногда и в спектрах жидкостей. Для большинства соединений почти все молекулы при комнатной температуре находятся в основном состоянии, поскольку разность между основным и возбуждённым колебательными уровнями в основном электронном состоянии намного превышает кТ (тепловую энергию), которая при 300 К имеет величину 200 см"1. Для электронного перехода необходимо время порядка 10"ь с. Поскольку электронный переход очень быстр, молекула в возбуждённом состоянии будет иметь ту же самую молекулярную конфигурацию и колебательную кинетическую энергию, как и в момент поглощения фотона 350 в основном состоянии; во время перехода расстояние между ядрами не меняется. Общего правила отбора, которое налагало бы ограничения на изменения в колебательном состоянии, сопровождающие электронный переход, не существует. Колебательные уровни. Для того чтобы молекула поглощала энергию электромагнитной волны при взаимодействии с электрическим компонентом последней, помимо выполнения требования, налагаемого на длину волны (т.е. энергию) излучения, должно удовлетворяться ещё одно условие: переход в молекуле обязан сопровождаться изменением положения электрического центра молекулы, т.е. выполняться работа. Колебательные энергетические состояния характеризуются направлениями, частотами п амплитудами движений атомов в молекуле. Атомы в молекуле колеблются относительно центра масс, что исключает их поступательное движение. При колебании изменяется длина связи. Спектр колебаний зависит от числа внутренних степеней свободы, которые могут принимать энергию независимо друг от друга. Правила отбора как раз и определяют переходы, для которых выполняется указанное условие, и таким образом разделяют переходы на разрешённые и запрещённые, хотя более правильно говорить о вероятности переходов: более вероятные переходы характеризуются большей интенсивностью линии поглощения. Запрещённые переходы имеют малую вероятность и характеризуются низкой интенсивностью. Поскольку большинство молекул находятся на основном колебательном уровне, все переходы, которые приводят к появлению полосы в спектре поглощения, происходят с основного уровня. Колебательные переходы возбуждаются низкоэнергетическим инфракрасным излучением. Вращательные уровни. Вращательные состояния соответствуют квантованным молекулярным вращениям вокруг оси без заметного изменения длин связей или валентных углов; они отвечают разным угловым моментам вращения или вращению вокруг разных осей. Можно наблюдать чисто вращательный спектр вещества, но нельзя чисто колебательный. Для каждого данного колебательного уровня молекулы имеется целый набор вращательных уровней. Их можно наблюдать при высоком разрешении (рис. 14). По энергиям вращательные переходы соответствуют дальнему ИК-излучению и излучению в микроволновом диапазоне. Измерения в микроволновом диапазоне позволяют исключительно точно определять частоты переходов. Точность измерений в этом диапазоне мо- 351  жет достигать 10"" см"1. Наработаны таблицы частот для нескольких сотен различных соединений, которые включают тысячи линий, охватывающих диапазон в 200 000 МГц с разрешением лучше 0,25 МГц. В И1С-дпапазопе можно разрешить две полосы, соответствующие различным частотам, если они разделены 0,1 см*'. Форма спектральной линии зависит от скорости протекания процессов. При наличии физического пли химического процесса, протекающего за время, значительно меньшее времени жизни возбуждённого состояния, линия уширяется. жет достигать 10"" см"1. Наработаны таблицы частот для нескольких сотен различных соединений, которые включают тысячи линий, охватывающих диапазон в 200 000 МГц с разрешением лучше 0,25 МГц. В И1С-дпапазопе можно разрешить две полосы, соответствующие различным частотам, если они разделены 0,1 см*'. Форма спектральной линии зависит от скорости протекания процессов. При наличии физического пли химического процесса, протекающего за время, значительно меньшее времени жизни возбуждённого состояния, линия уширяется. %t пропускания  3100 3050 3000 2950 2900 2850 2800 2750 2700 2650 2600 СМ Рис. 14. Спектр поглощения газообразного HCI О механизме излучения До сих пор мы имели в виду процессы поглощения, хотя и упоминали о том, что с равной вероятностью могут идти и процессы излучения. Если при возбуждении молекулы светом не происходит химической реакции и энергия не рассеивается в среду путём соударений с другими частицами, то молекула может вернуться в основное состояние путём освобождения фотона энергии. Это явление называется люминесценцией. Люминесценция, по СИ. Вавилову, представляет собой избыточное над температурным световое излучение с длительностью, значительно превышающей период световых колебаний. По типу возбуждения люминесценцию подразделяют на фото-, реитгено-, электро-, хемо-, триболюминесценшпо. Важно, что спектр свечения не зависит от вида возбуждения. В формировании спектра люминесценции главную роль играет не тип и характер воздействия, а химический состав и 352 структура вещества-преобразователя. Диапазон частот электромагнитных колебаний, преобразуемых люминофорами в видимый свет, огромен: от постоянного электрического и магнитного полей (/ = 0) до Y- излучения (/ = 102Г1 Гц). При люминесценции возможны два пути освобождения энергии возбуждённой молекулы - путём флуоресценции и путём фосфоресценции. Спектр флуоресценции представляет собой зеркальное отображение спектра поглощения с небольшим сдвигом флуоресценции в сторону более длинных волн по сравнению с поглощением. Время затухания или время жизни флуоресцентного состояния - около 10"9-10"5 с при длительности колебания около 10"ы-10"13 с. При этом большая часть колебательной энергии рассеивается в виде тепла. Фосфоресценция представляет собой другой, более сложный путь возврата возбуждённой молекулы в основное состояние с испусканием света. Часть энергии растекается в виде безызлучательных переходов по соседним уровням. Поэтому фосфоресценция характеризуется существенно большими временами затухания, чем флуоресценция: от 10"3 до нескольких секунд. В арсенале природы имеется процесс, прямо противоположный фотосинтезу: генерация света при химических реакциях - хамияюлт-песценцип. В этом случае мы имеем дело с превращением химической энергии в световую. В процессе химической реакции образуется одно или несколько промежуточных соединений в электронно-возбуждённом состоянии, которые в состоянии испускать свет путём флуоресценции. Известно большое число хемилюминесцентных соединений, К наиболее изученным системам относится реакция окисления люми-нола. Если люминал обработать щелочью, перекисью водорода и фер-рициаипдом калия, то наблюдается интенсивное голубое свечение. Другой пример хемилюминесценцпи - испускание красного и зелёного света возбуждёнными атомами кислорода в газовой фазе. Подобное явление наблюдается и в живой природе. Многие организмы, включая ряд бактерий, грибов, кораллов, моллюсков, насекомых, обладают способностью излучать свет. Это явление называется биолюминесценцией. Из них нам лучше всего знакомы, несомненно, светлячки. Секрет их свечения связан с таким химическим процессом, как окисление органического вещества - тоциферииа. Превращение химической энергии в световую происходит здесь с исключительно большим к.п.д., порядка 50-80%. Один вид светлячков испускает свет в желто-зелёном участке 13 3ак. 3066 353  спектра, тогда как другие - в более длинноволновой области. Различия в окраске свечения, как полагают, обусловлены особенностями фермента люг/иферазы, структура и (или) конформаиия которого могут варьироваться от вида к виду. Любопытно, что длина волны излучения зависит от рЫ среды. Лесной светлячок - один из многих примеров, заставляющих нас удивляться той изобретательности, с какой природа решает свои энергетические проблемы. спектра, тогда как другие - в более длинноволновой области. Различия в окраске свечения, как полагают, обусловлены особенностями фермента люг/иферазы, структура и (или) конформаиия которого могут варьироваться от вида к виду. Любопытно, что длина волны излучения зависит от рЫ среды. Лесной светлячок - один из многих примеров, заставляющих нас удивляться той изобретательности, с какой природа решает свои энергетические проблемы.Когда квант света сталкивается с молекулой и рассеивается с той же частотой, мы имеем дело с рэлеевааш рассеянием. В этом случае, если молекула находится в поле действия электрического вектора излучения, индуцируется дипольный момент, и электроны вынуждены осциллировать с той же частотой, что и частота падающего излучения. Осциллирующий диполь излучает энергию во всех направлениях и отвечает за рэлеевское рассеяние. Различие между люминесценцией и рассеянием имеет тонкий характер и определяется временем жизни частиц, образовавшихся в ходе столкновения фотона с молекулой. В первом случае мы имеем дело с т.н. упругим столкновением фотона с молекулой. При неупругом столкновении, комбинационном рассеянии, когда молекула в основном состоянии получает энергию от рассеиваемого фотона, возбуждающего еб до более высокого колебательного состояния, энергия рассеиваемого кванта уменьшается на величину энергии перехода. Когда же излучение падает на возбуждённую молекулу, последняя отдаёт фотону энергию, равную энергии перехода, и возвращается в основное состояние; энергия рассеиваемого кванта увеличивается на величину энергии перехода. На спектре по обе стороны от частоты падающего излучения будут две эквидистантные (равноотстоящие) линии: стоксовская и анптстоксовская. В виде рэлеевского рассеяния проявится около 103 интенсивности падающего света и только около 106 - в виде комбинационного рассеяния. Лазер (мазер). При облучении молекул светом вероятность индуцированного перехода одинакова и для поглощения, и для испускания. В условиях стационарного освещения скорости поглощения и испускания должны быть равны, и в условиях теплового равновесия заселённость верхнего уровня никогда не может быть больше, чем заселённость нижнего уровня. Если же тем или иным способом повысить заселённость верхнего уровня, не прибегая к обычным излучательным процессам, то можно получить инверсную заселённость, т.е. такую 354 ситуацию, когда на верхнем уровне накапливается частиц больше, чем на нижнем. Среда с инверсной заселённостью уровней может усиливать падающее на неё излучение. В этом случае облучение системы одним фотоном подходящей частоты вызовет стимулированное испускание целого ансамбля частиц. При организации в системе положительной обратной связи она способна генерировать монохроматическое излучение. На этом принципе построена работа лазера (мазера), Магнитные уровни Мы рассмотрели системы электронных, колебательных, вращательных энергетических уровней. Их объединяет та особенность, что они взаимодействуют с электрическим компонентом электромагнитного излучения. Ниже речь пойдёт о другой, ещё более тонкой и поэтому более информативной системе энергетических уровней, которые в природе в отсутствие магнитного поля не существуют. Точнее, природой они для чего-то предусмотрены, но энергетически вырождены и проявляют себя только в присутствии магнитного поля, - наблюдается так называемое зеемановское расщепление уровней. Происходит это благодаря тому, что многие частицы, в том числе электроны, протоны и другие, в силу определённых природных качеств обладают магнитным моментом и поэтому будут эффективно взаимодействовать с внешним магнитным полем и магнитным компонентом падающего на них электромагнитного излучения. Это означает, что энергетические спектры ядер, атомов и молекул существенно усложняются во внешнем магнитном поле, дополняются магнитными уровнями, в результате чего качественно изменяется картина взаимодействий. Частицы, обладающие магнитным моментом, помещённые в постоянное магнитное поле и облучённые электромагнитным излучением соответствующей частоты, будут поглощать энергию резонансным образом. Это явление получило название магнитного резонанса: ядерного магнитного резонанса (ЯМР) - для ядер; электронного парсшагпиптого резонанса (ЭПР) - для электронов. Протонный [Н резонанс, резонанс на ядрах l9F, I3C, 3|Р, а также на ядрах ' В, I7O,I5N, 59Co содержит важную информацию о биохимических процессах. Электроны в большинстве молекул, согласно принципу Паули, образуют пары, что приводит к компенсации результирующего магнитного момента, поэтому наблюдать ЭПР не удаётся. Лишь немногие 355 молекулы, например О2, NO, NO2, CI2O , содержат один или несколько неспаренных электронов в своём основном устойчивом состоянии, и для всех таких молекул наблюдается спектр ЭПР. Однако это наиболее активные в химическом отношении соединения. Так называемые сво-боднорадикальные реакции имеют отношение практически ко всем жизненно важным биохимическим процессам. Неспаренные электроны имеются в ионах переходных металлов, таких как Fe3+, Mn"', Cu"+... Этот факт также играет важную роль в биохимии, так как парамагнитные ионы входят в состав многих белков и ферментов. Спектры магнитного резонанса весьма чувствительны к окружению и состоянию атомных и молекулярных систем. На рис. 15 приведены схема расщепления энергетических уровней в магнитном поле (й) и спектр ЯМР этанола С2Н5ОН (а). он гндрокснлышп группа сн, сн, етнлсновая метальная 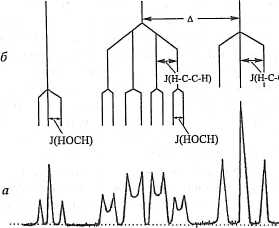 группа группа Рис. 15. Протонный спектр ЯМР этанола С2Н5ОН (а) и диаграмма энергетических уровнен в поле Но (б): Д - химический сдвиг, обусловленный экранировкой ядер электронами (зависит от величины Wo). J - константа спнн-спниового расщепления, обусловлена влиянием магнитных моментов соседних ядер (от напряжённости магнитного поля Но не зависит). Площадь, ограниченная спектральными полосами, прямо пропорциональна числу эквивалентных атомов водорода; соотношение площадей у групп - 1:2:3 356 В ЯМР разрешение составляет порядка 0,1 Гс (10 'с '). Метод позволяет измерять процессы с временем жизни 10^'-105 с. Уширеиие спектральных линий может вызвать процесс со временем жизни частиц около 2 с (или ниже) или с константой скорости (частотой) порядка 0,5 с*1 (или выше). Метод ЭПР позволяет измерять процессы с временем жизни 10"4—10 а с. Эффект Штаргса. Сильные внешние электрические поля, воздействуя на электрические дипольные моменты молекул, квадрупольные моменты ядер, также расщепляют энергетические уровни. Величина расщепления пропорциональна произведению момента на напряжённость электрического поля. Это так называемый эффект Штарка. Здесь возможен канал влияния статического электричества на биохимические процессы в живой материи. До сих пор мы вели разговор о структуре энергетических уровней атомов и молекул. Для полноты картины укажем, что протоны и нейтроны в ядрах также имеют свои системы энергетических уровней, потому что, как мы уже говорили, квантование - это фундаментальное свойство материального мира1. А что представляет собой спектральная картина энергетических уровней целого организма - трудно себе вообразить! Представление о ней не будет полным, даже если суммировать все имеющиеся экспериментальные данные. Не все те явления, которые происходят в живом организме, доступны для измерения существующими приборами, как вследствие ограниченных возможностей последних по чувствительности и разрешающей способности, так и в силу невозможности воспроизвести в пробирке реальную жизненную ситуацию. Мы не можем заглянуть во внутренний мир метки. Известно только, что клетки излучают, а для чего? Значит, имеются и приёмники этого излучения. А вот влиять на эти процессы мы вольно или невольно умеем, во зло или во благо - не знаем... Живой организм — полирезонансная электромагнитная система Итак, непреложный факт состоит в том, что все тела при температуре выше абсолютного нуля излучают (поглощают) в широком диапазоне частот. Обмен энергией как внутри системы, так и с окружающей средой идёт непрерывно. Работает слаженный механизм, тонкая многоуровневая система. Акты поглощения и испускания происходят в невероятном темпе и количествах - исключительно динамический процесс. Правильнее | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
