Нереспираторные функции лёгких. Нереспираторные функции легких
 Скачать 3.54 Mb. Скачать 3.54 Mb.
|
|
ГЛАВА 6. ФИЗИОЛОГИЧЕСКАЯ РОЛЬ ЛЕГКИХ В ОБЕСПЕЧЕНИИ ВЫНАШИВАЕМОСТИ БЕРЕМЕННОСТИ Нами, совместно с нашим диссертантом В.В. Мясниковой, в 2002 году высказано предположение о наличие физиологической функциональной системы «легкие-плацента» у беременных женщин. С учетом биологической значимости детородной функции женщин функциональные взаимоотношения между плацентой и легкими приобретают особо важное значение в период вынашиваемости беременности. Данные, полученные нами при исследовании возможных функциональных взаимосвязей между плацентой и легкими у беременных с физиологической и осложенной беременностью, подтверждают выдвинутое нами предположение. Проиллюстрируем это на научных фактах. Гиперкоагуляция во время беременности имеет эволюционно-физиологический смысл, заключающийся, с одной стороны, в создании иммунологической толерантности материнского организма к растущему в нем плоду, с другой — в обеспечении быстрой остановки кровотечения во время родов после отделения плаценты. В процессе беременности одновременно с возрастанием коагуляционного потенциала включаются механизмы, обеспечивающие нормальные реологические свойства крови, притекающей к плаценте. Кровь, поступающая в межворсинчатое пространство, не сворачивается благодаря существованию тромболитической системы плаценты Следующим фильтром, куда попадает кровь, оттекающая от плаценты, является эндотелий капилляров малого круга кровообращения Функциональная взаимосвязь плаценты и легких определяется, кроме того, тем влиянием, которое оказывают гормоны, синтезируемые фетоплацентарным комплексом (прогестерон, эстрогены, плацентарный лактоген), на гемокоагуляционный потенциал и механизмы его регуляции. Известно общее протекторное влияние прогестерона. Так, предполагается, что прогестерон предотвращает тромбообразование в межворсинчатом пространстве на этапе имплантации и плацентации. Эстрогены, напротив, способствуют возрастанию коагуляционного потенциала. Ряд гормонов фетоплацентарного комплекса (пролактин, кортизол) участвуют в регуляции продукции легочного сурфактанта, в фетоплацентарной осморегуляции. Учитывая известное биохимическое сходство этих структур, возможна и общность механизмов регуляции. Таким образом, можно предположить, что не только легкие оказывают регулирующее воздействие на реологию маточно-плацентарного кровотока, но и работа фибринолитического фильтра легких зависит от влияния гуморальных стимулов плаценты. Наличие такого взаимодействия предполагает существование функциональной системы легкие-плацента. Целью нашей работы было рассмотрение физиологической системы легкие-плацента, ее роли в обеспечении гормонального и коагуляционного гомеостаза, выявление взаимообусловленных реакций, обеспечивающих нормальный маточно-шицентарный кровоток и развитие беременности. Обследовано 36 женщин с хронической фето-плацентарной недостаточностью (ХФПН), из них 22 женщины со сроком гестации 28-34 нед. и 14 со сроком 35-40 нед. составили опытную группу. В контрольную группу включены 19 женщин с неосложненной беременностью: 12 женщин со сроком гестации 28-30 нед. и 7 со сроком 35-36 нед. Для оценки состояния фетоплацентарного комплекса и влияния легких на гормональный и коагуляционный гомеостаз определяли содержание гормонов и показатели гемостаза в венозной и артериальной крови у 18 беременных с ХФПН и у женщин контрольной группы. Содержание прогестерона, кортизола, тиреотропного гормона (ТТГ), трииодтиронина (Т3), тироксина (Т4) в крови определяли иммуноферментным методом с помощью тест-набора "СтероидИФА-прогестерон" ("Алкор Био"). Гемостазиологическое исследование включало определение времени свертывания крови по Ли-Уайту, времени рекальцификации плазмы, протромбинового индекса, количества фибриногена весовым методом. Диагноз фетоплацентарной недостаточности, степень гипоксии плода определяли на основании УЗИ матки и плода, допплерометрии сосудов пуповины, кардиотокограммы (КТГ) плода. Достоверность различий оценивали с применением критерия Вилкоксона, коррелляция - по Спирмену. В опытной группе наиболее частыми экстрагенитальными заболеваниями, на фоне которых развивалась ХФПН, были: нейроциркуляторная дистония по гипертоническому или гипотоническому типу (25%), заболевания щитовидной железы (19.4%); урогенитальная инфекция (19.4%); уфоза прерывания (19.4%), плацентит (44%), поздний гестоз (33%), много- или маловодие (33%). По данным КТГ плода обнаружены признаки гипоксии плода различной степени тяжести у всех беременных с ХФПН. Лечение включало традиционную медикаментозную терапию (коррекция реологии, курсы метаболической терапии, по показаниям - противовоспалительная и антибактериальная терапия), а также лазеротерапию. Утолщение плаценты у беременных с ХФПН обусловлено развитием плацентита, диагностируемого по данным УЗИ, в 75% случаев сопровождающегося лейкоцитозом и палочкоядерным сдвигом. Кроме того, у женщин с ХФПН выявляется тенденция к гиперфибриногенемии по сравнению с контрольной группой (табл. 1). Известно, что по мере прогрессирования беременности нарастает коагуляционный потенциал крови. Так, была выявлена достоверная обратная корреляция между временем свертывания по Ли-Уайту и сроком гестации (r=-0,7,p<0,05). Таблица . Показатели гормонального и коагуляционного гомеостаза при неосложненной беременности и у беременных с ХФПН {М±т}
Примечание. *р<0,05 по сравнению с контрольной группой соответствующего срока. Таблица Содержание прогестерона и показатели свертывания в артериальной и венозной крови у беременных с ХФПН и в контрольной группе (М±т}
Примечание. р<0.05: *по сравнению с контрольной группой, **со сроком 28-34 нед. Содержание прогестерона в крови также достоверно коррелировало со сроком гестации (г=0.6, р<0.05). Уровень прогестерона у женщин с ХФПН в сроке 31,0±0,5 нед был снижен на 23% по сравнению с контрольной группой и составил 184,9±19,1 нмоль/л (р<0.05). При сроке беременности 36,5±0,4 нед. уровень прогестерона у женщин с ХФПН был на 45% ниже, чем в контрольной группе, и составил 193,0±21,6 нмоль/л (р<0,05). Выявлена достоверная корреляция между уровнем прогестерона как в артериальной (г=-0,77, р<0,05), так и в венозной крови (г=-0,71, р<0,05), и величиной артериовенозной разницы времени свертывания по Ли-Уайту: при снижении продукции прогестерона коагуляционный потенциал артериальной крови начинает превышать коагуляционный потенциал венозной крови, и артериовенозная разница времени свертывания становится отрицательной. В то же время в группе с неосложненной беремен-ностью артериовенозная разница положительна, т.е. время свертывания после прохождения крови через легкие увеличивается (табл. 2). При этом получен более высокий коэффициент корреляции для артериальной крови, в наибольшей степени отражающий выработку этого гормона фетоплацентарным комплексом и последующее прохождение его через легкие. В  группе беременных со сроком 28-34 нед. выявлялась тенденция к гипокоагуляции в венозной крови; на более поздних сроках время свертывания венозной крови по Ли-Уайту уже достоверно изменялось в сторону увеличения по сравнению с аналогичными показателями при неосложненной беременности. При этом у беременных с выраженной гипокоагуляцией наблюдались наиболее низкие показатели КТГ плода: коэффициент корреляции между временем свертывания крови по Ли-Уайту и балльной оценкой КТГ составил -0,62 (р<0,05). В то же время гиперфибриногенемия, сопровождающая развитие плацентита в 50% случаев, отражала как течение воспалительного процесса в плаценте, так и активацию процессов свертывания. Степень гипоксии плода была наиболее выраженной при гиперфибриногенемии: показатели КТГ были связаны отрицательной корреляцией с уровнем фибриногена (г=-0,79, р<0,05). группе беременных со сроком 28-34 нед. выявлялась тенденция к гипокоагуляции в венозной крови; на более поздних сроках время свертывания венозной крови по Ли-Уайту уже достоверно изменялось в сторону увеличения по сравнению с аналогичными показателями при неосложненной беременности. При этом у беременных с выраженной гипокоагуляцией наблюдались наиболее низкие показатели КТГ плода: коэффициент корреляции между временем свертывания крови по Ли-Уайту и балльной оценкой КТГ составил -0,62 (р<0,05). В то же время гиперфибриногенемия, сопровождающая развитие плацентита в 50% случаев, отражала как течение воспалительного процесса в плаценте, так и активацию процессов свертывания. Степень гипоксии плода была наиболее выраженной при гиперфибриногенемии: показатели КТГ были связаны отрицательной корреляцией с уровнем фибриногена (г=-0,79, р<0,05).При исследовании гемостазрегулирующей функции легких при неосложненной беременности наблюдалось гипокоагулирующее их влияние (табл. 2). Время свертывания крови по Ли- Уайту в артериальной крови было выше, чем в венозной (р=0,08). Однако у беременных с ХФПН на фоне гипокоагуляции в венозной крови, не характерной для данного срока беременности, время свертывания в артериальной крови было короче, чем в венозной. При этом время свертывания венозной крови у женщин с ХФПН достоверно отличалось от этого показателя при нормальной беременности (р<0,05). У беременных с ХФПН уровень прогестерона в артериальной крови был достоверно выше его содержания в венозной крови (р<0,05), отражая поступление гормона из фетоплацентарного комплекса, однако не достигал уровня контрольной группы (р<0,05). Достоверное снижение уровня кортизола у женщин с ХФПН со сроком гестации 28-34 нед. и тенденция к его снижению к сроку 35-40 нед. свидетельствует о недостаточной выработке этого гормона надпочечниками плода на фоне хронической внутриутробной гипоксии. Наиболее низкое значение этого гормона (471 нмоль/л) было отмечено у женщины с последующей в течение 2 нед. антенатальной гибелью плода. Нарастание кортизола в крови отмечается на начальных стадиях внутриутробной гипоксии плода, а также при развитии гестоза. Отмечена тенденция к снижению уровня Т3 при развитии ХФПН у женщин на сроке 28-34 нед; на более поздних сроках гестации выявляется уже достоверное снижение этого гормона по сравнению с контрольной группой. Связь выработки Т3 с состоянием плаценты подтверждается достоверной положительной корреляцией между его уровнем и толщиной плаценты (г=0,88, р<0,05). Не обнаружено значительных отличий уровня Т4 в обследуемых группах, однако выявлена корреляция между содержанием этого гормона в артерии и временем свертывания артериальной крови по Ли-Уайту (г=0,53, р<0,05), позволяющая предположить взаимосвязь между механизмами выработки тироксина и факторов внешнего пути свертывания крови (рис. 1). При исследовании ТТГ установлено, что его содержание достоверно коррелировало со сроком беременности (r=0,6, р<0,05). С уровнем этого гормона также связана выработка Т4: между содержанием обоих гормонов выявлена достоверная прямая корреляционная связь (г=0,54, р<0,05). При развитии ХФПН отмечается тенденция к повышению ТТГ, особенно на поздних сроках, но при этом выявляется достоверная обратная корреляция ТТГ с состоянием плода, оцениваемым по данным КТГ: чем выше уровень ТТГ в крови, тем более выражена внутриутробная гипоксия плода (г=-0,5, р<0,05). Кроме того, избыточное содержание ТТГ обнаруживается при угнетении функции надпочечников плода, что подтверждается достоверной обратной корреляцией между содержанием ТТГ и кортизола в артериальной крови (r=-0,7,р<0.05; рис. 2). К 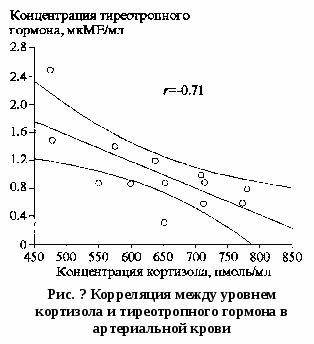 ак коагуляционньгй потенциал крови, так и уровень гормонов, вырабатываемых фетоплацентарным комплексом (прогестерона, кортизо-ла, ТТГ), тесно связаны, в первую очередь, со сроком гестации, а также зависят от состояния плаценты (степени зрелости, толщины, наличия воспаления), развития фетоплацентарной недостаточности, внутриутробной гипоксии плода. С состоянием плода также связаны изменения свертывающей системы - развитие гипер- или гипокоагуляции, гиперфибриногенемии. ак коагуляционньгй потенциал крови, так и уровень гормонов, вырабатываемых фетоплацентарным комплексом (прогестерона, кортизо-ла, ТТГ), тесно связаны, в первую очередь, со сроком гестации, а также зависят от состояния плаценты (степени зрелости, толщины, наличия воспаления), развития фетоплацентарной недостаточности, внутриутробной гипоксии плода. С состоянием плода также связаны изменения свертывающей системы - развитие гипер- или гипокоагуляции, гиперфибриногенемии.Уровень некоторых гормонов (прогестерона, тироксина) коррелирует с изменением коагуляционного потенциала крови, а при исследовании артериовенозной разницы времени свертывания крови выявляется ее зависимость от содержания прогестерона. Таким образом, единство многих физиологических, морфологических, биохимических систем легких и плаценты (участие в синтезе и инактивации эндотелина, тромбоксана и простациклина, поддержание баланса активаторов плазминогена и ингибиторной системы в обоих органах; сходство сурфактанта альвеол и гликокаликса плаценты) позволяет предположить наличие тесной функциональной взаимосвязи между этими двумя органами. Более того, если легкие рассматривать как орган, участвующий в регуляции системы гемостаза, то наличие физиологической системы легкие-плацента очевидно и можно признать доказанным. ЗАКЛЮЧЕНИЕ В настоящее время представление о легких, как органа, обеспечивающего исключительно газообмен, пересмотрено. Достаточно большой «поток» научных статей позволяет говорить об активной метаболической активности легких. Наличие многочисленных ферментов, рецепторов, а также особенности анатомического расположения легких позволяет говорить о важнейшей роли легких, как органа гуморального контроля различных параметров гомеостаза. Многочисленные экспериментальные и клинические данные говорят об участие легких в различных обменах веществ: жировом, липидном, углеводном, белковом. Посредством изменения интенсивности и направленности того или иного вида обмена веществ легкие оказывают большое влияние на поддержание температурного баланса, конденсирующей функции легких, жидкого состояния крови и др. Способность легких депонировать, инактивировать и синтезировать биологически активные вещества (БАВ) обеспечивает влияние легких на функциональную активность других органов и систем. Примером может служить роль ангитензина-II, синтезируемого в легких из ангиотензина-I, в поддержании уровня системного артериального давления. Экспериментальные исследования, проведенные нами, подтверждают активную роль легких в поддержании вводно-солевого обмена во всем организме. В то же время в обеспечении вводно-электролитного баланса в самих легких принимают активное участие целый ряд гормонов и БАВ (ренин, ангиотензин-II, альдостерон, кортизол, T4, инсулин и др.) при активном участии различных отделов центральной нервной системы. В совокупности они представляют из себя нейроэндокринную функциональную систему регуляции вводно-солевого обмена в легких. Клинические данные позволяют подтвердить роль и участие гормонов в обеспечении поддержания водного гомеостаза у здоровых людей, а также при нарушении сократительной функции миокарда. Исследуя указанные взаимосвязи мы пришли к заключению о способности легких к регуляции уровня гормонов в артериальном кровотоке. Конкретные механизмы такой способности легочной ткани еще предстоит выяснить. Оценивая физиологическую роль легких как органа регулятора целого ряда физиологических функций в организме мы не могли не обратить пристальное внимание на участие легких в адаптивных реакциях на одну из важнейших биологически значимых ситуациях – беременность. Предложенная нами и нашими сотрудниками концепция о существовании физиологической системы «легкие-плацента», как нам кажется, имеет под собой теоретические предпосылки, а сегодня фактические доказательства. Беременность сопровождается мощной перестройкой целого ряда функций органов и систем. На фоне возрастающей антигенной нагрузки и роста коагуляционного потенциала активируются, видоизменяется и метаболическая и гормональная функция легких. Конечным результатом такой активации функций легких является улучшение реологических свойств крови, «выравнивание» гормонального фона (кортизола, прогестерона и др.), которые могут снизить иммунный конфликт со стороны матери на плод и обеспечить качественное формирование фето-плацентарного комплекса. Это направление требует дальнейшей разработки и изучения, которое может получить практический результат, направленный на регуляцию процесса формирования фето-плацентарного комплекса. С учетом частоты поражаемости легких при различных патологических состояниях следует предполагать, что нереспираторные функции легких могут нарушаться. Особенно часто поражение легких наблюдаются при терминальных состояниях. Как следствие этого могут нарушаться метаболизм и функции других органов и систем. Новые сведения об изменении нереспираторных функций легких при различных физиологических и патологических состояниях открывает перспективу для целенаправленной коррекции нереспираторных функций легких. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
