Нереспираторные функции лёгких. Нереспираторные функции легких
 Скачать 3.54 Mb. Скачать 3.54 Mb.
|
Таблица 3Показатели концентрации трийодтиронина в артериальной и венозной крови (нМоль/л)в зависимости от выраженности отека легочной ткани (в баллах)
П римечание: *-достоверность p<0,05; **p<0,01; *** p<0,001; pt-достоверность с использованием критерия Стьюдента; pW-критерия Уилкоксона; А- концентрация гормона в артерии; В- концентрация гормона в вене; А-В- артерио-венозная разница концентрации гормона. Таблица 3 (продолжение) Показатели концентрации тиреотропного гормона в артериальной и венозной крови (мМЕ/мл) в зависимости от выраженности отека легочной ткани (в баллах)
П римечание: А- концентрация гормона в артерии; В- концентрация гормона в вене; А-В- артерио-венозная разница концентрации гормона, pt-достоверность с использованием критерия Стъюдента; pW-с использованием критерия Уилкоксона; *-достоверность p<0,05; **p<0,01; *** p<0,001. 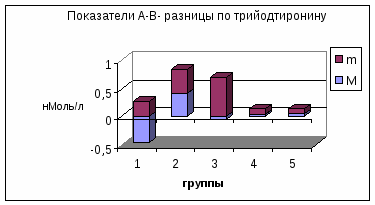  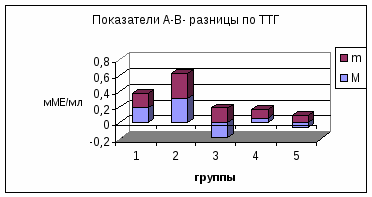 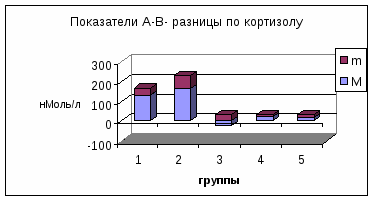 Рис. 3. Сравнительный анализ А-В- разницы у больных разных групп. Примечание: 1 - контрольная группа; 2 - группа умерших; 3 - группа больных (выжившие) с венозным застоем 8-9 баллов (отек легких); 4 - с венозным застоем 6-7 баллов; 5 - с венозным застоем 3-5 балла. При адаптивной форме течения ОИМ (рис.4.2) гормонометаболическая функция легких также сохраняла свои адаптивные возможности по Т3; Т4 и кортизолу, но с иным уровнем функциональной активности. Так, в подтверждение вышесказанного следует отметить, что по трийодтиронину А-В-разница увеличивалась (0,01±0,09 нМоль/л) на фоне достоверно низкой концентрации Т3 в артериальной (1,64±0,1 нМоль/л) и в венозной крови (1,63±0,12 нМоль/л). Создается впечатление, что легкие в данной ситуации выступают в роли органа-депо, способствующего повышению концентрации трийодтиронина в артериальном кровотоке. Относительно тироксина мы не обнаружили изменений в метаболической функции легких, и исследуемые показатели были достоверно неразличимы. Интересные закономерности отмечены нами по тиреотропному гормону в группе больных с неосложненным течением раннего постинфарктного периода. В частности, на фоне достоверно повышенной концентрации ТТГ в артериальной (1,37±0,25 мМЕ/мл) и в венозной крови (1,39±0,22 мМЕ/мл) функция легких, в отличие от здоровых, менялась на противоположную (А-В= -0,02±0,09 мМЕ/мл). В раннем постинфарктном периоде, при адаптивной его форме, стрессовая реакция сопровождалась активацией глюкокортикоидной функции надпочечников с увеличением концентрации кортизола в венозной и в артериальной крови. В этих условиях гормональная активность легких уменьшалась, что сопровождалось «сглаживанием» артерио-венозной разницы. Функция легких по поддержанию определенного уровня гормонов подтверждалась корреляционными зависимостями между исследуемыми параметрами (концентрацией Т3 в артериальной крови и венозной г=0,72; р<0,01; концентрацией Т3 в венозной крови к А-В- разнице г= -0,52; р<0,01; концентрацией ТТГ в артериальной крови и в венозной г=0,93; р<0,01; концентрацией кортизола в артериальной крови и в венозной г=0,89; р<0,01). Между, гормонами, проходящими через легкие, устанавливаются взаимоотношения по типу прямых и обратных связей. Концентрация кортизола в артериальной крови находилась в обратной корреляционной зависимости от показателей А-В-разницы концентрации трийодтиронина (г= -0,5; р<0,01). Показатели А-В-разницы концентрации кортизола находились в прямой корреляционной зависимости по отношению к уровню Т3 в артериальной крови (г=0,53; р<0.01). При дезадаптивном течении раннего постинфарктного периода были отмечены некоторые особенности. В частности, при отеке легких (рис.4.5) по отношению к Т3, также, как и у больных с неосложненным течением, наблюдался «синдром эутиреоидной патологии» (И.Л. Телкова, А.Т. Тепляков, Р.С. Карпов, 2000; Kimura, Kanda, Kotajima, et al., 2000; Shen et al., 2001; Flammer, Pache, Resink, 2001, Dunn, 2002; Porra et al., 2002; Jacques, Rossouw, 2002), при этом гормон как и в контрольной группе задерживался легкими. У больных без клинических признаков застоя в легких (рис.4.2) направленность обмена тироксина не менялась по сравнению со здоровыми пациентами, однако, «захват» гормона тканью легких усиливался. По-видимому, усиление этого процесса характеризуется положительными компенсаторно-метаболическими сдвигами в паренхиме легких, которые с учетом исхода заболевания можно оценить как благоприятные. Оказалось, что степень гидратации ткани легких находилась в прямой зависимости от концентрации тироксина в артериальной и в венозной крови и у больных с выраженной степенью легочной гидратации (отек легких), а концентрация Т4 в артериальной и в венозной крови в 1,5-2 раза превышала аналогичные показатели контрольной группы. При выраженном и умеренном венозном застое (рис.4.3; рис.4.5) легкие преимущественно выделяли гормон в артериальное русло. При отсутствии признаков отека легких на фоне ОИМ (как мы указывали выше) гормонорегулирующая функция легких сохранялась. Высокие показатели тироксина могли быть причиной снижения синтеза ТТГ гипофизом по принципу обратной связи, что можно расценивать как нарушение процесса адаптации (И.Л. Заячук, 1988; Kaptein, 1986; Polikar, Feld, Dittrich et al., 1989; Igbar, 1994; Eber, Schumacher, Langsteger, 1995; Jug, Korsis, Plavsic, 1998). Действительно, как показали исследования, уровень ТТГ у больных с умеренным и выраженным отеком легочной ткани был низким. Однако уровень снижения ТТГ зависел от выраженности отека легочной ткани, при этом гормоновыделительная функция легких снижалась. Создается впечатление, что гормон «транзитом» проходит через легкие при усилении их гидратации. Наличие корреляционных связей между концентрацией каждого гормона по исследуемым показателям подтверждают мысль о том, что по мере нарастания степени гидратации легочной ткани нарушаются межгормональные функциональные взаимосвязи, характерные для интактных легких. Так, при умеренном венозном застое при сравнении с нормой они изменяются, а при отеке легких они теряются совсем (отсутствие корреляционных связей Т3-Т4-ТТГ). При умеренной форме отека легочной ткани, как и у здоровых пациентов, отсутствуют корреляционные взаимоотношения между трийодтиронином и кортизолом по исследуемым показателям, а в группе больных с выраженным отеком легких взаимосвязи вновь выявляются (Т3 артериальная кровь – кортизол венозная кровь р= -0,7; р<0,01; Т3 А-В- разница - кортизол А-В- разница г=0,82; р<0,01). Что же касается самого кортизола, то оказалось, что степень концентрации в артериальной и в венозной крови также зависит от степени венозного застоя: чем выше степень венозного застоя, тем выше концентрация гормона в артериальной и в венозной крови. Показатели А-В разницы также увеличивались по мере нарастания отека легочной ткани, что говорит о повышенном «выбросе» гормона из легких. Интересные данные получены при анализе результатов в угрожающем для жизни состоянии (группа умерших) (рис.4.4). По абсолютной концентрации Т3 в артериальной и в венозной крови в сравнении с показателями здоровых пациентов достоверных различий выявлено не было, а описанный «синдром эутиреоидной патологии» в данной группе не был подтвержден. Надо полагать, что уменьшение концентрации трийодтиронина в ответ на стрессовое воздействие можно расценивать как адаптивную реакцию. Можно предположить, что увеличенная концентрация Т3 у больных с летальным исходом является следствием низкого «захвата» гормона клетками-мишенями, либо усиленной диссоциацией комплекса рецептор-гормон (С.П. Лысенков, 1993; И.Е. Чазова, Т.В. Мартынюк, В.П. Масенко с соавт., 2000; С.П. Лысенков, Л.З. Тель, А.П. Галенко-Ярошевский, 2001). Последнее предположение подтверждается тем, что в этой группе больных в крови после прохождения через легкие (артериальная кровь) увеличивается концентрация Т3. Тироксин в группе умерших выделяется легкими в артериальный кровоток, что характеризуется увеличением А-В-разницы (10,7±13,0 нМоль/л). Однако если учесть, что у здоровых пациентов имел место «захват» легкими Т4 со значительной отрицательной А-В-разницей (-5,3±7,4 нМоль/л), то можно думать об ухудшении (нарушении) процесса взаимодействия гормона и рецептора на уровне легких. 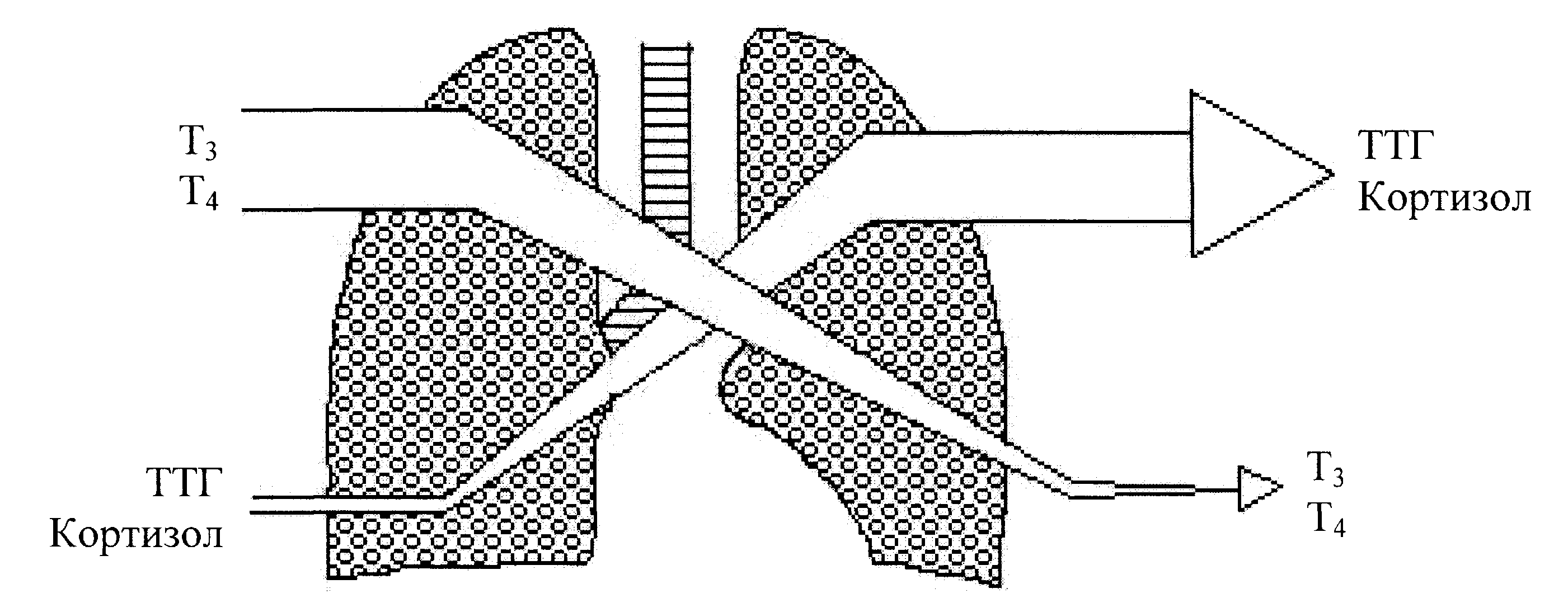 Рис. 4.1. Гормонорегулирующая функция легких у здоровых пациентов. 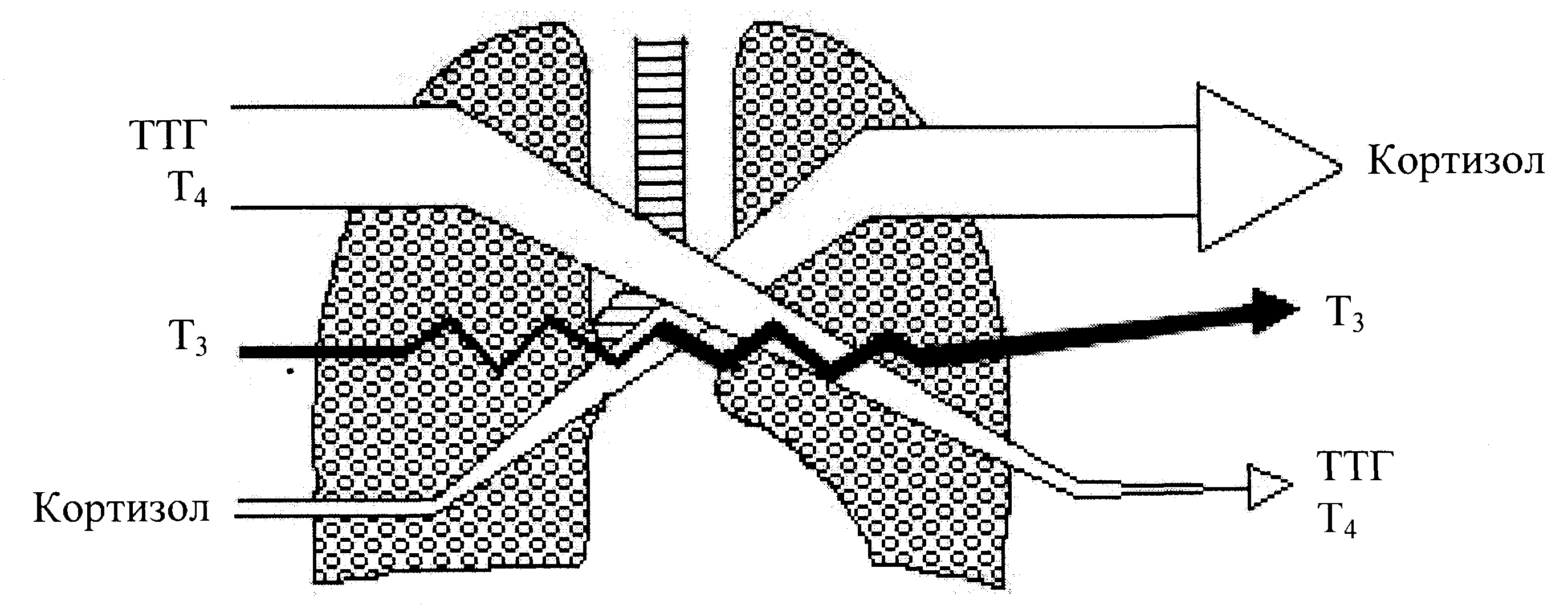 Рис. 4.2. Гормонорегулирующая функция легких в группе больных с венозным застоем 3-5 баллов. 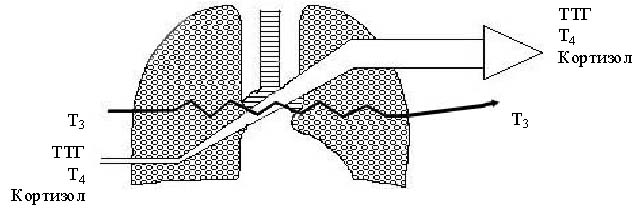 Рис. 4.3. Гормонорегулирующая функция легких в группе больных с венозным застоем 6-7 баллов. 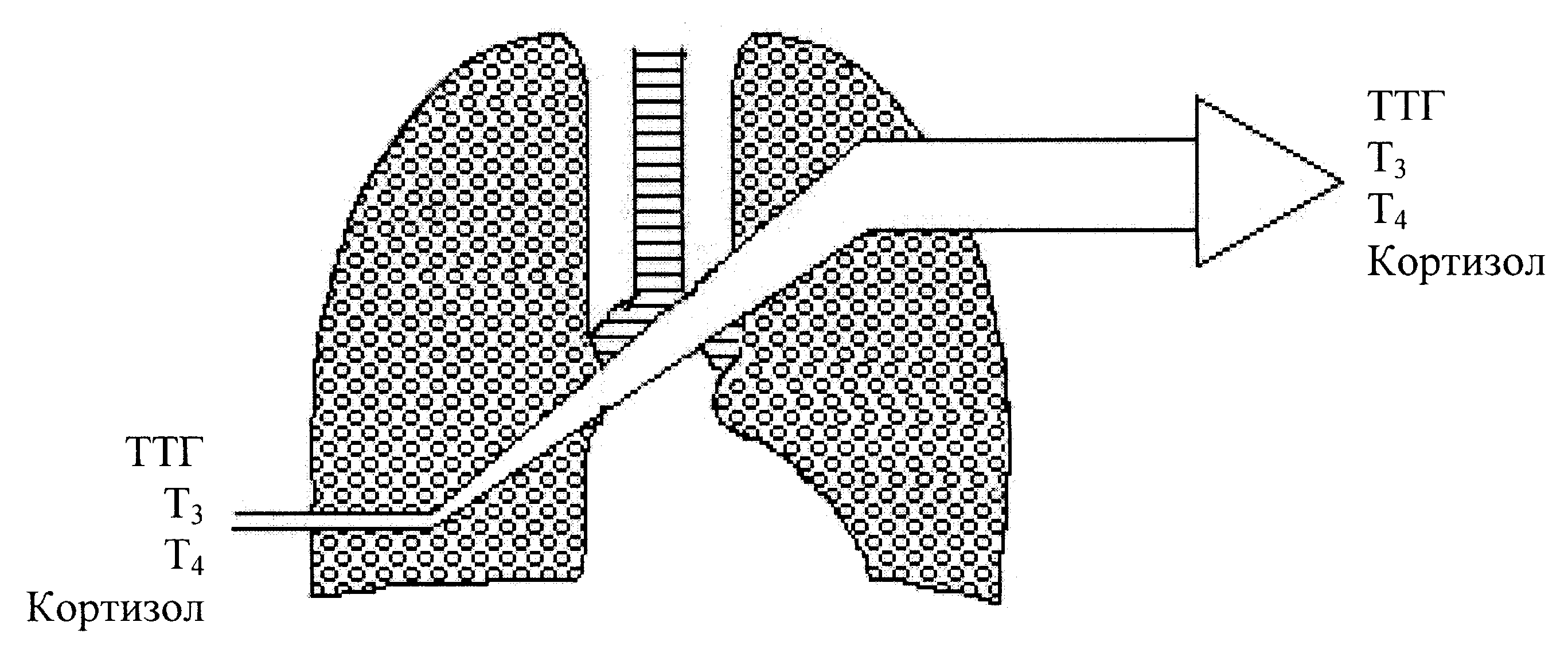 Рис. 4.4. Гормонорегулирующая функция легких в группе умерших.  Рис. 4.5. Гормонорегулирующая функция легких в группе выживших больных (степень венозного застоя 8-9 баллов, отек легких). Интересно отметить то обстоятельство, что по мере нарастания отека легочной ткани, величина «выброса» тироксина из легких увеличивалась, что подтверждалось наличием достоверной корреляционной зависимости (r=0,71; р<0,01). Однако у пациентов с альвеолярным отеком, но выживших, «отдача» гормона легкими была более значима по сравнению с группой больных в критическом для жизни состоянии (рис.4.3). Выявлена прямая корреляционная зависимость между концентрацией Т4 в артериальной крови по отношению к венозной крови в контрольной группе (r=0,59; р<0,01) и в исследуемых группах (r=0,91; р<0,01). Однако в группе умерших корреляционных взаимосвязей выявить не удалось. По отношению к ТТГ в группе умерших, как и в группе здоровых пациентов и группах больных с умеренной степенью венозного застоя, наблюдалось высвобождение гормона из легких (положительные показатели А-В-разницы), но в группе умерших этот процесс был максимальным (А-В-разница=0,37±0,31 мМЕ/мл). В то время, как в группе выживших больных с отеком легких отмечалась интенсификация процесса «захвата» ТТГ легкими (А-В-разница = -0,186±0,19 мМЕ/мл). В данном случае умеренный процесс высвобождения гормона в артериальный кровоток, наблюдаемый у здоровых пациентов, можно расценивать как физиологический, а значительный «выброс» ТТГ из легких (умершие больные) следует расценивать как процесс патологический и прогностически неблагоприятный. В группе больных в критическом для жизни состоянии реакция надпочечников характеризовалась чрезмерно высокой активностью, что подтверждалось достоверно высокими показателями концентрации гормона в венозной и артериальной крови в сравнении со всеми исследуемыми группами (р<0,01). В группе выживших больных с отеком легких имела место совершенно противоположная картина, характеризующаяся накоплением кортизола легкими (А-В-разница = -24,0±32,9 нМоль/л), а в группе умерших напротив - его «выносом» (А-В-разница = 214,0±65,4 нМоль/л). Можно предположить, что «захват» кортизола легкими является приспособительным механизмом, а его выделение - результат «поломки» физиологических механизмов. Таким образом, по отношению к большинству исследуемых гормонов легкие выполняют гормонорегулирующую функцию. Более того, для кортизола и ТТГ легкие являются органом выделения гормонов, а по отношению к Т3 и Т4 органом, депонирующим данные гормоны. Что касается самого механизма депонирования и выделения гормонов из легких, то здесь можно предположить несколько вариантов. Выделение гормона из легких возможно в результате диссоциации комплекса гормон-рецептор (С.П. Лысенков с соавт., 2001). Вторым источником гормона могут стать форменные элементы крови (М. В. Сыромятникова, В.А Гончарова, Т.В. Котенко, 1987; А.П. Симоненков, В.Д. Федоров, 2000), после прохождения которых через малый круг наблюдается «сбрасывание» гормона с соответствующего рецептора (И.И. Яковлева с соавт., 2000). Третьим источником может быть лимфа, скорость образования которой при развитии отека легких увеличивается в несколько раз (Я.А. Лазарис, И.А. Серебровская, 1962), что сопровождается, по-видимому, вымыванием гормона из интерстициального пространства и поступлением его в кровь. Таким образом, в экспериментальных условиях на различных лабораторных животных, а также в клинических условиях у человека мы получили факты, подтверждающие гормонорегулирующую способность легких. В связи с полученными фактами мы вправе утверждать, что функциональные системы поддержания гормонального гомеостаза в организме должны обязательно включать в себя легкие. Функция контроля уровня гормона в системном кровотоке, по-видимому, не лишена биологического смысла, так как малый круг кровообращения пропускает через себя весь объем циркулирующей крови. Механизмы этого контроля, в частности феномены депонирования и выделения, в каждом конкретном случае свои и имеют свойственные этому механизму метаболические основы. Однако, выявление этих механизмов является большой отдельной проблемой, решение которой мы не ставили целью в данной заявке. Сопоставимость результатов, полученных на человеке и в экспериментах на животных, позволяет утверждать тезис о том, что выявленная закономерность является общебиологической. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
