Ответы Физиология. Нормальная физиология как научная основа медицины, её связь с другими науками
 Скачать 1.62 Mb. Скачать 1.62 Mb.
|
|
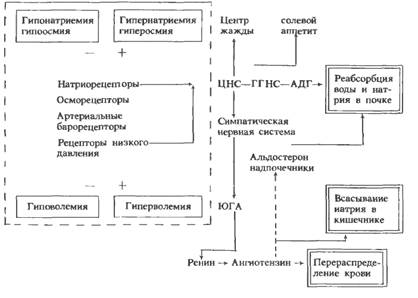
Рефлекторная реакция при гивоволемии Нарушение объема крови проявляется в виде гиповолемии и гиперволемии — уменьшении или увеличении объема крови по сравнению с нормой (нормоволемией), составляющей 6—8% от массы тела, или 65—80 мл крови на 1 кг массы тела. В свою очередь гипо- и гиперволемия подразделяются на простую, полицитемическую и олигоцитемическую в зависимости от того, сохраняется ли при этом нормальное соотношение плазмы и клеток крови (36 — 48% объема крови приходится на долю форменных элементов, 52—64% — на долю плазмы) или же изменяется в сторону преобладания клеток (полицитемическая форма) или плазмы (олигоцитемическая форма). Кроме того, к нарушениям объема крови относят изменения объемного соотношения между форменными элементами и плазмой при нормальном общем объеме крови — олиго- и полицитемическую нормоволемию (гемодилюция и гемоконцентрация). Показателем объемного соотношения является гематокритное число, выражающее содержание форменных элементов (преимущественно эритроцитов) в общем объеме крови (36—48 об.% в норме). Этиология. Гиповолемия простая (уменьшение объема крови без изменения гематокритного числа) возникает сразу после острой кровопотери и сохраняется до тех пор, пока жидкость не перейдет из тканей в кровь. Гиповолемия олигоцитемическая (уменьшение объема крови с преимущественным уменьшением в ней клеток — эритроцитов) наблюдается после острой кровопотери, когда компенсаторное поступление крови из депо и тканевой жидкости в кровеносное русло не восстанавливает объем и состав крови. Гиповолемия полицитемическая (уменьшение объема крови вследствие уменьшения объема плазмы при относительном увеличении содержания эритроцитов) развивается при обезвоживании организма (понос, рвота, усиленное потоотделение, гипервентиляция). При шоке кровь депонируется в расширенных сосудах брюшной полости, что ведет к снижению объема циркулирующей крови, а выход жидкости в ткани при повышении проницаемости сосудистой стенки обусловливает сгущение крови и возникновение полицитемической гиповолемии. Гиперволемия простая (увеличение объема крови при сохранении нормального соотношения между эритроцитами и плазмой) возникает сразу же после переливания большого количества крови. Однако вскоре жидкость покидает кровеносное русло, а эритроциты остаются, что ведет к сгущению крови. Простая гиперволемия при усиленной физической работе обусловлена поступлением в общий кровоток крови из депо. Гиперволемия олигоцитемическая (увеличение объема крови за счет плазмы) развивается при задержке воды в организме в связи с заболеванием почек, при введении кровезаменителей. В эксперименте она моделируется путем внутривенного введения животным изотонического раствора натрия хлорида. Гиперволемия полицитемическая (увеличение объема крови за счет нарастания количества эритроцитов) наблюдается при понижении атмосферного давления, а также при различных заболеваниях, связанных с кислородным голоданием (порок сердца, эмфизема), и рассматривается как компенсаторное явление. При эритремии полицитемическая гиперволемия является следствием опухолевого разрастания клеток костного мозга. Нормоволемия олигоцитемическая возникает при анемии вследствие кровопотери (объем крови нормализовался за счет тканевой жидкости, а количество эритроцитов еще не восстановилось), гемолиза эритроцитов, нарушения гемопоэза. Нормоволемия полицитемическая наблюдается при переливании небольших количеств эритроцитарной массы. Патогенез. Гиповолемия сопровождается нарушением транспортной функции крови и связанных с ней дыхательной, трофической, экскреторной, защитной, регуляторной (гуморальная регуляция, терморегуляция) функций крови, что в той или иной мере отражается на гомеостазе. Гиперволемия обусловливает повышение нагрузки на сердце, особенно при одновременном возрастании гематокритного числа (полицитемическая гиперволемия), когда увеличивается вязкость крови (внутреннее трение), повышается склонность к образованию тромбов и могут возникнуть нарушения кровообращения в некоторых органах. Патогенез нарушений, развивающихся при олигоцитемической нормоволемии, следует прежде всего связать со снижением дыхательной функции крови и развитием гипоксии. Помимо осмо- и натриорецепторов, уровень секреции АДГ определяет активность волюморецепторов, воспринимающих изменение объема внутрисосудистой и внеклеточной жидкости. Ведущее значение в регуляции секреции АДГ имеют рецепторы, которые реагируют на изменение напряжения сосудистой стенки в области низкого давления. Прежде всего это рецепторы левого предсердия, импульсы от которых передаются в ЦНС по афферентным волокнам блуждающего нерва. При увеличении кровенаполнения левого предсердия активируются волюморецепторы и угнетается секреция АДГ, что вызывает усиление мочеотделения. Поскольку активация волюморецепторов в отличие от осморецепторов обусловлена увеличением объема жидкости, т. е. возросшим содержанием в организме воды и солей натрия, возбуждение волюморецепторов приводит к увеличению экскреции почкой не только воды, но и натрия. Эти процессы связаны с секрецией натрийуретического гормона, уменьшением секреции ренина, ангиотензина, альдостерона, при этом снижается тонус симпатической нервной системы, в результате уменьшается реабсорбция натрия и возрастают натрийурез и мочеотделение. В конечном счете восстанавливается объем крови и внеклеточной жидкости.
Для поддержания почками постоянства объема и состава внутренней среды и прежде всего крови существуют специальные системы рефлекторной регуляции, включающие специфические рецепторы, афферентные пути и нервные центры, где происходит переработка информации. Команды к почке поступают по эфферентным нервам или гуморальным путем. В целом перестройка работы почки, ее приспособление к непрестанно изменяющимся условиям определяются преимущественно влиянием на гломерулярный и канальцевый аппарат аргинин-вазопрессина [антидиуретического гормона (АДГ)], альдостерона, паратгормона и ряда других гормонов. Роль почек в осмо- регуляции. Почки являются основным органом осморегуляции. Они обеспечивают выделение избытка воды из организма в виде гипотонической мочи при увеличенном содержании воды (гипергидратация) или экономят воду и экскретируют мочу, гипертоническую по отношению к крови, при обезвоживании организма (дегидратация). После питья воды или при ее избытке в организме снижается концентрация растворенных осмотически активных веществ в крови и падает ее осмоляльность. Это уменьшает активность центральных осморецепторов, расположенных в области супраоптического ядра гипоталамуса, а также периферических осморецепторов, имеющихся в печени, почке и других органах, что приводит к снижению секреции АДГ нейрогипофизом и увеличению выделения воды почкой. Центральные осморецепторы открыл английский физиолог Верней (1947), а представление об осморегулирующем рефлексе и периферических осморецепторах разработал А. Г. Гинецинский.
При обезвоживании организма или введении в сосудистое русло гипертонического раствора NaCl увеличивается концентрация осмотически активных веществ в плазме крови, возбуждаются осморецепторы, усиливается секреция АДГ, возрастает всасывание воды в канальцах, уменьшается мочеотделение и выделяется осмотически концентрированная моча (схема 12.1). В эксперименте было показано, что, помимо осморецепторов, секрецию АДГ стимулируют натриорецепторы. При введении в область III желудочка мозга гипертонического раствора NaCl наблюдался антидиурез, если же вводить в то же место гипертонический раствор сахарозы, то мочеотделение не уменьшается. Осморецепторы высокочувствительны к сдвигам концентрации осмотически активных веществ в плазме крови. При увеличении концентрации в плазме осмотически активных веществ на 1 % (около 3 мосмоль/кг Н2О) концентрация аргинин-вазопрессина в плазме крови у человека возрастает на 1 пг/мл1. Повышение концентрации осмотически активных веществ в плазме на 1 мосмоль/кг 11 пг (пикограмм) = 10-12 г. вызывает благодаря выделению АДГ увеличение осмотической концентрации мочи почти на 100 мосмоль/кг НгО, а переход от состояния водного диуреза до максимального осмотического концентрирования мочи требует 10-кратного возрастания активности АДГ в крови — с 0,5 до 5 пг/мл
Для поддержания почками постоянства объема и состава внутренней среды и прежде всего крови существуют специальные системы рефлекторной регуляции, включающие специфические рецепторы, афферентные пути и нервные центры, где происходит переработка информации. Команды к почке поступают по эфферентным нервам или гуморальным путем. В целом перестройка работы почки, ее приспособление к непрестанно изменяющимся условиям определяются преимущественно влиянием на гломерулярный и канальцевый аппарат аргинин-вазопрессина [антидиуретического гормона (АДГ)], альдостерона, паратгормона и ряда других гормонов. Роль почек в осмо- и волюморегуляции. Почки являются основным органом осморегуляции. Они обеспечивают выделение избытка воды из организма в виде гипотонической мочи при увеличенном содержании воды (гипергидратация) или экономят воду и экскретируют мочу, гипертоническую по отношению к крови, при обезвоживании организма (дегидратация). После питья воды или при ее избытке в организме снижается концентрация растворенных осмотически активных веществ в крови и падает ее осмоляльность. Это уменьшает активность центральных осморецепторов, расположенных в области супраоптического ядра гипоталамуса, а также периферических осморецепторов, имеющихся в печени, почке и других органах, что приводит к снижению секреции АДГ нейрогипофизом и увеличению выделения воды почкой. Центральные осморецепторы открыл английский физиолог Верней (1947), а представление об осморегулирующем рефлексе и периферических осморецепторах разработал А. Г. Гинецинский.
При обезвоживании организма или введении в сосудистое русло гипертонического раствора NaCl увеличивается концентрация осмотически активных веществ в плазме крови, возбуждаются осморецепторы, усиливается секреция АДГ, возрастает всасывание воды в канальцах, уменьшается мочеотделение и выделяется осмотически концентрированная моча (схема 12.1). В эксперименте было показано, что, помимо осморецепторов, секрецию АДГ стимулируют натриорецепторы. При введении в область III желудочка мозга гипертонического раствора NaCl наблюдался антидиурез, если же вводить в то же место гипертонический раствор сахарозы, то мочеотделение не уменьшается. Осморецепторы высокочувствительны к сдвигам концентрации осмотически активных веществ в плазме крови. При увеличении концентрации в плазме осмотически активных веществ на 1 % (около 3 мосмоль/кг Н2О) концентрация аргинин-вазопрессина в плазме крови у человека возрастает на 1 пг/мл1. Повышение концентрации осмотически активных веществ в плазме на 1 мосмоль/кг 11 пг (пикограмм) = 10-12 г. вызывает благодаря выделению АДГ увеличение осмотической концентрации мочи почти на 100 мосмоль/кг НгО, а переход от состояния водного диуреза до максимального осмотического концентрирования мочи требует 10-кратного возрастания активности АДГ в крови — с 0,5 до 5 пг/мл
Почки обеспечивают активное выведение из организма с мочой ряда веществ с кислыми или основными свойствами, а также поддерживают концентрацию бикарбонатов крови. К главным механизмам уменьшения или устранения сдвигов КЩР крови, реализуемых нефронами почек, относят ацидогенез, аммони-огенез, секрецию фосфатов и К+,Nа+-обменный механизм. • Ацидогенез. Этот энергозависимый процесс, протекающий в эпителии дистальных отделов нефрона и собирательных трубочек, обеспечивает секрецию в просвет канальцев Н+ в обмен на реабсорбируемый Na+. Количество секретируемого Н+ эквивалентно его количеству, попадающему в кровь с нелетучими кислотами и Н2С03. Реабсорбированный из просвета канальцев в плазму крови Na+ участвует в регенерации плазменной гидрокарбонатной буферной системы). • Аммониогенез, как и ацидогенез, реализует эпителий канальцев нефрона и собирательных трубочек. Аммониогенез осуществляется путём окислительного дезаминирования аминокислот, преимущественно (примерно 2/3) — глутаминовой, в меньшей мере — аланина, аспарагина, лейцина, гистиди-на. Образующийся при этом аммиак диффундирует в просвет канальцев. Там NH3+ присоединяет ион Н+ с образованием иона аммония (NH4+). Ионы NH4+ замещают Na+ в солях и выделяются преимущественно в виде NH4C1 и (NH4)2S04. В кровь при этом поступает эквивалентное количество гидрокарбоната натрия, обеспечивающего регенерацию гидрокарбонатной буферной системы. Секреция КГ клетками канальцев и собирательных трубочек • Секреция фосфатов осуществляется эпителием дистальных канальцев при участии фосфатной буферной системы: Na2HP04 + Н2СО3 <=> NaH2P04 + NaHC03. Образующийся гидрокарбонат натрия реабсорбируется в кровь и поддерживает гидрокарбонатный буфер, a NaH2P04 выводится из организма с мочой. Таким образом, секреция Н+ эпителием канальцев при реализации трёх описанных выше механизмов (ацидогенеза, аммониогенеза, секреции фосфатов) сопряжена с образованием гидрокарбоната и поступлением его в плазму крови. Это обеспечивает постоянное поддержание одной из наиболее важных, ёмких и мобильных буферных систем — гидрокарбонатной и как следствие — эффективное устранение или уменьшение опасных для организма сдвигов КЩР. • К+,Na+-обменный механизм, реализуемый в дистальных отделах нефрона и начальных участках собирательных трубочек, обеспечивает обмен Na+ первичной мочи на К+, выводящийся в неё эпителиальными клетками. Реабсорбиро-ванный Na+ в жидких средах организма участвует в регенерации гидрокарбонатной буферной системы. K+,Na+- oбмен контролируется альдостероном. Более того, альдостерон регулирует (увеличивает) объём секреции и экскреции Н+. Таким образом, почечные механизмы устранения или уменьшения сдвигов КЩР осуществляются путём экскреции Н+ и восстановления резерва гидрокарбонатной буферной системы в жидких средах организма. Эндокринология 1 вопрос.?????? 2 вопрос. Стероидные гормоны. В эту группу входят тестостерон, эстрадиол, эстрон, прогестерон, кортизол, альдостерон и др. Эти гормоны образуются из холестерина в корковом веществе надпочечников (кортикостероиды), а также в семенниках и яичниках (половые стероиды). В малом количестве половые стероиды могут образовываться в корковом веществе надпочечников, а кортикостероиды — в половых железах. Свободный холестерин поступает в митохондрии, где превращается в прегненолон, который затем попадает в эндоплазматическую сеть и после этого — в цитоплазму. В корковом веществе надпочечников синтез стероидных гормонов стимулируется кортикотропином, а в половых железах — лютеинизирующим гормоном (ЛГ). Эти гормоны ускоряют транспорт эфиров холестерина в эндокринные клетки и активируют митохондриальные ферменты, участвующие в образовании прегненолона. Кроме того, тропные гормоны активируют процессы окисления сахаров и жирных кислот в эндокринных клетках, что обеспечивает стероидогенез энергией и пластическим материалом. Кортикостероиды. Подразделяют на две группы. Глюкокортикоиды (типичный представитель — кортизол) индуцируют синтез ферментов глюконеогенеза в печени, препятствуют поглощению глюкозы мышцами и жировыми клетками, а также способствуют высвобождению из мышц молочной кислоты и аминокислот, тем самым ускоряя глюконеогенез в печени. Минералокортикоиды (типичный представитель — альдостерон) задерживают натрий в крови. Снижение концентрации натрия (см. раздел 5.2.5) в выделяемой моче, а также секретах слюнных и потовых желез приводит к меньшим потерям воды, так как вода движется через биологические мембраны в направлении высокой концентрации солей. Кортикотропин влияет слабо на синтез минералокортикоидов. Имеется дополнительный механизм регуляции синтеза минералокортикоидов, осуществляющийся через так называемую ренин-ангиотензиновую систему. Рецепторы, реагирующие на давление крови, локализованы в артериолах почек. При снижении давления крови эти рецепторы стимулируют секрецию ренина почками. Ренин является специфической эндопептидной, отщепляющей от α2-глобулина крови С-концевой декапептид, который называют «ангиотензин I». От ангиотензина I карбоксипептидаза (ангиотензинпревращающий фермент, расположенный на наружной поверхности эндотелия кровеносных сосудов) отщепляет два аминокислотных остатка и образует октапептид ангиотензин II — гормон, к которому на мембране клеток коркового вещества надпочечников имеются специальные рецепторы. Связываясь с этими рецепторами, ангиотензин II стимулирует образование альдостерона, который действует на дистальные канальцы почек, потовые железы, слизистую оболочку кишечника и увеличивает в них реабсорбцию ионов Na+, Сl- и НСОз-. В результате в крови повышается концентрация ионов Na+ и снижается концентрация ионов Сl- и К+. Эти эффекты альдостерона полностью блокируются ингибиторами синтеза белка. Половые стероиды. Андрогены (мужские половые гормоны) продуцируются интерстициальными клетками (гландулоцитами) семенников и в меньшем количестве яичниками и корковым веществом надпочечников. Основным андрогеном является тестостерон (см. раздел 5.2.7). Этот гормон может претерпевать изменения в клетке-мишени — превращаться в дигидротестостерон, который обладает большей активностью, чем тестостерон. Следует отметить, что ЛГ, который стимулирует начальные этапы биосинтеза стероидов в эндокринной железе, активирует также превращение тестостерона в дигидротестостерон в клетке-мишени, тем самым, усиливая андрогенные эффекты. Эстрогены (женские половые гормоны) в организме человека в основном представлены эстрадиолом. В клетках-мишенях они не метаболизируются. Стероидные гормоны легко проникают через клеточную мембрану, поэтому их секреция происходит параллельно с синтезом. Содержание стероидов в крови определяется соотношением скоростей их синтеза и распада. Регуляция этого содержания осуществляется главным образом путем изменения скорости синтеза. Тропные гормоны (кортикотропин, ЛГ и ангиотензин) стимулируют этот синтез. Устранение тропного влияния приводит к торможению синтеза стероидных гормонов. Действующие концентрации стероидных гормонов составляют 10-11—10-9 М. Период их полураспада равен 1/2—11/2 ч. Тиреоидные гормоны. В эту группу входят тироксин и трийодтиронин. Синтез этих гормонов осуществляется в щитовидной железе, в которой ионы йода окисляются при участии пероксидазы до йодиниум-иона, способного йодировать тиреоглобулин — тетрамерный белок, содержащий около 120 тирозинов. Йодирование тирозиновых остатков происходит при участии пероксида водорода и завершается образованием монойодтирозинов и дийодтирозинов. После этого происходит «сшивка» двух йодированных тирозинов. Эта окислительная реакция протекает с участием пероксидазы и завершается образованием в составе тиреоглобулина трийодтиронина и тироксина. Для того чтобы эти гормоны освободились из связи с белком, должен произойти протеолиз тиреоглобулина. При расщеплении одной молекулы этого белка образуется 2—5 молекул тироксина (Т4) и трийодтиронина (Тз), которые секретируются в молярных соотношениях, равных 4:1. Синтез и секреция тиреоидных гормонов находятся под контролем гипоталамо-гипофизарной системы. Тиреотропин активирует аденилатциклазу щитовидной железы, ускоряет активный транспорт йода, а также стимулирует рост эпителиальных клеток щитовидной железы. Эти клетки формируют фолликул, в полости которого происходит йодирование тирозина. Тиреоидные гормоны могут циркулировать в крови в неизменном виде в течение нескольких дней. Такая устойчивость гормонов объясняется, по-видимому, образованием прочной связи с Т4-свя-зывающими глобулинами и преальбуминами в плазме крови. Эти белки имеют в 10—100 раз большее сродство к Т4, чем к T3, поэтому в крови человека содержится 300—500 мкг Т4 и лишь 6—12 мкг Т3. Катехоламины. В эту группу входят адреналин, норадреналин и дофамин. Источником катехоламинов, как и тиреоидных гормонов, служит тирозин, однако при синтезе катехоламинов метаболизму подвергается свободная аминокислота. Синтез катехоламинов происходит в аксонах нервных клеток, запасание — в синаптических пузырьках. Катехоламины, образующиеся в мозговом веществе надпочечников, выделяются в кровь, а не в синаптическую щель, т. е. являются типичными гормонами. Определенное количество катехоламинов может диффундировать из синапсов в межклеточное пространство, а затем в кровь, поэтому содержание норадреналина в крови больше, чем адреналина, несмотря на то что мозговое вещество надпочечников секретирует в кровь адреналин, а норадреналин секретируется преимущественно в синапсах. При стрессе содержание катехоламинов повышается в 4—8 раз. Период полураспада катехоламинов в крови равен 1—3 мин. Катехоламины могут инактивироваться в тканях-мишенях, печени и почках. Решающее значение в этом процессе играют два фермента — моноаминоксидаза, расположенная на внутренней мембране митохондрий, и катехол-О-метилтрансфераза, цитозольный фермент. Эйкозаноиды. В эту группу входят простагландины, тромбоксаны и лейкотриены. Эйкозаноиды называют гормоноподобными веществами, так как они могут оказывать только местное действие, сохраняясь в крови в течение нескольких секунд. Образуются во всех органах и тканях практически всеми типами клеток. Биосинтез большинства эйкозаноидов начинается с отщепления арахидоновой кислоты от мембранного фосфолипида или диацил-глицерина в плазматической мембране. Синтетазный комплекс представляет собой полиферментную систему, функционирующую преимущественно на мембранах эндоплазматической сети. Образующиеся эйкозаноиды легко проникают через плазматическую мембрану клетки, а затем через межклеточное пространство переносятся на соседние клетки или выходят в кровь и лимфу. Скорость синтеза эйкозаноидов увеличивается под влиянием гормонов и нейромедиаторов, активирующих аденилатциклазу или повышающих концентрацию ионов Са2+ в клетке. Наиболее интенсивно образование простагландинов происходит в семенниках и яичниках. Простагландины могут активировать аденилатциклазу, тромбоксаны увеличивают активность фосфоинозитидного обмена, а лейкотриены повышают проницаемость мембран для ионов Са2+. Поскольку цАМФ и ионы Са2+ стимулируют синтез эйкозаноидов, замыкается положительная обратная связь в синтезе этих специфических регуляторов. Во многих тканях кортизол тормозит освобождение арахидоновой кислоты, что приводит к подавлению образования эйкозаноидов, и тем самым оказывает противовоспалительное действие. Простагландин E1 является мощным пирогеном. Подавлением синтеза этого простагландина объясняют терапевтическое действие аспирина. Период полураспада эйкозаноидов составляет 1—20 с. Ферменты, инактивирующие их, имеются практически во всех тканях, но наибольшее их количество содержится в легких. |