сроп. ФКХ+СРО+doc+(2). Общие рекомендации по выполнению самостоятельной работы обучающегося
 Скачать 0.82 Mb. Скачать 0.82 Mb.
|
|
3.2 Зависимость теплового эффекта химической реакции от температуры 3.2.1 Рассчитать зависимость теплового эффекта химической реакции 2Cu2S + 3O2 = 2Cu2O + 2SO2 от температуры, если известен тепловой эффект реакции при 298 К ΔН СР(Cu2S) = 39,25 + 130,54∙10-3T СР(O2) = 31,96 + 3,99∙10-3T – 3,57∙105T-2 СР(Cu2O) = 56,57 + 29,29∙10-3T СР(SO2) = 46,19 + 7,87∙10-3T – 7,7∙105T-2 Решение Зависимость теплового эффекта химической реакции от температуры Выражается уравнением ΔН где ΔН0 – постоянная интегрирования; ΔСР – изменение теплоёмкости химической реакции. Изменение теплоёмкости химической реакции определяется уравнением ΔСР = 2СР(Cu2O) + 2СР(SO2) - 2СР(Cu2S) -3СР(O2) После подстановки численных значений получим ΔСР = 2(56,57 + 29,29∙10-3T) + 2(46,19 + 7,87∙10-3T – 7,7∙105T-2)- 2(39,25 + 130,54∙10-3T)- 3(31,96 + 3,99∙10-3T – 3,57∙105T-2) = 32,64 – 196,79∙10-3T + 4,01∙105T-2 Подставив значение ΔСР в уравнение зависимости теплового эффекта химической реакции от температуры, получим ΔН После интегрирования уравнения получим ΔН На основании известного теплового эффекта химической реакции при температуре 298 К, рассчитаем постоянную интегрирования ΔН0. Для этого в полученное уравнений подставим значение теплового эффекта и температуру 298 К, обращая внимание на соответствие размерностей теплоёмкости и теплового эффекта. 781160 = ΔН0 + 32,64∙298 - 98,39∙10-3∙2982 - 4,01∙105∙298-1 Решая уравнение, получим ΔН0 = 780303 Дж Тогда уравнение зависимости теплового эффекта химической реакции от температуры будет иметь вид ΔН Ответ: ΔН 3.2.2 Рассчитать зависимость теплового эффекта химической реакции 2Cu2O + Cu2S = 6Cu + SO2 при температуре 1200оС. Решение Зависимость теплового химической реакции от температуры выражается уравнением ΔН где ΔН0 – постоянная интегрирования; ΔСР – изменение теплоёмкости химической реакции. Для расчёта теплового эффекта химической реакции от температуры необходимо знать зависимости теплоёмкостей участников химической реакции от температуры и величину теплового эффекта этой реакции, хотя бы при одной температуре. Последнее необходимо для расчёта постоянной интегрирования ΔН0 . Для решения задачи воспользуемся справочными данными, приведёнными в приложении А. Для расчёта теплового эффекта реакции при температуре 298 К выпишем из приложения значения тепловых эффектов образования участников реакции при температуре 298 К. ΔН ΔН Рассчитаем тепловой эффект реакции при температуре 298 К. ΔН Подставляя численные значения, получим ΔН Для расчёта ΔСР выпишем из приложения численные зависимости теплоёмкостей (Дж/(моль∙К)) участников реакции от температуры СР(Cu2S) = 39,25 + 130,54∙10-3T СР(Сu) = 22,64 + 6,28∙10-3T СР(Cu2O) = 56,57 + 29,29∙10-3T СР(SO2) = 46,19 + 7,87∙10-3T – 7,7∙105T-2 Изменение теплоёмкости химической реакции определяется уравнением ΔСР = 6СР(Cu) + СР(SO2) - СР(Cu2S) -2СР(Cu2O) Подставляя численные значения, получим ΔСР = 6(22,64 + 6,28∙10-3T) + (46,19 + 7,87∙10-3T – 7,7∙105T-2) - (39,25 + 130,54∙10-3T) – 2(56,57 + 29,29∙10-3T) = -60,92 – 168,68∙10-3T– 7, 7∙105T-2 Подставив значение ΔСР в уравнение зависимости теплового эффекта химической реакции от температуры, получим ΔН После интегрирования уравнения получим ΔН На основании известного теплового эффекта химической реакции при температуре 298 К, рассчитаем постоянную интегрирования ΔН0. Для этого в полученное уравнений подставим значение теплового эффекта и температуру 298 К, обращая внимание соответствие размерностей теплоёмкости и теплового эффекта. 46960 = ΔН0 – 60,92∙298 – 84,34∙10-3∙2982 + 7,7∙105∙298-1 Решая уравнение, получим ΔН0 = 70020 Дж Тогда уравнение зависимости теплового эффекта химической реакции от температуры будет иметь вид ΔН По полученному уравнению рассчитаем тепловой эффект химической реакции при 1483оК ΔН Ответ: -202187,36 кДж 3.3 Фазовые превращения 3.3.1 Зависимость давления насыщенного CdS пара (Па) от температуры гад жидким выражается уравнением lnP = Определить тепловой эффект процесса испарения CdS при 900 К. Решение Зависимость давления насыщенного пара жидкости от температуры выражается уравнением Откуда получим Продифференцируем по температуре уравнение зависимости давления насыщенного пара от температуры С учётом последнего уравнения для теплового эффекта процесса испарения жидкого CdS можно записать ΔН = RT2∙( Подставляя в последнее уравнение численное значение температуры, получим величину теплового эффекта процесса испарения жидкого CdS при температуре 900 К. ΔН = = 8,31(3266 + 6,35∙900) = 74632,11 Дж/моль Ответ: 74632,11 Дж/моль 3.5.2 Зависимость константы равновесия химической реакции MgCl2 + H2O = MgO + 2HCl от температуры приведено в таблице 2.20. Таблица 2.20 – Зависимость константы равновесия от температуры
Вывести уравнение зависимости константы равновесия реакции от температуры и графическим способом рассчитать тепловой эффект реакции в приведённом интервале температур. Решение Выявим характер зависимости константы равновесия от температуры в координатах lnКР - Таблица 2.21 – Зависимость lnКР -
На основании таблицы 2.2 построим график в координатах lnKP- 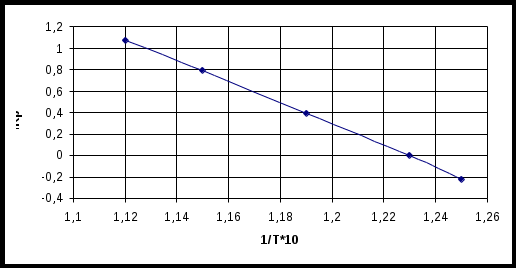 Рисунок 2.2 Зависимость lnKP реакции от Из графика видно, для рассматриваемой системы зависимость lnКР- lnКР = - где ΔН – тепловой эффект химической реакции В этом случае уравнение зависимости константы равновесия реакции от температуры можно получить как уравнение прямой, проходящей через две точки, лежащих на приведённой прямой. Выпишем координаты двух точек, лежащих на прямой: a(1/T1 = 1,12∙10-3; lnКР1=1,07); b(1/T2 = 1,25∙10-3; lnКР2= - 0,22) Уравнение прямой, проходящeй через две точки, лежащих на этой прямой, имеет вид (y – y1)/(y2 – y1) = (x – x1)/(x2 – x1) С учётом координат построенного графика можно записать (lnКР – lnКР1)/( lnКР2 – lnКР1) = (1/T – 1/T1)/( 1/T2 – 1/T1) Подставив численные значения координат точек, получим (lnКР – 1,02)/( - 0,22 – 1,07) = (1/T – 1,12∙10-3)/( 1,25∙10-3 – 1,12∙10-3) Решая уравнение относительно lnКР, получим lnКР = В нашем случае тепловой эффект химической реакции не зависит от температуры в приведённом интервале температур и определяется как тангенс угла наклона (β) прямой lnКР = f( ΔН = R∙tgβ Величину tgβ определим из треугольника abc, как tgβ = Тогда тепловой эффект процесса реакции составит ΔН = 8,31∙9923 = 82460 Дж. Ответ: lnКР = 3.3.3. Зависимость теплового эффекта процесса испарения четырёххлористого углерода от температуры выражается уравнением ΔН = 45857 - 44,08Т Определить давление насыщенного пара СCl4 при 60оС, если известно, что СCl4 кипит при температуре 75ос под давлением 101325 Па. Решение Зависимость давления насыщенного пара жидкости от температуры выражается уравнением Откуда следует, что dlnP = Проинтегрируем полученное уравнение с учётом зависимости ΔН = f(Т) в пределах Т- Ткип. Интегрирование уравнения даёт ln ln ln P = 82548,3 Па Ответ: 82548,3 Па 3.4 Равновесие в гомогенных и гетерогенных системах 3.4.1 При температуре 1093 К константа равновесия реакции СОгаз + Н2Огаз = СО2(газ) + Н2(газ) равна 1. Рассчитать исходный состав газовой смеси, если в состоянии равновесия оказалось 20% СО2 и 20% Н2. Решение Поскольку приведённая реакция протекает без изменения числа молей газообразных участников реакции (Δn = 0), то выражение константы равновесия реакции не зависит от способа выражения концентрации участников реакции. Выразим константу равновесия через концентрацию, выраженную в процентах КР = где %i – процентное содержание i – го компонента в равновесной газовой смеси. Для равновесного состояния справедливо %СО2 + %Н2 + %СО + %Н2О =100 С учётом содержания СО2 и Н2 в равновесной газовой смеси можно записать 20 + 20+ %СО + %Н2О =100 или %СО + %Н2О = 60 В равновесной смеси содержится 20% СО2 и 20% Н2. Тогда совместное содержание СО и Н2О в равновесной газовой фазе составит 60%. Обозначим через х процентное содержание СО в равновесной газовой смеси. Тогда содержание в ней Н2О составит 60 – х. Тогда константа равновесия реакции определится из уравнения КР = Откуда получим х2 - 60х + 400 = 0 Решая уравнение, получим х1 = 52,35 и х2 = 7,85 Тогда в равновесной газовой смеси может содержаться 52,35 %СО и 7,85 %Н2О или 52,35 %Н2О и 7,85 %СО В соответствии со стехиометрией химической реакции на образование 1 моль СО2 и 1 моль Н2 израсходуется 1 моль СО и 1 моль Н2О, соответственно. Это означает, что на образование 20% О2 и 20 % Н2 израсходуется 20% СО и 20 % Н2О из исходной смеси соответственно. Тогда в исходной смеси будет содержаться 52,35% + 20% = 72,35% СО и 7,65% + 20% = 27,65% Н2О или 7,65% + 20% = 27,65% СО иои 52,35% + 20% = 72.35% Н2О Ответ: 72,35% СО и 27,65% Н2О или 27,65% СО и 72.35% Н2О 3.4.2 Константа равновесия химической реакции MnOтв. + COгаз = Mnтв. + CO2газ при 700оС равна 9,0. Определить равновесный состав газовой смеси. Решение Поскольку приведённая реакция протекает без изменения числа молей газообразных участников реакции (Δn = 0), то выражение константы равновесия реакции не зависит от способа выражения концентрации участников реакции. Выразим константу равновесия через концентрацию, выраженную в процентах КР = Так как равновесная газовая фаза состоит только из СО и СО2, то для её состава справедливо уравнение %СО + %СО2 = 100 Тогда имеем систему уравнений описывающих равновесное состояние газовой фазы %СО + %СО2 = 100 Решая систему уравнений, получим %СО = 10; %СО2 = 90 Ответ: 10 %СО и 90 % СО2 3.4.2 Константа равновесия реакции Ств. + О2газ = 2СОгаз (1) при 1000оС равна 1,926∙105, а реакции 2СО2газ = 2СОгаз + О2газ (2) при той же температуре равна 0,253∙10-15. Рассчитать константу равновесия реакции Ств. + О2газ = СО2газ (3) при тех же условиях. Решение Комбинируем реакции (1) и (2) таким образом, чтобы их сложение давало реакцию (3). Для этого реакцию (2) необходимо записать в обратном направлении 2СОгаз + О2газ = 2СО2газ (2*) Константа равновесия этой реакции (2*) связана с константой равновесия реакции (2) уравнением Сложение реакций (1)и (2*) даёт реакцию (3) Ств. + О2газ = 2СОгаз 2СОгаз + О2газ = 2СО2газ -------------------------------- Ств + О2газ = 2СО2газ Тогда константа равновесия реакции (3) будет равна произведению констант равновесия реакций (1) и (2*) 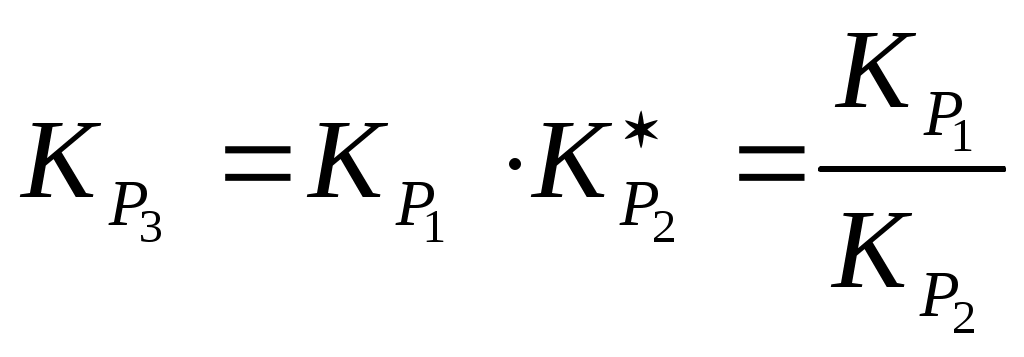 После подстановки численных значений получим Ответ: 7,6∙1020 |
