сроп. ФКХ+СРО+doc+(2). Общие рекомендации по выполнению самостоятельной работы обучающегося
 Скачать 0.82 Mb. Скачать 0.82 Mb.
|
|
3.5 Зависимость энергии Гиббса от температуры 3.5.1 Найти зависимость изменения энергии Гиббса от температуры для реакции ZnS + Cd = Zn + CdS если зависимость теплового эффекта реакции (Дж) выражается уравнением ΔН и изменение энергии Гиббса для реакции при температуре 298 К ΔG Решение Зависимость энергии Гиббса от температуры выражается уравнением ΔG где J – постоянная интегрирования. Подставив в уравнение зависимости энергии Гиббса от температуры уравнение зависимости теплового эффекта химической реакции от температуры, получим ΔG Интегрируя уравнение, получим ΔG ΔG На основании известной величины энергии Гиббса при 298 К рассчитаем постоянную интегрирования. Для этого в последнее уравнение подставим, соблюдая соответствие размерностей, величину G -41500 = -32410 + 5,56298ln298 - 3,67∙10-32982 + 298J Откуда получим J = 62 Тогда уравнение зависимости энергии Гиббса от температуры для реакции будет иметь вид ΔG Ответ: ΔG 3.6 Зависимость константы равновесия химической реакции от температуры 3.5.2 Зависимость константы равновесия химической реакции MgCl2 + H2O = MgO + 2HCl от температуры приведено в таблице 2.20. Таблица 2.20 – Зависимость константы равновесия от температуры
Вывести уравнение зависимости константы равновесия реакции от температуры и графическим способом рассчитать тепловой эффект реакции в приведённом интервале температур. Решение Выявим характер зависимости константы равновесия от температуры в координатах lnКР - Таблица 2.21 – Зависимость lnКР -
На основании таблицы 2.21 построим график в координатах lnKP- 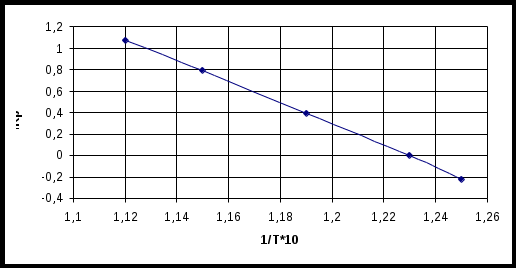 Hисунок 2.2 Зависимость lnKP реакции от Из графика видно, для рассматриваемой системы зависимость lnКР- lnКР = - где ΔН – тепловой эффект химической реакции В этом случае уравнение зависимости константы равновесия реакции от температуры можно получить как уравнение прямой, проходящей через две точки, лежащих на приведённой прямой. Выпишем координаты двух точек, лежащих на прямой: a(1/T1 = 1,12∙10-3; lnКР1=1,07); b(1/T2 = 1,25∙10-3; lnКР2= - 0,22) Уравнение прямой, проходящeй через две точки, лежащих на этой прямой, имеет вид (y – y1)/(y2 – y1) = (x – x1)/(x2 – x1) С учётом координат построенного графика можно записать (lnКР – lnКР1)/( lnКР2 – lnКР1) = (1/T – 1/T1)/( 1/T2 – 1/T1) Подставив численные значения координат точек, получим (lnКР – 1,02)/( - 0,22 – 1,07) = (1/T – 1,12∙10-3)/( 1,25∙10-3 – 1,12∙10-3) Решая уравнение относительно lnКР, получим lnКР = В нашем случае тепловой эффект химической реакции не зависит от температуры в приведённом интервале температур и определяется как тангенс угла наклона (β) прямой lnКР = f( ΔН = R∙tgβ Величину tgβ определим из треугольника abc, как tgβ = Тогда тепловой эффект процесса реакции составит ΔН = 8,31∙9923 = 82460 Дж. Ответ: lnКР = 3.7 Расчёт равновесий по термическим данным 3.7.1 Определить константу равновесия химической реакции NiS(тв.) + Н2О(газ) = NiО(тв.)+ H2S(газ) при температуре 600, воспользовавшись справочными данными. Решение Константу равновесия реакции рассчитаем по уравнению lnKP = - Изменение свободной энергии при 600 К рассчитаем по уравнению где Рассчитаем СР = для участников реакции. NiS H2O NiO H2S - Тогда тепловой эффект химической реакции при 298 К составит (-239,74) + (-20,60) – (-20,60) – (-241,8) = 60,97 кДж = 60970 Дж Изменение энтропии для химической реакции составит 37,99 + 205,70 – 52,97 – 188,72 =1,95 Дж/К Изменение теплоёмкости химической реакции составит ∆СР= СР(NiO) + СР(H2S) - СР(NiS) - СР(H2O) = -20,88 + 157,23∙10-3∙T + 16,28∙105∙T-2 + 29,37 + 15,40∙10-3∙T – 38,70 – 26,76∙10-3∙T - 30,00 -10,71∙10-3∙T – 0,33∙105∙T-2 = -60,31 + 135,17∙10-3∙T + 15,95∙105∙T-2 После подстановки величин Тогда Откуда Ответ: 6,72∙10-6. 3.7.2 На основе справочных данных по методу Тёмкина-Шварцмана рассчитать константу равновесия химической реакции FeS(тв.) + 3Fe3O4((тв.) = 10FeO(тв) = SO2(газ) при температуре 1300 К. Решение Константу равновесия реакции рассчитаем по уравнению lnKP = - Изменение энергии Гиббса химической реакции по методу Тёмкина-Шварцмана рассчитывается по уравнению где Рассчитаем СР = для участников реакции. FeO SO2 Fe3O4 FeS - Тогда тепловой эффект химической реакции при 298 К составит 10(-264,85) + (-295,90) – 3(-1117,13) – (-96.03) = 502,02 кДж = 502020 Дж Изменение энтропии для химической реакции составит 10∙60,73 + 248,07 – 3∙146,19 – 60,29 = 356,11 Дж/К Изменение теплоёмкости химической реакции составит ∆СР=10СР(FeO) + СР(SO2) – 3СР(Fe3O4) – СР(FeS) = 10∙50,80 + 10∙8,61∙10-3∙T -10∙3,3∙105∙T-2 + 46,19 + 7,87∙10-3∙T –7.70∙105∙T-2- 3∙86,27 – 3∙208,92∙10-3∙T – 50,42 -11,42∙10-3∙T = 244,06 – 544,21∙10-3∙T – 40,80∙105∙T-2 Таким образом, имеем Из приложения находим Мо = 0,7091; М1= 0,3860∙103; М-2 = 0,3340∙105 После подстановки численных значений в уравнение Тёмкина – Шварцмана получим Тогда lnKP = Откуда КР = Ответ: 4,93∙10-5 |
