сроп. ФКХ+СРО+doc+(2). Общие рекомендации по выполнению самостоятельной работы обучающегося
 Скачать 0.82 Mb. Скачать 0.82 Mb.
|
|
3.8 Термодинамическая теория растворов 3.8.1 Рассчитать растворимость СО2 в воде (моль/дм30, если парциальное давление СО2 над раствором равно 1,013∙105 па, а постоянная Генри равна 0,6∙10-9 при концентрации СО2, выраженной в молярных долях. Решение Согласно закону Генри можно записать Х где Х Г Р Рассмотрим 1 дм3 раствора. Масса раствора из-за малой растворимости СО2 практически составит 1000 г.Тогда в растворе будет содержаться содержится молей воды n 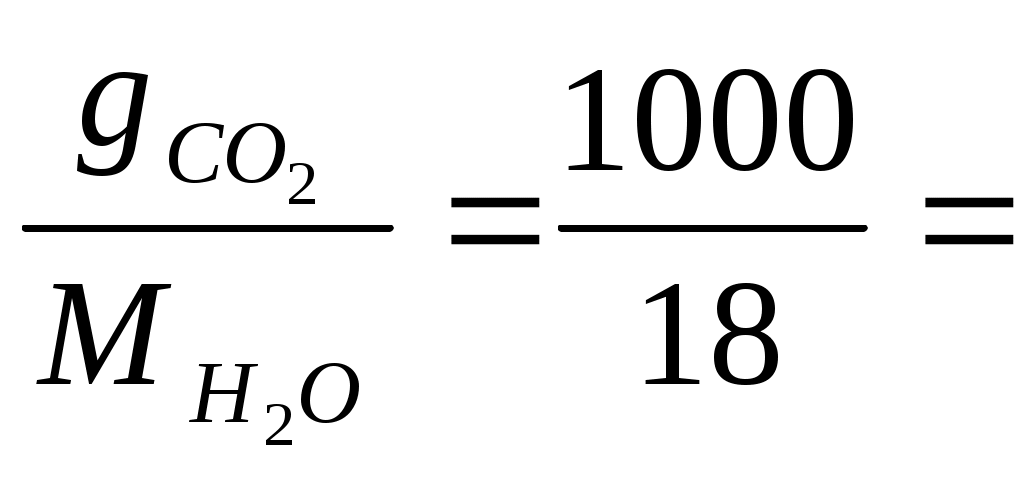 55,56 55,56Тогда молярная доля СО2 в растворе составит Х 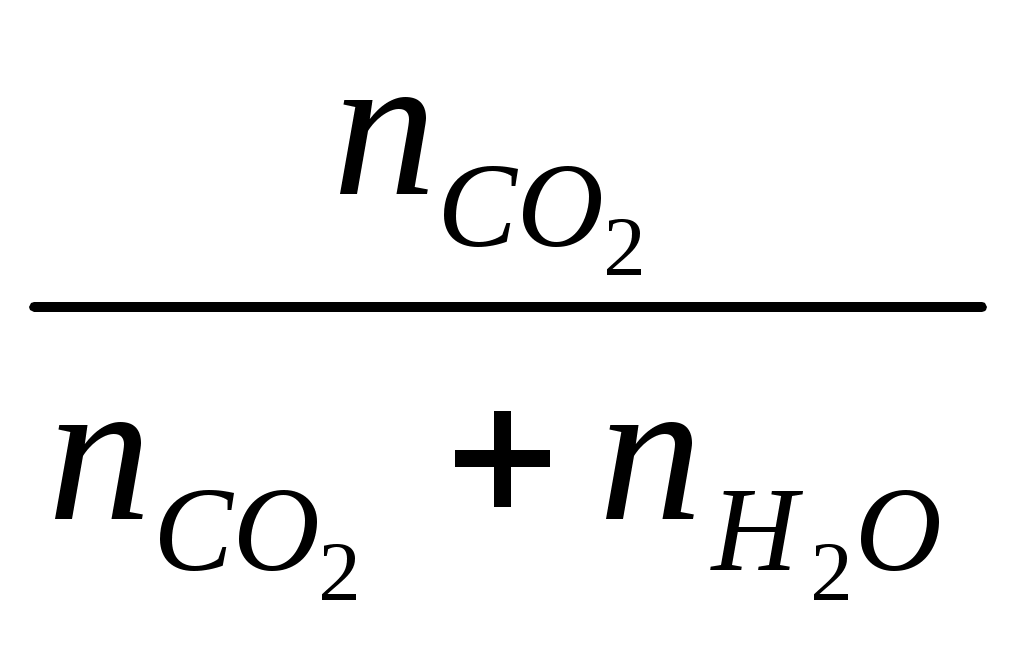 Поскольку n Х 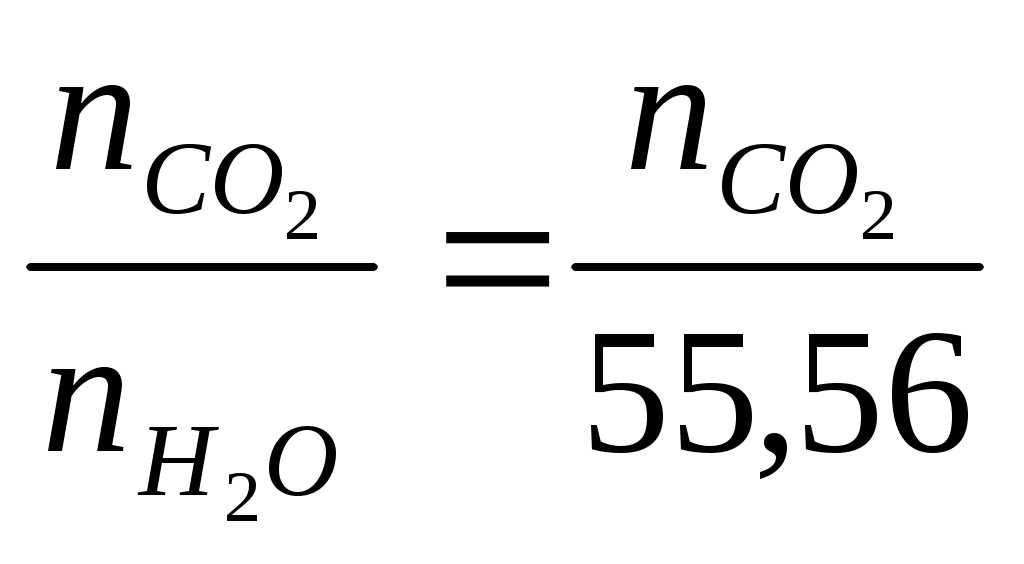 Тогда с учётом закона Генри можно записать Решая уравнение, получим n Таким образом в 1 дм3 воды содержится 3,38∙10-3 моль СО2. Тогда растворимость СО2 составит 3,38∙10-3 моль/дм3. Ответ: 3,38∙10-3 моль/дм3 3.8.2 Температура плавления чистого золота составляет 1275,7 К, а температура начала кристаллизации золота из расплава Au – Pb, содержащего 5,5% по массе свинца равна 1272,6 К.Определить тепловой эффект процесса плавления золота. Решение При растворении свинца в расславленном золоте приводит к понижению температуры, по сравнению с температуры плавления чистого золота. Понижение температуры плавления выражается уравнением ΔТ = где То – температура плавления чистого золота (растворителя), К; Х – концентрация растворённого свинца, мольная доля; ΔТ – понижение температуры плавления раствора, К. ΔН – тепловой эффект процесса плавления чистого золота, Дж/моль. Тогда теплота плавления чистого золота определится из уравнения ΔН = Понижение температуры плавления раствора составит ΔТ = То – Т = 1275,7 – 1272,2 = 3,5 К где Т – температура начала кристаллизации золота из раствора, К. Для расчёта концентраций компонентов расплава в мольных долях рассмотрим 100 г расплава. В нём содержится 5,5 г Pb и 94,5 г Au. Тогда число молей Pb и Au в расплаве составит nPb = nAu = Тогда молярная доля Pb в расплаве составит ХPb = Тогда теплота плавления чистого золота составит ΔН = Ответ: 206431 Дж 3.8.3 Давление насыщенного пара над чистым железом при 1800 К составляет 6,13 Па. Рассчитать давление насыщенного железа при данной температуре над расплавом, приготовленным из 50 г Fe и 30 г, Mn, если образующийся раствор считать совершенным. Решение Поскольку каждый компонент совершенного раствора подчиняется закону Рауля, то парциапьное давление пара над раствором составит PFe = XFe∙P где PFe - парциальное давление насыщенного пара железа над раствором, Па; P XFe – молярная доля железа в расплаве Рассчитаем состав раствора. Число молей железа и марганца в расплаве составит nFe = nMn = g – масса металла, г; М – молекулярный вес металла, г. Тогда молярная доля железа в расплаве составит Х = Тогда парциальное давление насыщенного пара железа над раствором составит PFe = 0,621∙6,13 = 3,81 Па Ответ: 3,81 Па. 3.8.4 При 2000 К давление насыщенных паров над чистыми железом и никелем составляет соответственно 70,4 и 4520 Па. Рассчитать состав расплава, при котором общее давление пара над раствором составит 4000 Па, если раствор считать совершенным Решение Общее давление пара над совершенным железо - никелевым раствором составит P = XFe∙P где P – общее давление насыщенных паров железа м никеля над раствором, Па; P XFe, XNi – молярные доли железа и никеля в расплаве соответственно. После подстановки численных значений общего и парциальных давлений компонентов получим 4000= XFe∙70,4 + XNi∙4520 С другой стороны XFе + XNi = 1 или XFе =1 - XNi Тогда можно записать 4000 = (1 - XNi e)∙70,4 + XNi∙4520 Откуда получим XN = 0,85; XFе =0,15 Ответ: 0,85; 0,15. 3.8.5 Коэффициент распределения фосфора между шлаком и металлом составляет 60, если концентрация фосфора в металле выражена в массовых процентах. Для дефосфации 200 т металла, содержащего 0,06 % по массе фосфора, использовали 10 т шлака. Рассчитать конечное содержание фосфора в металле. Решение Дефосфация металла осуществляется смешением фосфор содержащего металла и шлака, не содержащего фосфор. При смешении фосфор из металла переходит в шлак до установления равновесного состояния системы металл-шлак. Для установившегося равновесия коэффициент распределения фосфора между шлаком и металлом определится уравнением 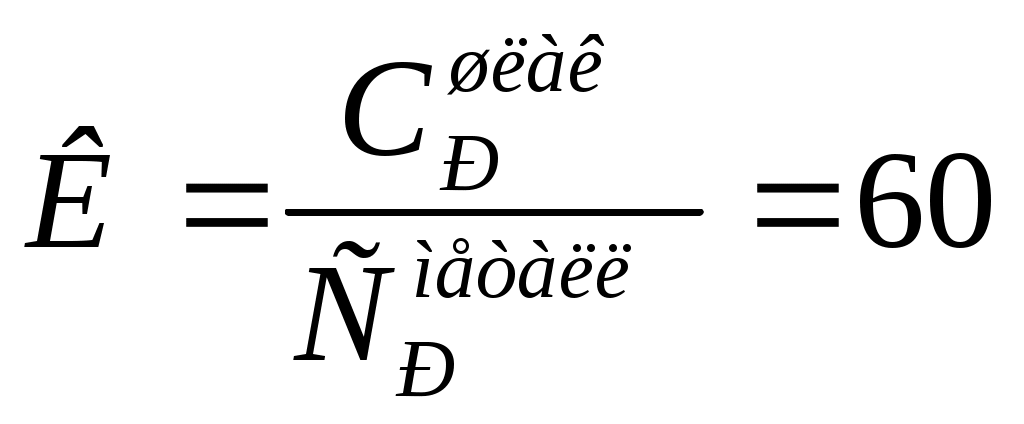 где С К- константа распределения Начальное количество фосфора в металле составляет g Обозначим через х т массу фосфора, которая перейдет из металла в шлак в процессе дефосфации металла. Тогда в металле останется 0,12 –х т фосфора. Тогда равновесные концентрации фосфора в шлаке и металле в массовых процентах составят С С Тогда коэффициент распределения фосфора между шлаком и металлом выразится уравнением 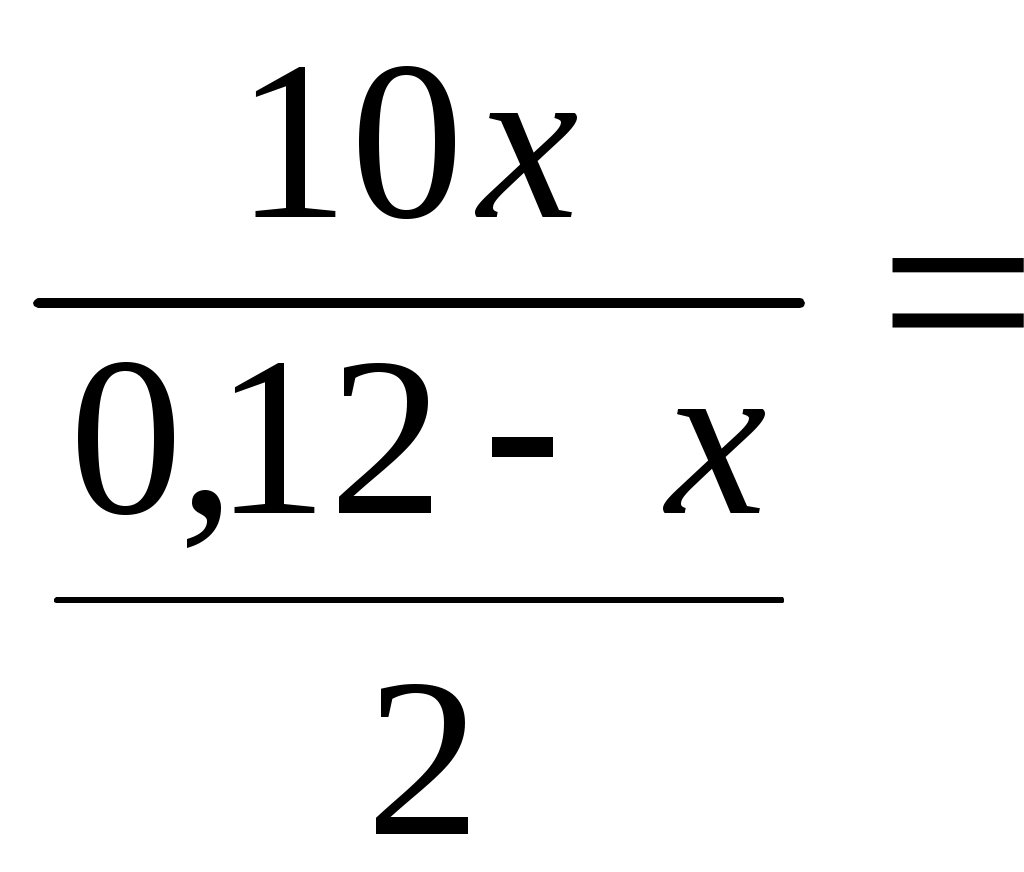 60 60Решая уравнение, получим х = 0,09 т Тогда в металле останется фосфора 0,12 – 0,09 =0,03 т Остаточная концентрация фосфора в металле после процесса дефосфации составит С Ответ: 0,015 % 3.8.6 Зависимость давления насыщенного пара магния от состава Mg - Cu расплава при 1000 К приведена в таблице 2.22. Таблица 2.22 – Давление насыщенного пара магния над Mg – Cu расплавом
Определить активность и коэффициент активности магния и характер отклонения от закона Рауля, если концентрация магния выражена в молярных долях. Решение Для расчёта активности магния принимаем за стандартное состояние чистый магний. Тога активность магния определится уравнением где РMg – давление насыщенных паров магния над Сu – Mg расплавом, Па; Р Коэффициент активности магния рассчитаем по уравнению где γ – коэффициент активности; ХMg – молярная доля магния в расплаве. Результаты расчётов сведём в таблицу 2.23 Таблица 2.23 – Активность и коэффициент активности магния в Сu – Mg расплаве
Так как коэффициент активности γMg < 1, то имеет место отрицательное отклонение от закона Рауля. 3.9 Кинетика химических реакций 3.9.1 Константа скорости некоторой химической реакции первого порядка равна 2,05∙10-3 мин-1. Определить период полураспада химической реакции и рассчитать, сколько процентов исходного вещества прореагирует за 25 минут и за какой период времени прореагирует 90% исходного вещества. Решение Для реакции первого порядка период полураспада реакции определяется уравнением t1/2 = где k – константа скорости химической реакции, мин-1. После подстановки численных значений, получим t1/2 = Кинетическое уравнение химичкой реакции первого порядка выражается равнением kt = где х – количество вещества, прореагировавшего за время t, %. Рассчитаем, какое количество вещества прореагирует за 25 минут. После подстановки численных значений получим 2,05∙10-3∙25 =ln 0,0513 = ln e0,0513 = 1,0523 = х = 5.0 % Рассчитаем период времени, за которое прореагирует 90% исходного вещества 2,05∙10-3∙t = ln 2,05∙10-3∙t = ln t = 1123 мин = 18,71 час. Ответ: 5,64 час; 5.0 %; 18,71 час. 3.9.2 На нагретой до 1373 К вольфрамовой проволоке аммиак разлагается по реакции 2NH3 = N2 +3H2 Определить порядок реакции, если при начальном давлении аммиака 3.5∙104 Па период полураспада реакции составляет 7,6 минут, а при начальном давлении аммиака 1,72∙104 Па период полураспада составляет 3,7 минут. Решение Если известны значения периодов полураспада реакции при двух начальных концентрациях исходного вещества, то порядок реакции можно рассчитать по уравнению n = 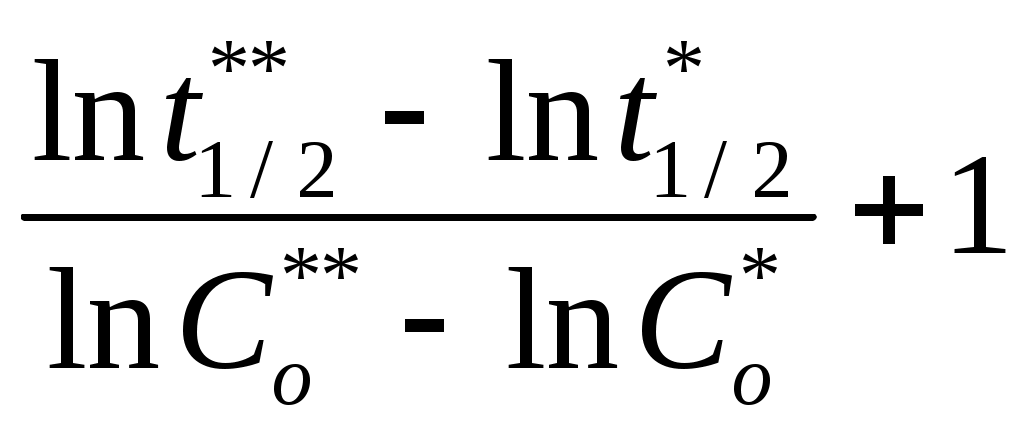 Поскольку величина давления аммиака пропорциональна его концентрации, порядок исходной реакции можно рассчитать по уравнению 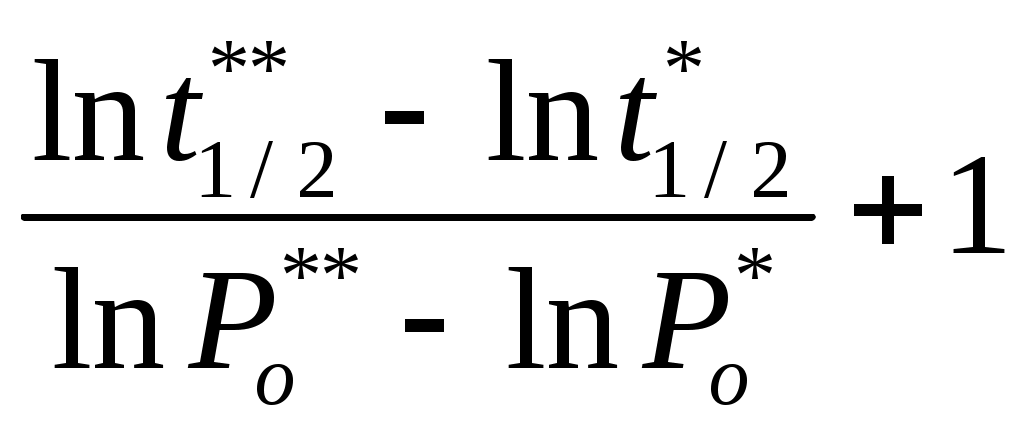 n = После подстановки в последнее уравнение численных значений получим n = Ответ: 2. 3.9.3 Определить энергию активации химической реакции Cu + (NH4)2S2O8 = CuSO4 + (NH4)2SO4 если известны константы скорости данной реакции при различных температурах (Таблица 2.24) Таблица 2.24 –Значения константы скорости реакции при различных температурах
Решение Зависимость скорости химической реакции от температуры выражается уравнением lnk = где k – константа скорости химической реакции; Е – энергия активации химической реакции, Дж/моль Приведём исходные данные к виду (Tаблица 2.25) Таблица 2.25 – Значения lnk в зависимости от 1/Т .
По полученным данным строим график lnk = f( 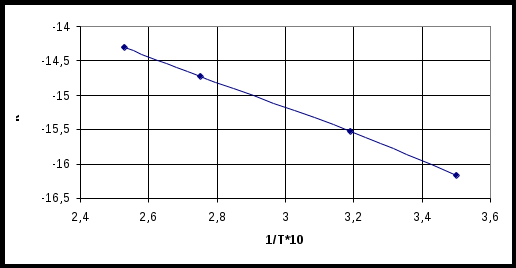 Рисунок 2.5 Зависимость lnk = f( Из сравнения графика с уравнением зависимости скорости химической реакции от температуры следует Е = R∙tgβ где β – угол наклона прямой lnk = f( Тангенс угла наклона найдём из треугольника abc, построенного через конечные точки, лежащие на искомой прямой tgβ = Тогда энергия активации химической реакции составит Е = 8,31∙31299 = 260094 Дж/моль Ответ: 260094 Дж/моль 3.9.4 Рассчитать константу скорости химической реакции и концентрацию исходных веществ через 2 часа СO + Cl2 = COCl2 если известны опытные данные (Таблица 2.26) Таблица 2.26 – Зависимость концентрации реагирующих веществ от времени
Принять, что скорость реакции подчиняется уравнению скорости реакции второго порядка. Решение Кинетическое уравнение реакции второго при выражении скорости реакции через исходные вещества при условии одинаковых начальных концентраций исходных веществ имеет вид - После разделения переменных уравнения получим - Определённое интегрирование уравнения в пределах С1 – С2 и t1 – t2 соответственно даёт 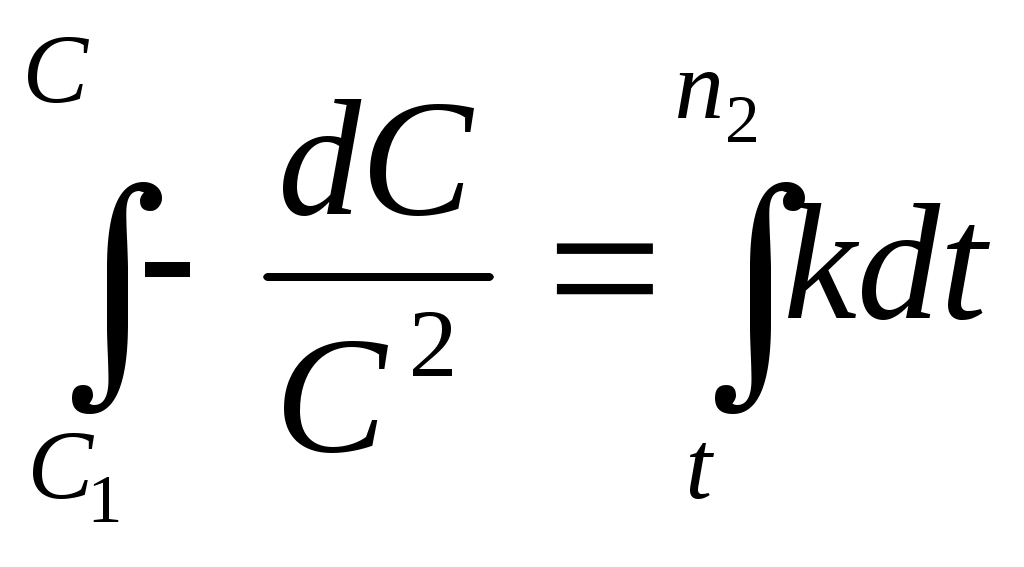 или Откуда получим k = 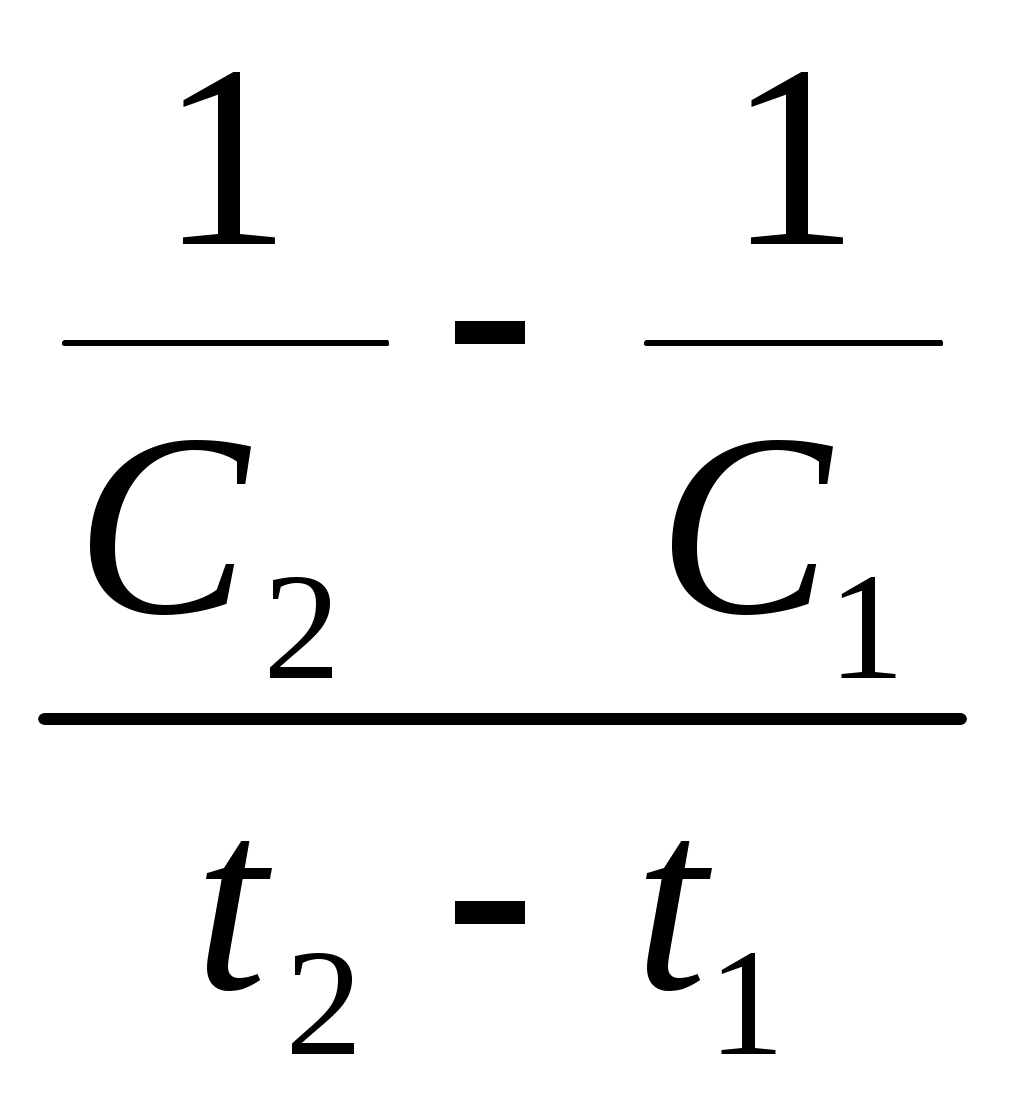 Рассчитаем несколько значений константы скорости химической реакции k1 = 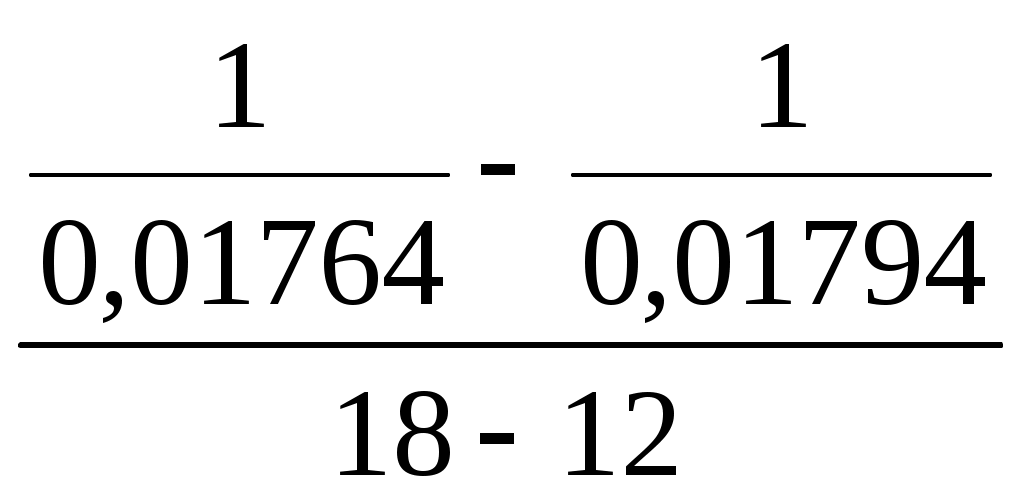 = 0,158 = 0,158 k2 = 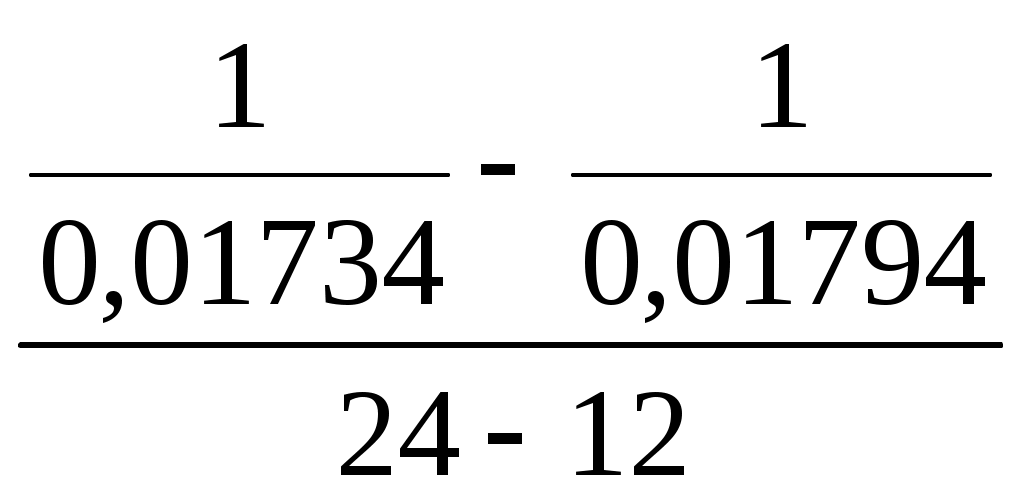 = 0,160 = 0,160k3 = 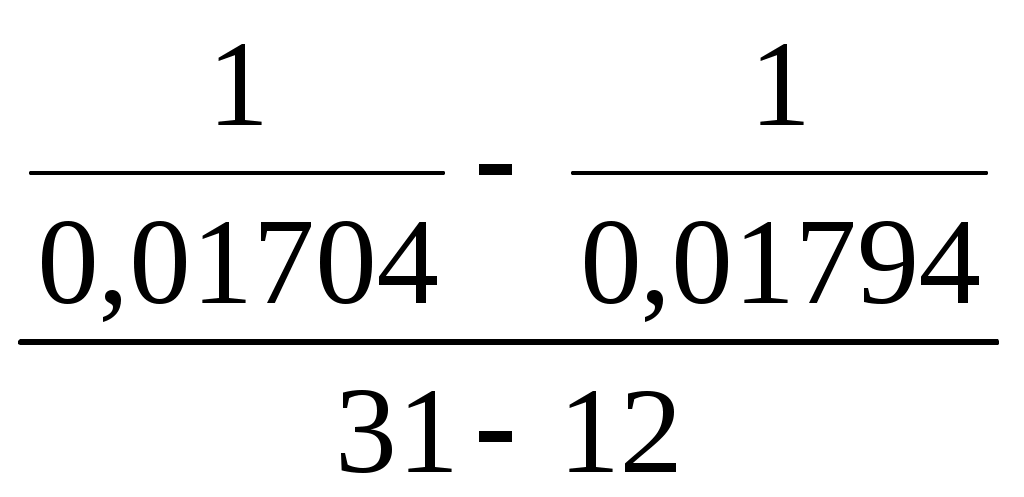 = 0,155 = 0,155Средняя величина константы скорости химической реакции составит k = Концентрацию СО = Сl2через 2 часа, равную С2, рассчитаем по уравнению или После подстановки численных значений получим С2 = 0,0137 кмоль∙м-3 Ответ: 0,0137 кмоль∙м-3 3.9.5 Во сколько раз надо изменить давление в системе СO + Cl2 = COCl2 чтобы скорость прямой реакции увеличилась в 16 раз. Решение Считая, что начальные концентрации СO и Cl2 одинаковы, для скорости этой химической реакции можно записать w = kС2 где k - константа скорости химической реакции. Проведём два опыта при различных начальных концентрациях исходных веществ. Тогда уравнение скоростей химической реакции составит w1 = kС где С1,о и С2,о – начальные концентрации исходных веществ в опыте 1 и 2 соответственно. По условию задачи имеет место соотношение между скоростями реакций 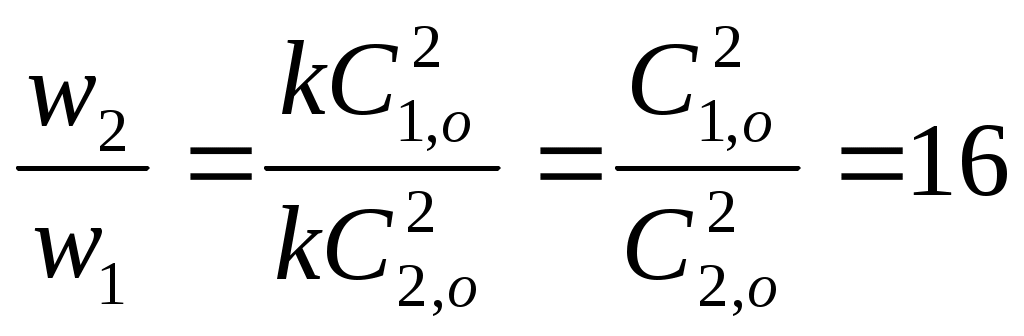 или С другой стороны концентрация исходных веществ может быть выражена уравнением Сi = где Сi - концентрация реагирующего вещества, моль/дм3; ni – число молей i – го компонента, содержащегося в объёме V. Тогда соотношение между скоростями реакции можно записать в виде 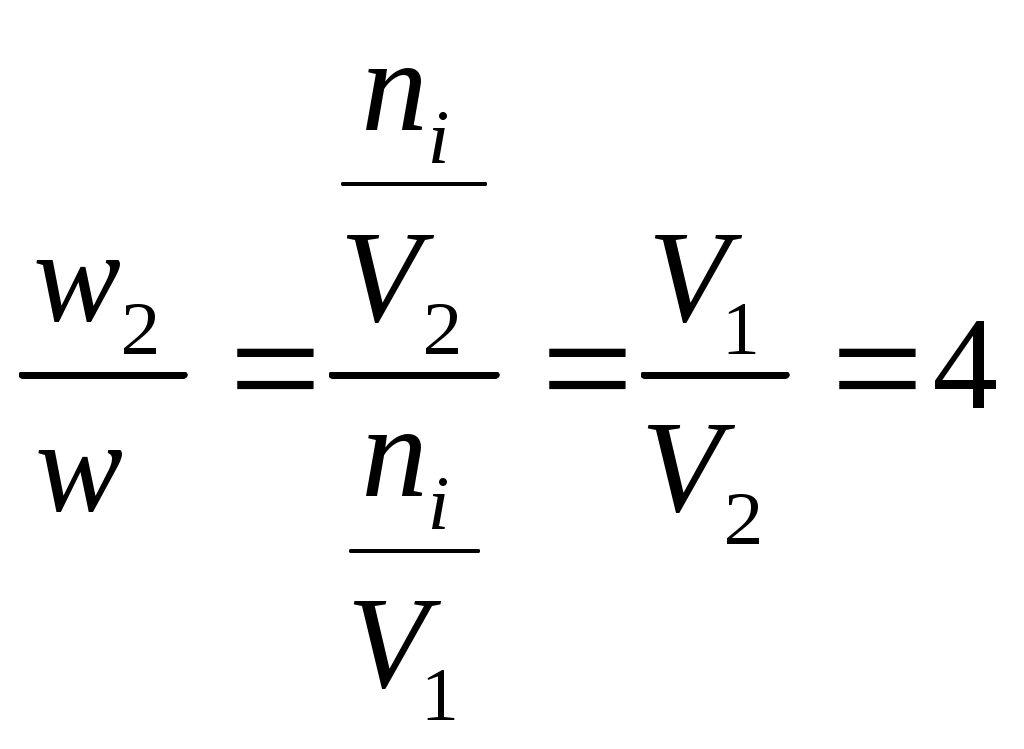 Таким образом, чтобы скорость реакции возросла в 16 раз необходимо уменьшить объём реагирующих веществ в 4 раза. Это означает, что давление в системе надо увеличить в 4 раза. Ответ: Увеличить давление в системе в 4 раза. |
