Курсовая. КР Денискин А.В (исправленный ). Оценка чистоты лекарственной субстанции натрия йодида
 Скачать 385.96 Kb. Скачать 385.96 Kb.
|
Прозрачность раствораРаствор 2 г субстанции в 20 мл воды, свободной от диоксида углерода, должен быть прозрачным. Прозрачность и степень мутности жидкостей определяют путем сравнения испытуемой жидкости с растворителем или эталоном. Испытуемую жидкость считают прозрачной, если она выдерживает сравнение с водой или растворителем, или её мутность не превышает мутность эталона I. 40-мм слой испытуемой жидкости сравнивают с 40-мм слоем свежеприготовленного эталона в пробирках с внутренним диаметром от 15 до 25 мм, просматривая образцы вдоль вертикальной оси пробирок на черном фоне. Эталонами для определения степени мутности служат взвеси из гидразина сульфата и гексаметилентетрамина. Эталонов мутности согласно ГФУ – четыре. Цветность раствораРаствор, полученный в испытании на «Прозрачность раствора», должен быть бесцветным. Раствор считают бесцветным, если он выдерживает сравнение с водой или растворителем или окрашен не более интенсивно, чем эталон. ЩелочностьК 12,5 мл раствора, полученного в испытании на «Прозрачность раствора», прибавляют 0,1 мл 0,05 % раствора бромтимолового синего. Цвет раствора должен измениться от прибавления не более 0,5 мл 0,01 М раствора хлористоводородной кислоты. При определении реакции среды раствора ГФУ рекомендует использовать два метода: инструментальный и индикаторный (колориметрический или определение кислотности и/или щелочности). Потенциометрический метод (физико-химический (электрохимический) метод) определения рН основан на измерении электродвижущей силы элемента, составленного из стандартного электрода (с известным значением потенциала) и индикаторного электрода, потенциал которого зависит от рН испытуемого раствора. Для установления рН среды используют потенциометры или рН-метры различных марок. Потенциометрический способ определения рН отличается от колориметрического более высокой точностью и обычно используется для анализа инъекционных растворов. Индикаторный метод определения рН основан на свойстве индикаторов изменять свою окраску при определенных интервалах значений рН среды. Интервалы перехода окраски различных индикаторов приведены в таблице ГФУ: «Зависимость между реакцией среды, приблизительным значением рН и цветом индикаторов». Испытания на наличие примесей В йодиде натрия могут быть примеси карбонатов, цианидов, нитратов, йодатов, растворимых солей бария. Все эти примеси ядовиты и поэтому содержание их в препаратах не допускается [10]. Испытание на сульфаты (ОФС «Сульфаты», метод 2). 1 г субстанции растворяют в 15 мл воды. К 4,5 мл стандартного раствора сульфат-иона спиртового (10 мкг/мл) прибавляют 3 мл бария хлорида раствора 25 %, встряхивают и выдерживают в течение 1 мин. Испытуемый раствор. К 2,5 мл описанного выше раствора прибавляют 15 мл раствора испытуемого образца, приготовленного, как указано в фармакопейной статье, и 0,5 мл уксусной кислоты разведенной 30 %. Эталонный раствор готовят с теми же количествами реактивов и в тех же условиях, используя вместо раствора испытуемого образца 15 мл стандартного раствора сульфат-иона (10 мкг/мл). Через 5 мин сравнивают мутность испытуемого и эталонного растворов. Мутность, появившаяся в испытуемом растворе, не должна превышать мутность эталонного раствора. Примечание. Если после прибавления хлористоводородной кислоты разведенной 8,3 % в анализируемом растворе появляется желтая окраска, для ее обесцвечивания прибавляют 0,05 – 0,10 мл 0,1 М раствора натрия тиосульфата; равный объем 0,1 М раствора натрия тиосульфата прибавляют в раствор сравнения [23]. Испытание на соли железа неорганических соединений (ОФС «Железо», метод 2). 0,5 г субстанции растворяют в 10 мл воды. Испытуемый раствор. 10 мл раствора испытуемого образца, приготовленного, как указано в фармакопейной статье. Эталонный раствор. 10 мл стандартного раствора 1 мкг/мл железо(III)-иона. К испытуемому и эталонному растворам прибавляют по 2 мл лимонной кислоты раствора 20 % и 0,1 мл тиогликолевой кислоты, перемешивают, добавляют аммиака раствор 10 % до щелочной реакции по универсальной индикаторной бумаге, доводят объем раствора водой до 20 мл, перемешивают и через 5 мин сравнивают окраску растворов. Испытание на соли тяжелых металлов растворов лекарственных веществ (ОФС «Тяжёлые металлы»). 1 г субстанции растворяют в 10 мл воды. К 10 мл испытуемого раствора, доведенного предварительно, если нужно, до нейтральной или слабокислой реакции уксусной кислотой или раствором едкого натра, прибавляют 1 мл разведенной уксусной кислоты, 1-2 капли раствора сульфида натрия и через 1 минуту сравнивают с эталоном, состоящим из 10 мл 0,00005% раствора свинец-иона и такого же количества реактивов, какое добавлено к испытуемому раствору. Наблюдение окраски производят по оси пробирок, размещенных на белой поверхности. В сравниваемых растворах допускается слабая опалесценция от серы, выделяющейся из полисульфидов натрия, присутствующих как примесь в растворе сульфида натрия. Испытание на мышьяк Метод 1 (эталонный метод) Навеску испытуемого препарата помещают в реакционную колбу (рис. 1.), туда же добавляют 20 мл разведенной соляной кислоты, 10- 12 капель раствора дихлорида олова, 2 г гранулированного цинка (без мышьяка) и тотчас закрывают колбу пробкой со вставленной в нее верхней частью прибора. Содержимое колбы осторожно взбалтывают и оставляют на 1 час. При этом температура реакционной смеси не должна превышать 40 °С. Параллельно в другом таком же приборе проводят контрольный опыт со всеми реактивами и добавлением 0,5 мл эталонного раствора мышьяка. Через 1 час полоску бумаги, пропитанную спиртовым раствором дихлорида ртути, помещают в водный раствор йодида калия. Через 10 минут раствор йодида калия сливают, полоску бумаги тщательно промывают несколько раз водой декантацией в том же стакане и сушат между листами фильтровальной бумаги. Полоска бумаги, взятая из прибора с испытуемым препаратом, не должна быть окрашенной, или окраска ее не должна быть интенсивнее окраски полоски бумаги в контрольном опыте. 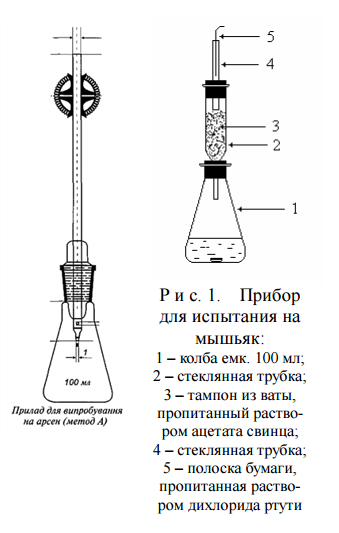 Определение примеси мышьяка в органических препаратах, а также в соединениях, выделяющих в условиях проведения испытания галогены, сероводород, сернистый ангидрид или фосфин, анализируют следующим образом. Навеску испытуемого препарата помещают в колбу прибора для испытания на мышьяк, приливают 10 мл концентрированной серной кислоты и кипятят до обугливания не менее 40 минут. Затем в горячий раствор по стенке приливают порциями по 3-4 мл пергидроль до обесцвечивания раствора, нагревают еще 10-15 минут и по охлаждении приливают 20 мл воды. Далее поступают, как описано выше. Испытание на отсутствие примесей цианидов 0,5 г субстанции растворяют в 5 мл воды, прибавляют 0,25 мл раствора железа(II) сульфата в серной кислоте, 0,1 мл 3 % раствора железа(III) хлорида, 1 мл 10 % раствора натрия гидроксида и нагревают. После подкисления хлористоводородной кислотой разведённой 8,3 % раствор не должен окрашиваться в синий цвет. Примечание. Приготовление раствора железа(II) сульфата в серной кислоте. 3,0 г железа(II) сульфата растворяют в смеси 3 мл свежепрокипячённой и охлажденной воды и 3 мл серной кислоты разведенной 9,8 %. Отсутствие примесей, не допускаемых в лекарственном веществе частной статьей, устанавливают по отрицательной реакции с соответствующими реактивами. Сравнение в этом случае проводится не с эталонным раствором, а с частью раствора препарата, к которому добавлены все реактивы, кроме основного, открывающего данную примесь. Положительная реакция в этом случае свидетельствует о наличии примеси и недоброкачественности лекарственного средства. Обнаружение цианид-ионов основано на взаимодействии их с двухвалентным железом с образованием иона гексацианоферрата (II). При последующем добавлении ионов трехвалентного железа выпадает синий осадок берлинской лазури. При невысоких концентрациях цианидов появляется синее окрашивание. Полученный комплекс устойчив в кислых растворах, поэтому реакцию проводят в присутствии разбавленной соляной кислоты. |
