Курсовая. КР Денискин А.В (исправленный ). Оценка чистоты лекарственной субстанции натрия йодида
 Скачать 385.96 Kb. Скачать 385.96 Kb.
|
Испытание на соли бария0,5 г субстанции растворяют в 10 мл воды, прибавляют 1 мл хлористоводородной кислоты разведенной 8,3 % и 1 мл серной кислоты разведенной 16 %; раствор должен оставаться прозрачным в течение 15 мин. Йодноватая кислота, тиосульфаты, сульфиты0,5 г субстанции растворяют в 10 мл свежепрокипяченной и охлажденной воды, прибавляют по 0,1 мл раствора крахмала и серной кислоты разведенной 16 %. В течение 30 с не должно появляться синее окрашивание, заметное при рассмотрении жидкости по оси пробирки. Синее окрашивание должно появиться от прибавления не более 1 капли 0,1 М раствора йода. НитратыК 1 г субстанции прибавляют 5 мл 10 % раствора натрия гидроксида, 0,5 г цинковых и 0,5 г железных опилок и нагревают. Выделяющиеся пары не должны вызывать синего окрашивания влажной красной лакмусовой бумаги. Микробиологическая чистотаВ соответствии с требованиями ОФС «Микробиологическая чистота» ОФС.1.2.4.0002.15. Определение потери в массе лекарственного препарата методом высушивания Около 1,0 г субстанции, растёртой в мелкий порошок высушивают в течение 2 ч в сушильном шкафу в пределах температурного интервала, указанного в фармакопейной статье или нормативной документации. Затем открытый бюкс вместе с крышкой помещают в эксикатор для охлаждения на 50 мин, после чего закрывают крышкой и взвешивают. Последующие взвешивания проводят после каждого часа дальнейшего высушивания до достижения постоянной массы. При отсутствии других указаний пробу сушат до постоянной массы при температуре от 100 до 105ºС. Количественное определение Около 0,3 г (точная навеска) субстанции, предварительно высушенной при температуре от 100 до 105 °С в течение 4 ч, растворяют в 30 мл воды, прибавляют 1,5 мл уксусной кислоты разведенной 30 % и титруют 0,1 М раствором серебра нитрата до перехода окраски осадка от желтой к розовой (индикатор – 0,3 мл 0,1 % раствора эозина Н). Параллельно проводят контрольный опыт. 1 мл 0,1 М раствора серебра нитрата соответствует 14,99 мг натрия йодида NaI. Обсуждение результатовПодлинность Определение натрия А. Реакция с гексагидроксостибатом(V) калия K[Sb(OH)6] с образованием белого кристаллического осадка, растворимого в щелочах. NaCl + K[Sb(OH)6] = Na[Sb(OH)6] + KCl Условия проведения реакции: а) достаточная концентрация Na+; б) нейтральная реакция раствора; в) проведение реакции на холоду; г) потирание стеклянной палочкой о стенку пробирки. Мешающие ионы: NH4+, Mg2+ и др. В кислой среде реагент разрушается с образованием белого аморфного осадка метасурьмяной кислоты HSbO3. 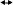 K[Sb(OH)6] + HCl KCl + H3SbO4 + 2 H2O K[Sb(OH)6] + HCl KCl + H3SbO4 + 2 H2O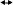 H3SbO4 HSbO3 + H2O H3SbO4 HSbO3 + H2OБ. Соль натрия, смоченная хлористоводородной кислотой 25 % и внесенная в бесцветное пламя, окрашивает его в желтый цвет. Открытие иодида А. Реакция окисления йодид-иона до элементарного галогена. К раствору ЛФ добавляют разведенную серную кислоту, хлороформ, нитрит натрия или хлорид окисного железа (FeCl3), встряхивают, дают отстояться. Хлороформный слой окрашивается в фиолетовый цвет. 2KI + 2NaNO2 + 2H2SO4 → I2 + K2SO4 + Na2SO4 + 2NO↑ + 2H2O Б. Реакция с раствором нитрата серебра в присутствии азотной кислоты. КI +AgNO3 →AgI+КNO3 Ag+ + I- = AgI↓ Образуется желтый творожистый осадок. Осадок нерастворим в растворах аммиака. Проверка осадка на растворимость: осадок AgI не растворяется в азотной кислоте. Практически не растворяется в водном растворе аммиака (в отличие от AgCl и AgBr), вследствие чего анион йода не мешает открытию анионов хлора и брома. Выполнение: полученный осадок разделить на две части. К одной – прилить несколько капель азотной кислоты, к другой – водный раствор аммиака. Напишите уравнение реакции в молекулярной и ионной форме. В. Реакция взаимодействия иодида калия и серной кислоты, выделяются пары фиолетового цвета. 8KI + 5H2SO4 Вывод: ЛФ соответствует своему наименованию. Известны также методы не фармакопейные на йод: Реакция с железа (III) хлоридом в присутствии хлороформа: 2I - + Fe3+ I2 + Fe2+ К 2 мл раствора йодида (3 – 20 мг йодид-иона) прибавляют 0,2 мл серной кислоты разведенной 16 %, 0,2 мл натрия нитрита раствора 10 % или железа(III) хлорида раствора 3 % и 2 мл хлороформа; при взбалтывании хлороформный слой окрашивается в фиолетовый цвет [6-9]. Реакция с хлорной водой Cl2 (раствор хлора в воде): хлорная вода окисляет ионы йода до свободного йода: 2I - + Cl2 = I2 + 2Cl- Выделяющийся йод легко обнаружить крахмалом (синее окрашивание) или взбалтыванием раствора с органическим растворителем (красно-фиолетовое окрашивание). Если прибавит избыток хлорной воды, то окраска не появится – свободный йод превращается в бесцветную йодноватую кислоту НIО3: I2 + 5Cl2 + 6Н2О = 2НIО3 +10Н+ + 10Cl- Потерю в массе при высушивании (Х) в процентах вычисляют по формуле: 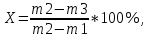 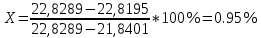 где: m1 – масса бюкса, доведенного до постоянной массы, г; m2 – масса бюкса с испытуемым образцом до высушивания, г; m3 — масса бюкса с испытуемым образцом после высушивания, г. Таблица 2. Результаты испытаний на наличие примесей
Нормированный предел содержания примеси в препарате определяется по формуле: СН= СЭ·V·Р/ А (1). С Э –концентрация данной примеси в эталонном растворе, %; С Н –нормированный предел содержания примеси в препарате, %; А –навеска препарата, взятая для приготовления раствора примеси, г; V –объем приготовленного раствора примеси, мл; Р –кратность разведения приготовленного раствора при приготовлении из него испытуемого раствора. Испытание на сульфаты основано на реакции: Ba2+ + SO4 2- BaSO4 (белый осадок) Растворы доводят до нейтральной реакции как указано в монографии ГФ, затем добавляют кислоту уксусную и раствор бария хлорида. Для увеличения чувствительности реакции к испытуемому раствору прибавляют 1,5 мл эталонного раствора сульфат-иона (10 ррm). Реакция проводится в уксуснокислой среде, так как бария хлорид осаждает не только сульфаты, но и дает осадки со всеми анионами первой группы (карбонат-ион, фосфат-ион, тиосульфат-ион) [1]. Примесь цианидов определяется по образованию берлинской лазури. 2CN- + Fe2+ → Fe(CN)2 Fe(CN)2 + 4NaCN → Na4[Fe(CN)6] 3Na4[Fe(CN)6] + 4FeCl3 → Fe4[Fe(CN)6] 3 + 12NaCl Испытание на катион бария основано на реакции: Ba2+ + SO4 2- BaSO4 (белый осадок) Растворы солей железа с раствором кислоты тиогликолевой, в присутствии кислоты лимонной и раствора аммиака, образуют соединения, окрашенные в розовый цвет: Fe3+ + 2HS-CH2COOH + 5NH3∙H2O → [Fe(OH)(SCH3COO- )2] 2- + 5NH4+ + 4H2O Йодаты: после прибавления кислоты серной разведенной и крахмала, не должно наблюдаться синего окрашивания: IO3 - + 5I - + 6H+ 3I2 + 3H2O Тиосульфаты: после прибавления раствора йода и крахмала к раствору субстанции, должно наблюдаться синее окрашивание. Если присутствует недопустимая примесь тиосульфатов, то протекает следующая реакция (синее окрашивание не наблюдается) [1]: I2 + 2Na2S2O3 2NaI + Na2S4O6 Примесь нитратов открывается путем восстановления их до аммиака, который обнаруживается органолептически или по посинению влажной красной лакмусовой бумажки [10-16]. Zn + 2NaOH = Zn(ONa)2 +H2↑ 4H2 + NaNO3 = NH3↑ +NaOH + 2H2O Примесь йодатов (IO3-) определяется аналогично примеси броматов (буровато-коричневое окрашивание). 5NaI + NaIO3 + 6HCl = 3I2 + 6NaCl + 3H2O Метод А. Основан на восстановлении мышьяка из его соединений цинком в кислой среде до мышьяковистого водорода. Zn - 2e →Zn +2 As +3 + 6e →As -3 As +3 + 3H + →AsH3 Суммарно: 6Zn + As2O3 + 12HCl 2AsH3 + 3H2O + 6 ZnCl2 Далее мышьяковистый водород вступает в реакцию с ртути бромидом (ртутно-бромидная бумага), при этом образуется несколько продуктов: AsH3 + HgBr2 AsH2(HgBr) + HBr; AsH3 + 2HgBr2 AsH(HgBr)2 + 2HBr; AsH3 + 3HgBr2 As(HgBr)3 + 3HBr; AsH3 + As(HgBr)3 As2Hg3 + 3HBr. После промывания в воде и высушивания, на ртутно-бромидной бумаге остается пятно от светло- желтого (AsH2(HgBr)) до темно-коричневого (As2Hg3), интенсивность которого зависит от концентрации примеси мышьяка. Прибор для определения примеси мышьяка описан в ГФУ и представлен на рисунке. Определение проводят в двух приборах: I – с испытуемой субстанцией; II – с эталонным раствором. Реакция протекает в присутствии раствора олова (II) хлорида (являясь сильным восстановителем, он нейтрализует действие возможных окислителей); гранулированного цинка, кислоты хлористоводородной разведенной 18 и раствора калия йодида. Для улавливания сероводорода и сернистого газа (которые могут образовывать осадки черного цвета с ртути бромидом (Hg, HgS)) в нижнюю трубку помещают вату или бумагу, пропитанную свинца ацетатом. Температура водяной бани не должна превышать 40С. Таблица 3. Результаты испытаний на чистоту
Количественные определения Методы количественного определения: 1. Йодатометрия (ГФУ). Субстанцию титруют раствором калия йодата в присутствии кислоты хлористоводородной до перехода красной окраски в желтую. Затем добавляют хлороформ и титруют до обесцвечивания смеси, пересчет на сухое вещество (s=2): 5KI + KIO3 + 6HCl 3I2 + 6 KCl + 3H2O 2I2 + KIO3 + 6HCl 5ICl + KCl + 3H2O Суммарно: 2KI + KIO3 + 6HCl 3ICl + 3KCl + 3H2O 2. Аргентометрия (по Фаянсу); индикатор – эозинат натрия, (s=1). NaI + AgNO3 AgI + NaNO3 В момент эквивалентности осадок окрашивается в розовый цвет вследствие адсорбции индикатора на осадке. 3. Меркуриметрия без индикатора, (s=4). В точке эквивалентности появляется неисчезающий красный осадок. На примере натрия йодида: 4NaI + Hg(NO3)2 Na2[HgI4] + 2KNO3 Избыточная капля ртути нитрата реагирует с калия тетрайодомеркуратом и образуется красный осадок ртути (II) йодида: Na2[HgI4] + Hg(NO3)2 2HgI2 + 2NaNO3 Метод Фаянса Количественное определение проводят методом аргентометрии, вариант Фаянса, среда уксусной кислоты, индикатор – эозинат натрия. NaI +AgNO3 →AgI+NaNO3 Йодиды нельзя определять методом Мора, так как титрование их сопровождается образованием коллоидных систем йодида серебра и адсорбцией, что затрудняет установление конечной точки титрования. Поэтому йодиды определяют титрованием нитратом серебра с применением адсорбционных индикаторов, являющихся солями слабых органических кислот, например эозината натрия  По мере титрования йодида нитратом серебра образуется коллоидный осадок AgI, частицы которого обладают большой адсорбционной способностью. Заряженные положительно, они адсорбируют на своей поверхности отрицательно заряженные анионы индикатора и в эквивалентной точке вызывают изменение цвета осадка AgI от желтого до розового. Около 0,3 г (точная навеска) субстанции, предварительно высушенной при температуре от 100 до 105 С в течение 4 ч, растворяют в 30 мл воды, прибавляют 1,5 мл уксусной кислоты разведенной 30 % и титруют 0,1 М раствором серебра нитрата до перехода окраски осадка от желтой к розовой (индикатор – 0,3 мл 0,1 % раствора эозина Н). Расчет титра: f = 1 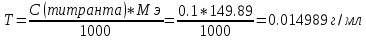 1 мл 0,1 М раствора нитрата серебра соответствует 0,01660 г калия йодида Содержание калия иодида в процентах (Х) вычисляем по формуле: 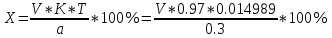 где V – объем 0,1 М раствора нитрата серебра; K – поправочный коэффициент, К=0,97; TNaI –0,014989 г/мл; a – масса препарата, взятого для анализа, г. Таблица 1. Отклонения значений количества иодида натрия
Распределим в порядке увеличения 98,91381; 98,96748; 99,02115; 99,02115; 99,12849. 1) Проведем оценку грубых промахов с использованием Q-критерия. Сомнительным значением может быть величина 98,91381. Q= (98,96748-98,91381)/( 99,12849-98,91381)=0,33 Табличное значение Qтабл при n=5 и P=0,95 равно Qтабл=0,73. Поскольку Qрассч=0,33 Qтабл=0,73, то значение 98,8657 не является грубым промахом. Выборка однородна. Рассчитаем среднее значение ср.знач. Определяем стандартное отклонение S=  =0,0612 =0,0612Для оценки сходимости результатов параллельных определений необходимо рассчитать величину относительного стандартного отклонения Sr Значение не превышает 2% - метод дает сходимые результаты. Определяем полуширину доверительного интервала среднего при n=5 и P=0,95. Коэффициент Стьюдента t0,95;4 = 2,57 [25-27]. Δ  Доверительный интервал среднего Рассчитываем относительную ошибку среднего Должно содержаться в субстанции ЛС не менее 99,0 % натрия йодида NaI в пересчете на сухое вещество. Следовательно полученные анализы доказали соответствие лекарственных форм ГФ: содержание натрия йодида |
