Производство карбамида. Курсовая работа. Курсовой 5 курс. Однак, в цих дослідах карбамід одержати взагалі не вдалося
 Скачать 0.53 Mb. Скачать 0.53 Mb.
|
|
ВСТУП Протягом століття після історичного синтезу сечовини з ціанати амонію, здійсненого Велером в 1828 р., було відкрито понад п'ятдесят способів отримання цього продукту, наприклад, з фосгену і аміаку, оксиду вуглецю та аміаку, шляхом гідролізу ціанаміду та ін Знаменним фактом є те, що володіє безперечними перевагами єдиний спосіб, який застосовується в світовій промисловій практиці, був відкритий видатним російським хіміком А. І. Базаровим. Базаров ставив досліди по тривалому нагріванню в запаяних трубках карбаміновокіслого і вуглекислого амонію та отримав карбамід. Відкрита російським хіміком реакція: 2NH3 + С02 = NH2COONH4 = СО(NH2)2 + Н20 Карбамід в продукційної суміші був ідентифікований дослідником як у вільному стані, так і у вигляді типових для нього подвійних сполук з азотною і щавлевої, кислотами. Природно, сто років тому Базаров не мав можливостей для реальної оцінки значення свого відкриття і перспектив практичного його використання. Для нього згадані досліди були лише одним з етапів проводилося систематичного дослідження будови різних сполук азоту. Тим не менш, з метою перевірки можливості зрушення рівноваги реакції в бік цільового продукту, Базаров зробив спробу введення в суміш вихідних речовин ряду водовіднімаючих агентів, зокрема, абсолютного С2Н5ОН. Однак, в цих дослідах карбамід одержати взагалі не вдалося. Карбамід було зафіксовано лише в тих дослідах, де нагрівався чистий карбамат амонію без усяких добавок. У світлі сучасних уявлень очевидно, що невдача Базарова в дослідах з добавками була обумовлена настільки малим ступенем заповнення трубки карбаматом амонію, коли конверсія мізерно мала. За життя Базарова відкритий ним спосіб отримання карбаміду практично невикористовувався. Перша в світі промислова установка з виробництва карбаміду з аміаку і діоксину вуглецю була пущена в 1922 р. в Німеччині. За минулі з того моменту роки реакція Базарова була ретельно і всебічно вивчена. Серед проведених досліджень чільне місце займають роботи радянських вчених Г. О. Яковкін, А. І. Красильщикова, Б. А. Болотова, Г. Д. Єфремової, Н. А. Гольдберга та ін Піонерами промислового освоєння виробництва карбаміду в СРСР є інженери В. В. Святухін, Н. М. Павлов, І. П. Білоусов. Зараз виробництво карбаміду, що отримало в останні роки загальне визнання як найбільш ефективної форми азотних добрив, порівняно з виробництвами інших продуктів азотної промисловості розвивається найбільш інтенсивно. Карбамід відноситься до числа пржежо-вибухонебезпечних продуктів, містить невелику кількість азоту, зберігає повну розсипчастість після тривалого зберігання у різних умовах. На відміну від аміачної селітри карбамід не викликає опіків листя, тому його можна застосовувати і для позакореневої підкормкі рослин. Що міститься в карбаміді амідний азот важче вимивається з ґрунту, ніж нітратна, в якій половина загальної кількості азоту міститься в аміачній селітрі. Тому азот карбаміду триваліше зберігається в ґрунті, що дозволяє ефективно використовувати дане мінеральне добриво в областях рясного зволоження і в районах поливального землеробства. 2 ВИБІР ТА ОБГРУНТУВАННЯ СПОСОБУ ВІРОБНИЦТВА У 1828р. німецький хімік Ф. Велер відкрив реакцію взаємодії сульфату амонію з ціанатів калію по реакції: (NH4)2S04 + 2K[O−C≡N] → 2NH4[O−C≡N] + K2S04 (2.1) NH4[O−C≡N] → O=C(NH2)2 (2.2) Це була перша органічна речовина, отримана синтетичним шляхом. Практичні реакції значення не мали, однак робота Ф.Велера поклала початок розвитку органічної хімії і дозволила зруйнувати існуючий в той час вітаїстичною уявлення про життєві процеси, пояснювали їх наявністю в живому організмі особливої «життєвої сили». Надалі для отримання синтетичного карбаміду було передбачено кілька способів. Більшість з них не знайшли практичного застосування в промисловості через серйозні труднощі їх реалізації. Один з цих способів - ціанамідний. Полягає у взаємодії ціанаміду кальцію з водою в присутності СО2 або них полягає в гідратірованіі ціанаміду кальцію в присутності двоокису вуглецю (або сірчаної кислоти) з утворенням ціанаміду: CaCN2 + Н20 + С02→ CN-NH2 + СаС03 (2.3) Після фільтрації розчин ціанаміду підкисляють сірчаної кислотою при температурі 50-70°С і абсолютному тиску 1 - 5ат. У результаті ціанамід гідролізується в карбамід: CN-NH2 + Н2С → CO(NH2)2 (2.4) Цей процес, що протікає в освинцьованої автоклаві в атмосфері інертного газу, супроводжується утворенням побічних продуктів, забруднюючих карбамід. Через дорожнечу і нерентабельність він не знайшов промислового застосування. З високим виходом (до 94%) карбаміду може бути отримана з реакції між аміаком і сероокисью вуглецю. Спочатку утворюється тиокарбамат амонію, який при 100°С розкладається, даючи карбамід і сірководень: 2NH3 + COS → (NH3)2COS (2.5) (NH3)2COS ↔ (NH2)2CО + H2S (2.6) Карбамід можна також синтезувати з фосгену й аміаку: СОСl2 + 2NH3 → CO(NH2)2 + 2НС1 (2.7) 2НС1 + 2NH3 → 2NH4C1 (2.8) За такого способу сечовина утворюється в суміші з хлористим амонієм Промислового застосування цей спосіб не отримав через труднощі поділу суміші. У 1868р. російський хімік А. І. Базаров запропонував спосіб отримання карбаміду аміаку і двоокису вуглецю: 2NH3 + С02 ↔ NH2−CO−ONH4 ↔ CO(NH2)2 + H20 (2.9) В даний час в усьому світі синтез карбаміду в промисловому масштабі проводять за цим способом, хоча реалізація його розпочалася лише у 20-х роках минулого століття. Основною причиною затримки було недостатнє значення складних фізико-хімічних основ процесу. Крім того в ході розробки, промислових систем виробництва карбаміду виникли значні труднощі при конструктірованіі апаратів, рішенням питань захисту їх від корозії. Як випливає з реакції, синтез карбаміду протікає в 2-е стадії: спочатку з виділенням великої кількості тепла утворюється карбомат амонію, який потім дігідріруется, перетворюючись на карбамід. Ці процеси, можливо проводити в однакових умовах, в одному і тому ж апараті. Аміак і вуглекислий газ за певних умов можуть бути перетворені практично без остачі і з великою швидкістю в карбомат амонію. Таким чином, реакційна суміш, що виходить з апарату, в якому протікає синтез, завжди буде містити карбамід, воду, аміак і карбомат амонію. Найбільш вигідні умови цього процесу визначається глибиною і ступенем перебігу обох наведених вище реакцій, а також фізичним станом реакційної маси. Прямий синтез карбаміду з аміаку і двоокису вуглецю складається з декількох стадій: взаємодії NH3 і CO2, дистиляції продуктів син-теза і переробки розчинів карбаміду в готовий продукт. Застосовувані способи виробництва карбаміду мало відрізняються умовами процесу синтезу і поділяються головним чином за методами використання газів дистиляції. При здійсненні процесу без повернення надлишкового аміаку і газів дистиляції, його переробляють в інші продукти: нітрат амонію, сульфат амонію, амонійні солі або на аміачну воду. У способах з рециркуляцією газу, не перетвореного на карбамід, його виділяють з газів дистиляції плаву і повертають у цикл. Дистиляцію плаву карбаміду виробляють в одну або дві ступені. Існує кілька способів регенерації газів дистиляції з метою їх рециркуляції: гаряче компримування; поглинання газів мінеральним маслом; виборча абсорбція аміаку і двоокису вуглецю (газовий рецикл); повернення в цикл NH3 і CO2 у вигляді водних розчинів амонійних солей (жідкосной рецикл). Запропоновано багато способів, заснованих на виборчій абсорбції одного з компонентів – аміаку або CO2. Наприклад, виборча абсорбція аміаку з газів дистиляції розчином нітрату карбаміду. Не поглинену двоокис вуглецю або викидають в атмосферу або повторно використовують у циклі. Іншим прикладом є виборча абсорбція з газів дистиляції двоокису вуглецю за допомогою моноетаноламіна. Розроблено і змішаний спосіб повернення газів в колону синтезу непрореагіровавшіх NH3 і CO2 75% повертають у цикл у вигляді водного розчину амонійних солей, а інші 25% - за допомогою виборчої абсорбції. При виборчої абсорбції CO2 водним розчином моноетаноламіна процес може бути здійснено з частковим або повним поверненням у цикл газів дистиляції. Поділ газів з повним поверненням їх в процес може бути також здійснено із застосуванням двох поглиначів - водного розчину моноетаноламіна для абсорбції СО2 і розчину моноамінофосфата для поглинання аміаку. З усіх способів повернення газів дистиляції у виробництво самим економічним і менш трудомістким процесом є схеми з рідинним рециклом, де NH3 і CO2 повертаються в колону синтезу у вигляді водного розчину вуглеамонiйних солей. Для даного курсового проекту я вибираю саме цей спосіб отримання карбаміду з NH3 і CO2. 3 ХАРАКТЕРИСТИКА СИРОВИНИ ТА ГОТОВОГО ПРОДУКТУ Амміак NH3 – безбарвний горючий газ з гострим запахом. При змінюємося для промислового синтезу сечовини рідкий аміак представляє собою безбарвну рідину, яка сильно заломлює світло. Молекулярна вага 17,03 В’язкість при 0°С, н∙сек/м2 NH3 (газ) 93∙10-11 NH3 (рідина) 4∙10-5 Критичні константи тиск,н/м2 атм 114,84 температура, °С 132,40 питомій обьєм,м3/кг 4,26 Плотність NH3 (газ, при 0°С і 1am), кг/л 770 NH3 (рідина.),кг/м3 681 Температура, °С кипіння -33,35 плавлення -77,70 Теплота утворення з простих речовин,кДж/моль (ккал/моль) NH3 (газ) 45,8 (10,94) NH3 (ридина) 66,3 (15,84) Питома теплоємність, Дж∙кг-1∙г рад-1 NH3 (газ) при 0°С 2-103 при 25°С 2,1-103 при 100 °С 2,2-103 NH3 (рідина при 15—30°С) 4,7.103 Аміак добре розчиняється у воді з утворенням аміачної води по реакції: NH3 + н20 = NH4OH Зміст аміаку у воді залежить від температури і тиску. В даний час аміак у величезних кількостях одержують у промисловому масштабі з азоту і водню. У виробництво карбаміду рідкий аміак надходить згідно ГОСТ 6221-82 Масова частка аміаку н/м 99,96% Вологи н/б 0,04% Олії н/б 2,0 мг/дм2 Температура -28 − -33°С Тиск 12 − 33 кгс/см2 Рідкий аміак зберігають на складі, в резервуарах, що знаходяться під тиском. Чим вище температура навколишнього середовища, тим більше тиск парів аміаку і, отже, тиск у резервуарі. Влітку при 40°С тиск у резервуарі досягає 15,85 ат, а взимку при мінус 15°С 2,4 ат. Для підтримки необхідного тиску аміаку резервуари постачають нагрівальними паровими трубами. На виробництво сечовини рідкий аміак надходить із заводського складу засуцільнотягнутої сталевої труби. Транспортування аміаку здійснюється шляхом видавлювання його з резервуару за рахунок наявного в ньому тиску. На деяких складах для перекачування рідкого аміаку застосовують спеціальні відцентрові насоси. Рідкий аміак перевозять у залізничних цистернах або балонах. Цистерни для рідкого аміаку повинні бути пофарбовані у жовтий колір і мати на бічній поверхні напис «Аміак» або «Отруйно, газ». Балони, призначені для транспортування рідкого аміаку, також необхідно фарбувати у жовтий колір і постачати нанесеною чорною фарбою написом: «Аміак». Робочий тиск в балоні повинен бути 30ат. Балони з аміаком слід захищати від прямого впливу сонячних променів і оберігати при транспортуванні від ударів і падіння. Двоокис вуглецю СО2 - безбарвний газ, що володіє кислуватим запахом і смаком. При 0°С і тиску 35,54 ат газ згущується в безбарвну рідину, а при сильному охолодженні застигає в снігоподібну масу білого кольору. При температурі -56,6°С і тиску 5,28 ат двоокис вуглецю знаходиться у всіх трьох станах: твердому, рідкому і газоподібному. Двоокис вуглецю добре розчиняється у воді. При нормальних умовах в 1 об'ємі води розчиняється 1,84 обсягу СО2. З підвищенням тиску розчинність двоокису вуглецю у воді пропорційно збільшується. Основні фізико-хімічні константи двоокису вуглецю наведені нижче: Молекулярна вага 44 В’язкість, н∙сек/м2 при 20°С 146∙10-11 при 50°С 16∙10-10 при 100°С 183∙10-11 Критичні константи тиск, н/м2 (атм) 75,1 (72,9) температура, °С 31 Плотність, кг/л СО2 (газ) 1,98∙10-3 CO2 (рідина) 0,92 CO2 (тв.) 1,3 — 1,6 Температура, °С кипіння -78,5 плавления -56,2 Газ приходящий у виробництво має відповідати ТУ: Об’ємная доля CO2 н\м 95,5% Н2 + СО н\б 0,01% СН4 н\б 0,04% О2 0,35 — 0,5% N2 н\м 3,5% Для виробництва карбаміду в більшості випадків використовується двоокис вуглецю, одержуваний в якості відходу при очищенні конвертованого газу, споживаного в синтезі аміаку. Зазвичай в умовах промислового виробництва очищення газу здійснюється водним або моноетаноламіновим способом. Зберігають отриманий двоокис вуглецю в газгольдерах. Транспортування двоокису вуглецю в цех з виробництв карбаміду здійснюється по трубопроводах з вуглецевої сталі. Карбамід HaNCONHa являє собою амід карбамінової кислоти (H2NCOOH), обо карбамід. Його можна також вважати повним амідом вугільної кислоти (НОСООН). Карбамід відіграє велику роль у процесі обміну речовин і є кінцевим продуктом перетворення білків у тваринному організмі. Зовнішній вигляд карбаміду – безбарвні і без запаху кристали, що мають форму довгих і тонких призм. Технічний карбамід звичайно пофарбований в білий колір і іноді в жовтуватий. Розчин карбаміду у воді має слабколужних властивостями. Чистий карбамід містить 46,6% азоту в амідній формі (у перерахунку на аміак 56,7%). Дані, що характеризують деякі фізико-хімічні властивості сечовини, представлені нижче: Молекулярна вага 60,06 Плотність (при 20°С),кг/м3 1335 Температура плавліния, °С при 1ат 132,7 при 300 ат 150 Теплота утворення з простих речовін, кдж/моль (ккал/моль) 334 (79,8) плавліния, кдж/моль (ккал/моль) 15 (3,6) розчиненняния у воді (при 19°С), кдж/кг (кал/г) 251,7 (60,1) Кут природного укосу, град гранульований продукт 37 кристалічний продукт 35 Питома теплоємність (при 20°С), кдж∙кг-1∙град-1 (кал∙кг-1∙град-1) 1,34 (0,32) Карбамід при нормальних умовах пожежо-і вибухобезпечний, не токсичний. Карбамід упаковують у клапанні паперові та полімерні мішки по нормативно-технічної документації. Навалом у залізничні вагони типу «хопер», мінераловози, а також до спеціалізованих металеві контейнери. Для роздрібної торгівлі продукт пакують у поліетиленові пакети, масою не більше 3 кг. Зберігають в закритих сухих складських приміщеннях. Контейнери з карбамідом і транспортні пакети допускається зберігати на відкритих майданчиках. Для зберігання споруджують складські приміщення закритого типу, ретельно захищені від атмосферних опадів. Такі приміщеннях повинні бути сухими і абсолютно чистими. Гранульовану сечовину зберігають на складі навалом і в мішках. При зберіганні сечовини навалом в крамниці на стані скребковий транспортер (кратцер- кран), за допомогою якого сечовину забирають з штабеля і зсипають у прийомний бункер накопичувач, звідки насипом проводитися завантаження у вагони. Транспортують в упакованому вигляді і насипом всіма видами критого транспорту, крім повітряного. Випускають карбамід двох марок: А - для використання в хімічній промисловості та тваринництві, і Б – для використання в сільському господарстві. У нижченаведеної таблиці коротко представлено технічні вимоги до карбаміду згідно ДЕСТ 2081–92. Таблиця 3.1 Вимоги до продукту згідно ГОСТ 2081–92
4 ФІЗИКО-ХІМІЧНІ ОСНОВИ ТЕХНОЛОГІЧНОГО ПРОЦЕСУ Синтез карбаміду з аміаку і двоокису вуглецю протікає у дві стадії. У першій стадії відбувається безпосереднє з'єднання реагентів з утворенням карбамата амонію: У другій стадії карбамат амонію відщеплює воду і перетворюється на карбамід: Обидві реакції оборотні, тому стан рівноваги їх і вихід сечовини залежить від умов синтезу - температури, тиску, співвідношення аміаку і двоокису вуглецю і ряду інших чинників. В даний час вплив різних чинників вивчені досить добре, завдяки чому досягаються високі техніко-економічні показники виробництва. Реакція утворення карбамата амонію (4.1) екзотермічна, тобто протікає з виділенням тепла. Внаслідок розбіжності результатів, отриманий різними дослідниками при визначенні теплоти створення карбамата амонію, можна прийняти її рівною 152 дж/моль при постійному обсязі і 158 дж/моль при постійному тиску. Реакція дегідратації карбамата амонію з утворенням карбаміду ендотермічна, тобто протікає з поглинанням тепла 32,3 дж/моль. Теплота утворення карбаміду з аміаку і двоокису вуглецю може бути обчислена на основі реакцій (4.1) і (4.2) і становіть 125,7 дж/моль. Таким чином, сумарно процес утворення карбаміду йде з виділенням тепла. Кількість його знаходиться в прямій залежності від чистоти вихідної сировини, ступеня перетворення карбамат амонію в карбамід, від надлишку аміаку, що подається в колону синтезу. При підвищенні температури ступінь дегідратації (конверсії) карбамата амонію в карбамід збільшується (рисунок 3.1). Проте таке збільшення триває лише до певного максимуму. Надалі зі зростанням температури при постійному тиску ступінь перетворення карбамата амонію починає знижуватися. Це пояснюється досить інтенсивним збільшенням тиску дисоціації карбамат амонію при підвищенні температури: температура 60,4 77,2 106,0 130,2 167,0 197,6 тиск 1,21 2,99 12,64 38,4 113,4 259,9 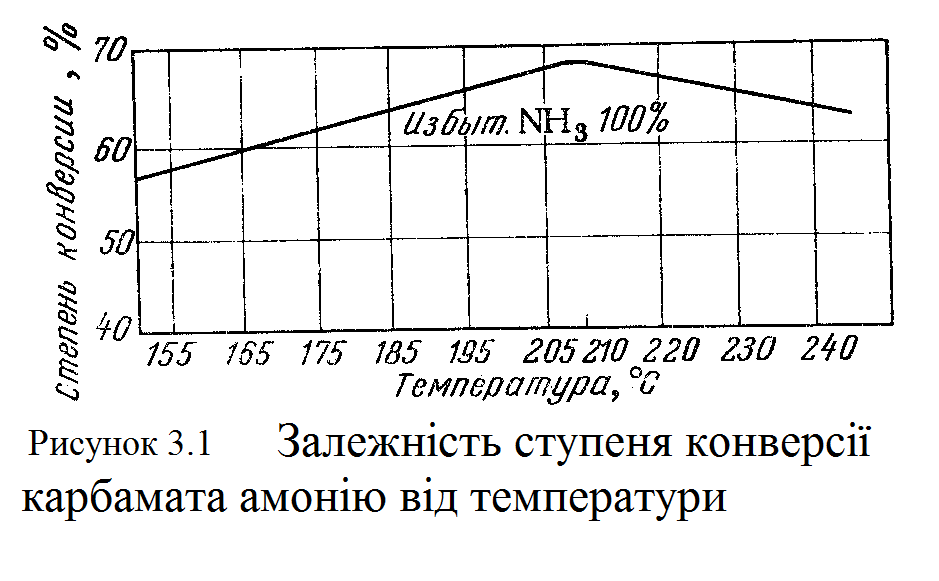 З підвищенням тиску при постійних обсязі і завантаженні ступінь конверсії карбамата амонію в карбамід значно зростає. Так, при тиску 154 aт ступінь конверсії становить лише 35%, при 175 aт вона зростає до 47%, при 210 aт –до 51% і, нарешті, при 280 aт – приблизно до 57%, після чого залишається приблизн на одному рівні (малюнок 3.2). 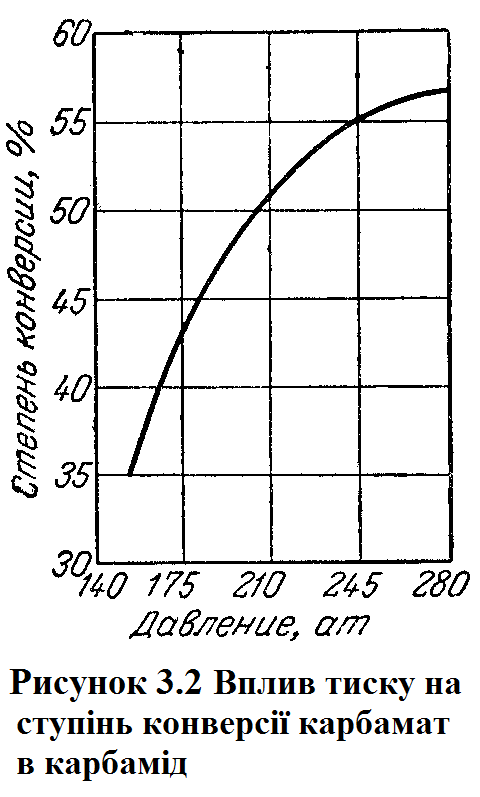 Швидкість утворення карбамата амонію (при всіх інших рівних умовах) зростає приблизно пропорційно квадрату тиску. Реакція, досить повільна при атмосферному тиску і звичайній температурі, при тиску близько 100 aт і температурі 150°С перебігає майже миттєво. Внаслідок наявності газової фази в реакційному просторі зменшується ступінь перетворення карбамата амонію в карбамід, вихід якої при збільшенні відносного об'єму газової фази прагне до нуля. З підвищенням тиску зменшується обсяг газової фази і, отже, ворзрастає ступінь дегідратації карбамата амонію. У промисловому масштабі надає – інтерес вести процес при можливо більш високому тиску (близько 200 aт) і температурі, сумісної з цим тиском. Реакція утворення сечовини з карбамата амонію може протікати зі значними виходами тільки в рідкій фазі. Тому вода, знижуючи температуру плавлення карбамата в початковий період, сприяє швидкому утворення рідкої фази. При досягненні рівноваги реакції вода вже негативно впливає на перебіг процесу. Було встановлено, що при введенні кожного відсотка води понад можливих 2-3% ступінь конверсії карбамат амонію в карбамід знижується на 1%. Шкідливий вплив води до деякої міри може бути компенсовано в присутності надлишку аміаку понад стехіометричного кількості. Впливу надлишку аміаку на вихід карбаміду присвячені численні роботи. Проведені дослідження показують, що при надлишку аміаку ступінь перетворення карбамата амонію в карбамід зростає; одночасно зменшуються утворення побічних продуктів і корозія апаратури. Вивчено також вплив надлишку двоокису вуглецю на вихід сечовини. Було встановлено, що при наявності в суміші надлишкового (понад стехіометричного) кількості СО2 ступінь дегідратації карбамата амонію практично не збільшується. На підставі фізико-хімічних досліджень процесу отримання карбаміду з аміаку і двоокису вуглецю встановлено наступні оптимальні умови синтезі температура 185 - 200°С, тиск 200 ат, надлишок аміаку 100% стехіометричного кількості. Вихід карбаміду при цьому становить 60-70%, тривалість процесу одна година. 5 ОХОРОНА ВОДНОГО ТА ПОВІТРЯНОГО БАСЕЙНІВ. ВІДХОДИ ВИРОБНИЦТВА ТА ЇХ УТИЛІЗАЦІЯ На установках карбаміду, як правило, джерела викидів в навколишнє середовище бувають постійні і періодичні. До числа постійних відносяться: 1) забруднена олією вода з домішкою СО2 (з вузла компресії СО2), з домішкою NH3 або також СО2 і CO(NH2)2 (після охолодження сальників аміачних та інших насосів); 2) конденсат сокової пари з вузла вакуум-концентрування розчинів карбаміду; 3) повітря системи гранулювання та охолодження гранул карбаміду; 4) інертні по відношенню до процесу синтезу карбаміду гази. До числа джерел періодичних викидів відносяться: 1) вода після промивці апаратури; 2) вода після змиву підлог; 3) скидання від запобіжних клапанів; 4) скиди пускового і аварійного періодів. З вище перерахованих джерел забруднення навколишнього середовищає: пилкарбаміду уносимий з повітрям охолодження гранул і конденсат сокового пара з вузла вакуум-концентрування розчину карбаміду. Для зменшення викидів забруднюючих середовищ передбачені такі удосконалення технологічної схеми як: 1) промивка повітря з грануляційної вежі розчином карбаміду; 2) термічна обробка стічних вод у вузлі гідролізу; 3) утилізація непрореаговуючого NH3 з отриманням солей амонію або товарної аміачної води. Повітря, що відводиться з грануляційної вежі, містить пил карбаміду з розміром частинок 200-400 мкм. Джерелом забруднення повітря служать не тільки розтріскуються при охолодженні гранули і дрібні гранули (супутників фракція, що утворюється в процесі гранулювання при диспергируютвані плаву), але і аерозоль, що виникає внаслідок сильного пересичення пари карбаміду, що потрапляють з поверхні крапель розплаву в повітряний потік. Вміст пилу карбаміду в повітрі на виході з башти складає 500 - 1000 мг/м3. Зрозуміло, чим вище швидкість повітря, тим вища концентрація пилу в повітрі. У баштах, де максимальний допустимий перепад тиску становить усього лише кілька десятків Па, для очищення повітря часто використовують відбійні пристрої з перегородкою і системою водяної завіси. Відпрацьоване повітря спочатку вдаряється об відбійну перегородку, змінює свій напрямок вниз, до поверхні водозбірника, і, перш ніж потрапити в атмосферу, проходить через водяну завісу. Метод простий і ефективний для порівняно великих частинок, які легко відокремлюються в результаті гравітаційного осадження і для яких досить досить незначного перепаду тиску. Однак для дрібного пилу ефективність цього процесу низька. У викидається повітрі все ще залишається 200 - 500 мг/м3 пилу карбаміду. Основна частина стічних вод виробництва карбаміду утворюється у вузлі конденсації сокових парів, що виділяються при зневодненні розчину карбаміду. Відповідно до стехіометричним рівнянням синтезу, кількість води, яку слід вивести з процесу, теоретично не може бути менше 0,3 т/т карбаміду. У зв'язку з застосуванням парових ежекторів для створення вакууму в системах зневоднення ця кількість сягає м3/т. Гранично допустима концентрація (ГДК) карбаміду у воді водойм складає 0,01 кг/м3; для аміаку і амонійних солей ГДК (у перерахунку на азот) 0,002 кг/м3. При скидання стічних вод у системи біологічної очистки допустимий вміст амонійного азоту майже не збільшується, хоча, за деякими даними, біологічне очищення може успішно функціонувати при утриманні NH3 у стоках до 0,05 і навіть 0,1 кг/м3; вміст карбаміду може бути доведене до 0,1-0,3 кг/м3. Очевидно, що навіть розбавлення стоків виробництва карбаміду в загальнозаводських колекторі далеко не завжди дозволяє задовольнити вимоги охорони навколишнього середовища. Тому інтенсивно розроблялися методи очищення стічних вод від аміаку і карбаміду. Широко поширена у промисловості система очищення стічних вод включає гідроліз карбаміду і двоступеневу абсорбцію-десорбцію. Велику роль при остаточному очищенню стічних вод грає біологічні методи. Промисловий синтез карбаміду характеризується порівняно великим споживанням охолоджуючої води. Питома (у розрахунку на 1 т продукту) витрата свіжої води з джерела водопостачання підприємства для поповнення водо обігового системи складає 1-3 м3/т. У той же час при отриманні карбаміду в промислову каналізацію зливають близько 1 м3/т стічних вод з домішкою цільового продукту і аміаку. Очевидно, при раціональному використанні стічних вод споживання свіжої води можна скоротити. Найбільш простий метод повної ліквідації стічних вод - створення в цеху карбаміду внутрішнього водообігового циклу, що включає градирню. Воду цього циклу доцільно використовувати в якості охолоджуючого агента в теплообмінниках агрегату синтезу карбаміду. При цьому покриваються витрати теплоти на випаровування води в градирні та майже на 50% скорочується витрата охолоджуючої води із зовнішнього оборотного циклу. В даному курсовому проекті цеху виробництва карбаміду відходів і викидів в атмосферу нема. 6 ОПИС ТЕХНОЛОГІЧНОЇ СХЕМИ ВИРОБНИЦТВА З ЕЛЕМЕНТАМИ НОВОЇ ТЕХНІКИ, ТЕХНОЛОГІЇ ТА АПАРАТУРНОГО ОФОРМЛЕННЯ Газоподібний діоксид вуглецю, попередньо осушений і очищений від механічних домішок, від сірководню та органічних сірковмісних сполук, стискається в 4-х ступінчастому компресорі до 20 МПа і за 95-100°С направляється в змішувач 6. Сюди ж під тиском 20 МПа плунжерним насосом 3 подається рідкий аміак, а плунжерним нассосом 7 - розчин вуглеамонійних солей у вигляді якого повертаються в цикл NH3 і CO2. У результаті перемішування компонентів в змішувачі при 175°С починається утворення карбамат амонію. Потім реакційна суміш надходить у колону синтезу 5, в якій при 185°С і 20 МПа завершується освіту карбамат амонію та його розкладання до карбаміду. Колона синтезу карбаміду є порожній циліндричний апарат зі сферичним днищем, виготовлений з вуглецевої сталі; сопрекасающіеся з плавом внутрішні поверхні захищені листовими хромонікельмолібденовой сталлю Х17Н16М3Т або титаном. Багатошаровий корпус високого тиску виготовляється з листової вуглецевої сталі. Використання титану в якості каорозійонно-стійкого матеріалу дозволяє підвищити температуру синтезу до 200С. Для контролю за станом футіровкі в корпусі колони є отвори, з'єднані із загальним колектором. Реакційна маса надходить у колону через нижній штуцер і поступово рухається до вихідного штуцера в плоскій кришці. Отриманий в колоні синтезу плав карбаміду, що містить 30-31% карбаміду, 21-22% карбамат амонію, 33-34% надлишкового аміаку і 16-17% води, направляється на двоступеневу дистиляцію. Агрегат дистиляції кожному ступені складається з трьох апаратів: ректифікаційної колони, підігрівача і сепаратора. Плав карбаміду, що виходить з колони 5, дроселюється від 20 до 1,8 - 2,0 МПа і надходить у верхню частину ректифікаційної колони 9 агрегату дистиляції першого ступеня. Тут при 120 - 125°С відбувається виділення в газову фазу надлишкового аміаку. Потім плав для розкладання карбамат амонію нагрівається до 158 - 162°С в теплообміннику 10, і утворилася парорідинная суміш поділяється в сепараторі 11, а газова фаза повертається в нижню частину ректифікаційної колони 9, а рідка фаза дроселюється до тиску 0,25 - 0,4 МПа і спрямовується на дистиляцію другого ступеня. Газова фаза з ректифікаційної колони 9, містить 75 - 76% NH3, 21 - 22% CO2 і близько 3% води, направляється в нижню частину промивної колони 8, де за допомогою парового підігрівача підтримують температуру 92 – 96°С; сюди ж подається розчин вуглеамонійних солей з другої сходинки дистиляції. Тут поглинається основна кількість СО2 і конденсується водяна пара з утворенням розчину, що містить 38 - 45% NH3, 30 - 37% СО2 і 22 - 27% води, цей розчин стискається плунжерним насосом 7 до 20 МПа і повертається в змішувач 6. Газоподібний аміак при 45 - 50°С остаточно відділяється від СО2 у верхній насадок частини колони 8, зрошуваний концентрованим водним аміаком і прямує в конденсатор 4, де він стискається і через танк 2 повертається в цикл. Не сконденсировавшиеся гази відмиваються від залишку аміаку в системі абсорбції, дроселюється до атмосферного тиску і скидаються в атмосферу. Розчин, що надходить на дистиляцію другого ступеня, містить 55 - 61% карбаміду, 4 - 5% карбамат амонію, 6 - 7% надлишкового аміаку і 28 - 35% води. Дистиляція в другому ступені протікає так само як і в першій, тобто спочатку розчин проходить через ректифікаційної колона 12, охолоджувач до 110°С за рахунок випаровування аміаку і розкладання карбамат амонію, потім у підігрівач 13 нагрівається до 140 - 142°С і надходить у сепаратор 14, де відбувається розкладання газоподібної і рідкої фаз. У другому рівні дистиляції завершується розкладання карбамат амонію та отгонка аміаку і двоокису вуглецю. Що залишається розчин, який містить 70 - 72% карбаміду, з сепаратора 14 дроселюється і надходить у вакуум-випарник 15, в якому при залишковому при залишковому тиску 40 кПа відбувається його концентрування до 74 - 76% і охолодження до 90С за рахунок самовіпарювання. Далі цей розчин через збірник 16 і масловіддільник 17 направляється на переробку в готовий продукт. Газова фаза з ректифікаційної колони 12, що містить 55 - 56% аміаку, 24 - 25% двоокису вуглецю і 20 - 21% води, прямує в конденсатор 21. Утворився тут при 40°С слабкий розчин вуглеамонійних солей через резервуар 22 насосом 23 подається в промивну колону 8. Газова фаза з конденсатора 21 і інші гази, що відходять, містять NH3 та СО2, направляються в абсорбер 24, в якому вони поглинаються розчином вуглеамонійних солей, циркулюючим через холодильник 27. Інертні гази з абсорбера викидаються в атмосферу. Утворився в абсорбері 24 розчин вуглеамонійних солей підігрівається в теплообміннику 28 до 90 - 95°С і подається в десорбер 26; тут при 0,3 - 0,4 МПа і 135 - 145°С за допомогою гострої пари відбувається повне його розкладання на NH3, CO2 і H2O. Газоподібні аміак і двоокис вуглецю разом з водяними парами направляються в конденсатор другого ступеня 21, а вода що залашилася віддаляється в каналізацію. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
