Ответы по аналитике. Основные положения качественного анализа
 Скачать 0.71 Mb. Скачать 0.71 Mb.
|
Титрование с адсорбционными индикаторамиАдсорбционные индикаторы – индикаторы полученные методом пенного титрования: аргентометрии (метод Фаянса-Ходакова), меркурометрии. Индикаторы на основе адсорбентов меняют окраску из-за их адсорбции на поверхности осадка после точки эквивалентности вследствие изменения знака ее заряда. Напримре, в процессе титрования раствора NaCl стандартным раствором AgNO3 образуются мицеллы AgCl. К точке эквивалентности мицеллы заряжены отрицательно. из-за того, что их ядро (1) адсорбирует Cl- -ионы (2), которые находятся в избытке, при этом слой противоионов (3) состоит из катионов натрия. После достижения точки эквивалентности в избытке находятся катионы Ag + и знак заряда мицеллы меняется на положительный: 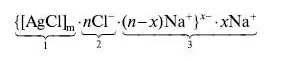 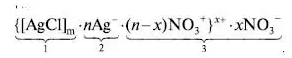 Адсорбционные индикаторы - слабые органические кислоты, окрашенные анионы которых замещают NO3 - ионы в слое 3, адсорбируются поверхностью, что приводит к резкому изменению окраски. Адсорбционные индикаторы при аргентометрии (флуоресцеин, эозин, дихлорфлуоресцеин и др.) используются при определении хлоридов, бромидов, йодидов, тиоцианатов в нейтральных (флуоресцеин) и кислых (эозин, дихлорфлуоресцеин) растворах. Адсорбционные индикаторы в меркурометрии (дифенилкарбазидом) используются при определении хлоридов, бромидов (рН <7). Индикаторы на основе адсорбентов используют для определения галогенидов щелочных металлов, галогенгидрогенних солей алкалоидов, витаминов (В1) в различных лекарственных препаратов.
Реакции катионов серебра Ag+
KI+AgNO3→AgI↓+KNO3 Образуется желтый осадок йодида серебра, нерастворимый в гидроксиде аммония, кислотах, но ратворимый в тиосульфате натрия с образованием комплексного соединения Na[AgS2O3]: AgI+Na2S2O3→Na[AgS2O3]+NaI
2AgNO3+K2CrO4→Ag2CrO4↓+2KNO3 Образуется красно-кирпичный осадок хромата серебра, растворимый в азотной кислоте и гидроксиде аммония.
2AgNO3+ Na2S2O3→ Ag2S2O3↓+2NaNO3 Образуется осадок белого цвета, растворимый в избытке реактива.
Ag2O+HCOH→2Ag↓+HCOOH При проведении реакции с формальдегидом в пробирке на ее стенках образуется блестящий налет – реакция «серебряного зеркала» Реакции катионов ртути Hg22+
Hg2Cl2+SnCl2→2Hg↓+SnCl4 Образуется осадок черного цвета Hg2(NO3)2+Cu→2Hg↓+Cu(NO3)2 Если раствор соли ртути нанести на медную монету, то раствор через 2-3 мин. Монета покроется серым слоем амальгамы меди, который после растирания кусочком шерсти становится блестящим.
Hg2(NO3)2+2NaOH→Hg2O↓+H2O+2NaNO3 Образуется черный осадок оксида ртути (1)
Hg2(NO3)2+2KI→Hg2I2↓+2KNO3 Образуется грязно-зеленый осадок йодида ртути (1), растворимый в избытке реактива с образованием тетрайодо (2) меркурата калия и черного осадка металлической ртути: Hg2I2+2KI→K2[HgI4]+Hg↓
Hg2(NO3)2+ K2CrO4→Hg2CrO4↓+2KNO3 Образуется кирпично-красный осадок хромата ртути(1), растворимый в азотной кислоте. Реакции катионов свинца Pb2+
Pb(NO3)2+2KI→PbI2↓+2KNO3 Образуется осадок дийодида свинца желтого цвета, растворимый в избытке реактива с образованием тетрайодо (2) плюмбата калия: PbI2+2KI→K2[PbI4] Осадок дийодида свинца растворим в горячей воде и уксусной кислоте.
Pb(NO3)2+ K2CrO4→PbCrO4↓+2KNO3 Образуется желтый осадок хромата свинца, растворимый в азотной кислоте и щелочах.
Pb(NO3)2+NaOH→Pb(OH)2↓+NaNO3 Образуется белый осадок гидроксида свинца (2), растворимый в избытке реактива с образованием плюмбатов: Pb(OH)2+NaOH→Na2PbO2+2H2O
CO – CO – CO – Na CO – CO – CO Pb(NO3)2+ │ ║ → │ ║ Pb ↓+ 2NaNO3 CO – CO – CO – Na CO – CO – CO В нейтральной среде образуется фиолетовый осадок родизонатом свинца. В кислой среде рН=3 осадок приобретает красный цвет. Проведению реакции мешают другие катионы 2-ой группы, поэтому ее следует предварительно отделив катион свинца от остальных с помощью хорошей растворимости хлорида свинца (2) в горячей воде.
NH – HN – C6H5 C6H5 – NH – N – Pb – N – NH – C6H5 Pb(NO3)2+ 2S=C → C=S S=C +2HNO3 N=N – C6H5 C6H5 – N=N N=N – C6H5 Хлороформный слой окрашивается в красный цвет вследствие образования и экстракции из воды в хлороформ дитизона свинца. Проведению реакции мешают другие катионы, поэтому целесообразно отделить катионы свинца от остальных, используя хорошую растворимость в горячей воде хлорида свинца.
Реакции катионов мышьяка As3+ As5+
Na3AsO3+I2+H2O→ Na3AsO4+ 2HI В слабощелочной среде арсенит натрия окисляется свободным йодом до арсената натрия. Другой стороны йодид-ион в кислой среде окисляется арсенат-ионами до свободного йода.Происходит обесцвечивание раствора вследствие перехода элементарного йода в йодид-ион. С H3AsO4+2KI+2HCl→ H3AsO2+ I2+H2O+2KCl Образование свободного йода легко установить по окрашиванию раствора в присутствии крахмала в синий цвет.
В момент выделения водород восстанавливает ионы мышьяка в асин (мышьяковистый водород): As3++3H+→AsH3↑ Арсин летуч и легко определяется по почернению фильтровальной бумаги, смоченной раствором нитрата серебра: AsH3+6AgNO3+3H2O→ H3AsO3+6Ag+HNO3 Водород при проведении опыта получают с помощью взаимодействия кислот с цинком или щелочей с алюминием: 2HCl+Zn→ZnCl2+2H Al+NaOH+H2O→NaAlO2+3H
План лекции: 1. Общая характеристика физико-химических методов 2. Общие сведения о спектроскопических методах анализа. 3. Фотометрический метод анализа: фотоколориметрия, колориметрия, спектрофотометрия. 4. Общие сведения о нефелометрическом, люминесцентном, поляриметрическом методах анализа. 5. Рефрактометрический метод анализа. 6. Общие сведения о масс-спектральном, радиометрическом анализах. 7. Электрохимические методы анализа (потенциометрия, кондуктометрия, кулонометрия, амперометрия, полярография). 8. Хроматографический метод анализа. Сущность физико-химических методов анализа. Их классификация. Физико-химические методы анализа, как и химичес кие методы, основаны на проведении той или иной хими ческой реакции. В физических методах химические реак ции отсутствуют или имеют второстепенное значение, хо тя в спектральном анализе интенсивность линий всегда существенно зависит от химических реакций в угольном электроде или в газовом пламени. Поэтому иногда физи ческие методы включают в группу физико-химических методов, так как достаточно строгого однозначного разли чия между физическими и физико-химическими метода ми нет, и выделение физических методов в отдельную группу не имеет принципиального значения. Химические методы анализа были не в состоянии удов летворить многообразные запросы практики, возросшие в результате научно-технического прогресса, развития полу проводниковой промышленности, электроники и ЭВМ, ши рокого применения чистых и сверхчистых веществ в техни ке. Применение физико-химических методов анализа на шло свое отражение в технохимическом контроле пищевых производств, в научно-исследовательских и производственных лабораториях. Эти методы характеризуются высокой чувствительностью и быстрым выполнением анализа. Они основаны на использовании физико-химических свойств веществ. При выполнении анализов физико-химическими методами точку эквивалентности (конец реакции) определяют не визуально, а при помощи приборов, которые фиксируют изменение физических свойств исследуемого вещества в точке эквивалентности. Для этой цели обычно применяют приборы с относительно сложными оптическими или электрическими схемами, поэтому эти методы получили название методов инструментального анализа. Во многих случаях для выполнения анализа этими методами не требуется химическая реакция в отличие от химических методов анализа. Надо только измерить показатели каких-либо физических свойств анализируемого вещества: электропроводность, светопоглощение, светопреломление и др. Физико-химические методы позволяют вести в промышленности непрерывный контроль сырья, полуфабрикатов и готовых изделий. Физико-химические методы анализа стали применять позднее, чем химические методы анализа, когда была установлена и изучена связь между физическими свойствами веществ и их составом. Точность физико-химических методов сильно колеблет ся в зависимости от метода. Наиболее высокой точностью (до 0,001%) обладает кулонометрия, основанная на изме рении количества электричества, которое затрачивается на электрохимическое окисление или восстановление опреде ляемых ионов или элементов. Большинство физико-хими ческих методов имеют погрешность в пределах 2-5 %, что превышает погрешность химических методов анализа. Од нако такое сравнение погрешностей не вполне корректно, так как оно относится к разным концентрационным облас тям. При небольшом содержании определяемого компонен та (около 10-3 % и менее) классические химические методы анализа вообще непригодны; при больших концентрациях физико-химические методы успешно соперничают с хими ческими. К числу существенных недостатков большинства физико-химических методов относится обязательное нали чие эталонов и стандартных растворов.
Катионы 5-ой аналитической группы Mn2+, Mg2+ Fe2+Fe3+ Bi3+ Sb3+ Sb5+ Общая характеристика катионов пятой аналитической группы Катионы 5-ой группы в отличие от катионов других групп при взаимодействии со щелочами образуют осадки гидроксидов, которые нерастворимы в избытке щелочей и растворе аммиака, но растворяются в кислотах. Нитраты, хлориды, сульфаты железа марганца и магния хорошо растворимы в воде. Соли сурьмы и висмута при растворении легко подвергаются гидролизу, образуя основные соли. Карбонаты, фосфаты и гидрофосфаты катионов 5-ой группы в воде нерастворимы. Сероводород осаждает из нейтральных растворов осадки сульфидов всех катионов 5-ой группы, которые растворяются в соляной кислоте, за исключением сульфида висмута и сурьмы. Применение в медицине и фармации солей катионов 5-ой аналитической группы Препараты элементарного,2 и 3-х валентного железа принимают внутрь для лечения анемий. Наиболее часто применяют восстановленное железо, сульфат железа (2), глицерофосфат железа (3), лактат железа (2), аскорбинат железа (2). Препараты железа назначают в виде порошков, таблеток, пилюль. Железо в виде ионов 2+ входит в состав гемоглобина крови и ряда ферментов. При анемиях наблюдается снижение количества гемоглобина. Препараты железа в этом случае стимулируют деятельность кроветворных органов и восполняют недостаток железа 2+. Ряд солей железа применяют при анализе лекарств. Из солей марганца в медицине получил перманганат калия, раствор которого используют как антисептик и обеззараживающее средство для промывания ран, полосканий, смазываний, примочек, при язвах, ожогах, различных кожных заболеваниях. Внутрь применяется в растворах при отравлениях для промывания желудка. С помощью перманганата калия проводится анализ многих лекарственных средств. Оксид и пероксид магния употребляются как желудочные средства. В состав присыпок входят карбонат гидроксомагния. Как слабительное и спазмолитическое средство используется сульфат магния. Нитрат дигидроксо висмута обладает вяжущими антисептическими свойствами и назначается в порошках при заболеваниях жкт , в присыпках и мазях при воспалительных заболеваниях кожи. Из соединений сурьмы в медицине применяют органические соединения сурьмы при кожных заболеваниях. Действие группового реактива Групповым реактивом являются растворы щелочей, которые осаждают гидроксиды катионов: FeCl2+2NaOH→ Fe(OH)2↓+2NaCl FeCl3+3NaOH→ Fe(OH)3↓+3NaCl MnCl2+2NaOH→ Mn(OH)2↓+2NaCl MgCl2+2NaOH→ Mg(OH)2↓+2NaCl BiCl3+3NaOH→ Bi(OH)3↓+3NaCl SbCl3+2NaOH→ Sb(OH)3↓+3NaCl H[SbCl6]+ 6NaOH→ SbO(OH)3↓+6NaCl+2H2O Осадки гидроксида железа (2), марганца (2) на воздухе быстро буреют вследствие окисления кислородом воздуха: Fe(OH)2+O2+2H2O→ 4Fe(OH)3↓ Mn(OH)2+ O2+2H2O→ 2Mn(OH)4↓ Fe(OH)2+O2+2H2O→ 4Fe(OH)3↓ Mn(OH)2+ O2+2H2O→ 2Mn(OH)4↓ Осадок гидроксида висмута при нагревании желтеет вследствие образования гидроксида оксовисмута Bi(OH)3→BiOOH↓+H2O Гидроксид сурьмы в растворе превращается в тригидроксид оксосурьмы(5) Sb(OH)5→ SbO(OH)3↓+H2O Растворимость осадков гидроксидов различается для разных катионов 5-ой группы. В воде и щелочах осадки гидроксидов нерастворимы, за исключением свежеосажденного гидроксида сурьмы (3), который растворяется с образованием комплексного соединения тетрагидроксо(3) стибата калия: Sb(OH)3+KOH→K[Sb(OH)4] Гидроксид железа (2) несколько растворим в солях аммония, поэтому гидроксидом аммония осаждается не полностью. Гидроксид магния растворим в солях аммония вследствие того, соли аммония при гидролизе образуют сильную кислоту: NH4Cl+HOH→NH4OH+HCl Среда раствора становится кислой и гидроксид магния растворяется, т.к. для начала его осаждения необходимо значение рН>10,4. Кроме того, ион аммония связывает ОН- в малодиссоциированное соединение – гидроксид аммония, вследствие чего нарушается равновесное состояние и осадок растворяется. Все гидроксиды катионов 5-ой группы растворимы в сильных кислотах, образуя соли: Fe(OH)3+3HCl→ FeCl3+3H2O Реакции катионов железа Fe2+
3FeCl2+2K3[Fe(CN)6]→ Fe3[Fe(CN)6]2↓+ 6KCl Образуется синий осадок турибуллиевой сини. Осадок нерастворим в кислотах. Реакция специфична.
Диметилглиоксим в аммиачной среде образует с железом (2) карминово-красный комплекс – диметилглиоксимат железа. |
