Ответы по аналитике. Основные положения качественного анализа
 Скачать 0.71 Mb. Скачать 0.71 Mb.
|
Способы выражения концентрации растворов.1. Массовая доля (или процентная концентрация вещества) – это отношение массы растворенного вещества m к общей массе раствора. Для бинарного раствора, состоящего из растворённого вещества и растворителя: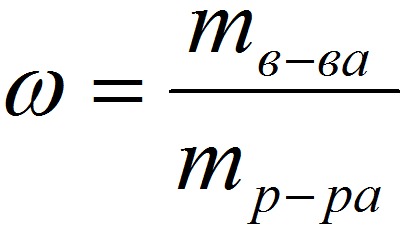 где: ω – массовая доля растворенного вещества; mв-ва – масса растворённого вещества; mр-ра – масса растворителя. Массовую долю выражают в долях от единицы или в процентах. 2. Молярная концентрация или молярность – это количество молей растворённого вещества в одном литре раствора V: 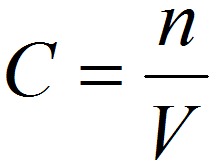 , ,где: C – молярная концентрация растворённого вещества, моль/л (возможно также обозначение М, например, 0,2 М HCl); n – количество растворенного вещества, моль; V – объём раствора, л. Раствор называют молярным или одномолярным, если в 1 литре раствора растворено 1 моль вещества, децимолярным – растворено 0,1 моля вещества, сантимолярным – растворено 0,01 моля вещества, миллимолярным – растворено 0,001 моля вещества. 3. Моляльная концентрация (моляльность) раствора С(x) показывает количество молей n растворенного вещества в 1 кг растворителя m: 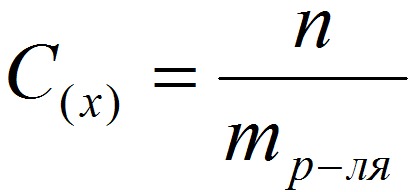 , ,где: С (x) – моляльность, моль/кг; n – количество растворенного вещества, моль; mр-ля – масса растворителя, кг. 4. Титр – содержание вещества в граммах в 1 мл раствора: 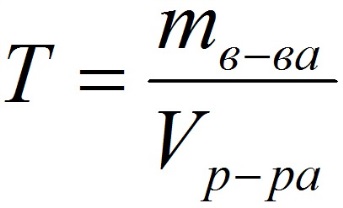 , ,где: T – титр растворённого вещества, г/мл; mв-ва – масса растворенного вещества, г; Vр-ра – объём раствора, мл. 5. Мольная доля растворённого вещества – безразмерная величина, равная отношению количества растворенного вещества n к общему количеству веществ в растворе: 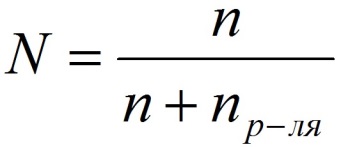 , ,где: N – мольная доля растворённого вещества; n – количество растворённого вещества, моль; nр-ля – количество вещества растворителя, моль. Сумма мольных долей должна равняться 1: N(X) + N(S) = 1. где N(X) - мольная доля растворенного вещества Х; N(S) - мольная доля растворенного вещества S. Иногда при решении задач необходимо переходить от одних единиц выражения к другим: 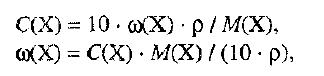 ω(X) - массовая доля растворенного вещества, в %; М(Х) – молярная масса растворенного вещества; ρ= m/(1000V) – плотность раствора.6. Нормальная концентрация растворов (нормальность или молярная концентрация эквивалента) – число грамм-эквивалентов данного вещества в одном литре раствора. Грамм-эквивалент вещества – количество граммов вещества, численно равное его эквиваленту. Эквивалент – это условная единица, равноценная одному иону водорода в кислотоно-основных реакциях или одному электрону в окислительно – восстановительных реакциях.Для записи концентрации таких растворов используют сокращения н или N. Например, раствор, содержащий 0,1 моль-экв/л, называют децинормальным и записывают как 0,1 н. 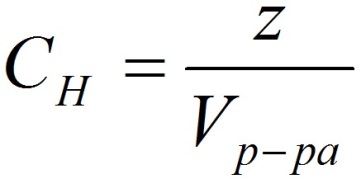 , ,где: СН – нормальная концентрация, моль-экв/л; z – число эквивалентности; Vр-ра – объём раствора, л. Растворимость вещества S - максимальная масса вещества, которая может раствориться в 100 г растворителя: 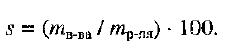 Коэффициент растворимости – отношение массы вещества, образующего насыщенный раствор при конкретной температуре, к массе растворителя: 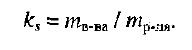 Раство́р — гомогенная (однородная) система (точнее, фаза), состоящая из двух или более компонентов и продуктов их взаимодействия. Гомогенность можно понимать в том смысле, что каждый из компонентов распределен в массе другого в виде своих частиц, то есть атомов, молекул или ионов. Растворитель — компонент, агрегатное состояние которого не изменяется при образовании раствора. В случае же растворов, образующихся при смешении газа с газом, жидкости с жидкостью, твёрдого вещества с твёрдым, растворителем условно считается компонент, количество которого в растворе преобладает[1]. Образование того или иного типа раствора обусловливается интенсивностью межмолекулярного, межатомного, межионного или другого вида взаимодействия, то есть теми же силами, которые определяют возникновение того или иного агрегатного состояния. Отличия: образование раствора зависит от характера и интенсивности взаимодействия частиц разных веществ. По сравнению с индивидуальными веществами по структуре растворы сложнее. Химическое взаимодействие растворенного вещества с водой приводит к образованию соединений, которые называются гидратами. Их формулы выражают с помощью формул растворенного вещества и воды, соединённых знаком «.» В зависимости от цели для описания концентрации растворов используются разные физические величины.
В основе ряда методов титриметрического анализа, которые объединяются под общим назва нием оксидиметрия, лежат окислительно-восстановительные реакции (ОВ), т.е. реакции, протекающие с изменением степени окисления атомов химических элементов, входящих в состав реагирующих веществ. В качестве рабочих растворов (титрантов) в оксидиметрии применяют растворы окислите лей и восстановителей. Методы оксидиметрии позволяют с помощью рабочих растворов окислителей количественно определять в рас творах или смесях разнообразные восстановители: соеди нения железа (II), олова (II), сульфиты, сульфиды, арсениты, оксалаты, пероксид водорода и др. С помощью рабо чих растворов восстановителей можно определить различные окислители: дихроматы, хлор, гипохлориты, хлориты, бром, броматы, йод, йодаты, пероксид водорода и др. К реакциям, используемым в оксидиметрии, предъяв ляются требования, заключающиеся в том, что реакция при титровании должна протекать быст ро и необратимо с образованием продуктов строго опреде ленного состава, не должна сопровождаться побочными взаимодействиями и должен существовать способ фикси рования конца реакции. Этим требованиям удовлетворяет лишь незначительная часть из огромного числа ОВ-реакций. Для оксидиметрического титрования подбирают ОВ пары так, чтобы разность их стандартных ОВ-потенциалов была не ниже 0,4 - 0,5 В. В противном случае при ти тровании отсутствует резкий скачок потенциала вблизи эквивалентной точки. В оксидиметрии применяются различные методы опре деления точки эквивалентности. Например, в перманганатометрии она фиксируется по изменению окраски тит руемого раствора, вызываемому избытком окрашенного рабочего раствора КМn04 (так называемое безындикатор ное титрование). В йодометрии точку эквивалентности ус танавливают с помощью индикатора крахмала, специфи чески реагирующего с йодом. В оксидиметрии применяют и специальные редокс-индикаторы (например, дифенила мин), которые изменяют свою окраску в зависимости от значения окислительного потенциала, подобно тому как кислотно-основные индикаторы изменяют свою окраску в зависимости от рН раствора. Большим недостатком окислительно-восстановитель ных реакций является их небольшая скорость, что затруд няет процесс титрования. Для ускорения медленно иду щих реакций применяют нагревание. Если нагревание применять нельзя (улетучивание од ного из веществ, разложение и т.д.), для ускорения реак ции увеличивают концентрации реагирующих веществ. На скорость реакции может оказывать влияние введе ние в раствор катализатора. При титровании применяют положительные катализаторы, ускоряющие реакцию, и от рицательные катализаторы — ингибиторы, замедляющие реакцию. Как уж было сказано, методы оксидиметрии основаны на окислительно-восстановительных реакциях, в ходе которых атомы химических элементов меняют свою степень окисления. Степень окисления - это услов ный электрический заряд атома элемента в химическом соединении при условии, что все образуемые этим атомом связи являются чисто ионными. Степень окисления имеет только математический смысл и используется для нахож дения стехиометрических коэффициентов реакций, клас сификации веществ и химической номенклатуры. Например, реакция Cu+2S04 + Fe° = Cu° + Fe+2S04 являет ся окислительно-восстановительной, потому что в процессе этой реакции атомы меди и железа изменяют свои степени окисления. Степень окисления атома железа повышается от О до + 2, степень окисления меди понижается от +2 до 0. Согласно электронной теории ОВ-процессов, окисление — это процесс отдачи электронов атомом, молекулой или ионом; восстановление — это процесс присоединения электронов атомом, молекулой, ионом. При окислении степень окисления элемента повышается, при восстанов лении — понижается. Окисление всегда сопровождается восстановлением, а восстановление - окислением. Поэтому окислительно-восстановительные реакции представляют собой единство двух противоположных процессов - окисления и восстановления. Вещества, атомы, молекулы или ионы которого отдают электроны, называются восстановителями. Восстанови тели имеют в своем составе элементы в низшей степени окисления и в процессе реакции окисляются. К ним отно сятся металлы, хлороводород, йодоводород, тиосульфат натрия и др. Вещества, атомы, молекулы или ионы которых присо единяют электроны, называются окислителями. Окисли тели имеют в своем составе элементы в высшей степени окисления и в процессе реакции восстанавливаются. К ним относятся азотная кислота, серная кислота, перманганат калия КМп04, оксид марганца (IV) Мn02, дихро мат калия К2Сг207, йодат натрия NaI03, бромат натрия NaBr03 и др. Число электронов, отданных восстановителем, должно равняться числу электронов, принятых окислителем. Сила окислителей и восстановителей зависит от их спо собности принимать или отдавать электроны: окислитель тем сильнее, чем больше у него выражена способность принимать электроны, и наоборот, более сильный восстановитель способен легче отдавать электроны. ОВ-реакции всегда идут в сторону образования более слабых окислите лей и более слабых восстановителей из исходных более сильных восстановителей и более сильных окислителей со ответственно. Если в растворе содержатся несколько вос становителей, например ионы Сl-, Вг-, I-, то добавляемый окислитель КМn04 будет реагировать с самым сильным восстановителем, т.е. с йодид-ионами I-, окисляя их до свободного йода I2. То же самое можно сказать о несколь ких окислителях и одном восстановителе. Восстановитель будет вначале реагировать с самым сильным окислителем. Окислительно-восстановительный потенциал Количественной характеристикой окислительной и вос становительной способностей различных веществ являются значения стандартных ОВ-потенциалов. При погружении электрода в раствор окислителя или восстановителя он отдает или принимает электроны. Электрод будет заряжаться положительно или отрица тельно до определенного потенциала, уравновешивающе го стремление электронов к перераспределению, причем положительный заряд электрода становится тем выше, чем сильнее окислительные свойства раствора. Потенци ал, до которого заряжается электрод при погружении его в данный раствор, является мерой окислительной актив ности последнего. Его называют электродным окисли тельным потенциалом раствора. Значение окислительно-восстановительного потенци ала зависит от природы окислителя и восстановителя, от их концентраций и температуры. Если концентрации оди наковы, то полученные редокс-потенциалы называют стандартными и обозначают через φ°. Определение аб солютных значений окислительно-восстановительных потенциалов отдельных пар невозможно. Они определяются экспериментально по отношению к стандартному (нормаль ному) водородному электроду, потенциал которого принима ется за нуль при стандартных условиях (температура 25 °С, давление 1 атм, или 101,325 кПа) путем определения электродвижу щей силы (э.д.с), полученного гальванического элемен та (т.е. разность редокс-потенциалов обеих пар).Ряд стандартных потен циалов называется также рядом напряжений металлов. В этом ряду каждый свободный металл вытесняет из раство ров солей все металлы, которые следуют за ним. Металлы, стоящие ранее водорода, вытесняют его из растворов кислот. Значения стандартных окислительных потенциалов приводятся в справочниках. Каждому окислителю в данных условиях соответствует определенный восстановитель: так, перманганат-иону МnО4- в кислой среде соответствует восстановитель Мn+2, в щелочной среде - Мn02; окислителю хлору Сl2 соответ ствует восстановитель хлорид-ион Сl-. Следовательно, каждому окислителю соответствует его окисленная форма (МnО4- ,Сl2) и восстановленная (Мn+2, Cl-1), т.е. окислен ная и восстановленная формы вещества образуют сопря женную ОВ-пару. Система, ОВ-потенциал которой больше, является окислителем по отно шению к ОВ-системе, потенциал которой меньше. Отсюда, чем больше разница ОВ-потенциалов взаимо действующих частиц, тем энергичнее протекает процесс ОВ между ними. Например, для реакции МnО4- + 5 Fe2+ + 8Н+ = Мn2+ + 5Fe3+ + 4Н20 стандартные потенциалы имеют значение: МnО4- + 8Н+ + 5è ↔ Мn2+ + 4Н20; Е0 = + 1,51В; Fe3+ +1è ↔ Fe2+; Е° = + 0,77 В. Потенциал первой системы больше, чем второй. Следовательно, окисленная форма пары МnО4-/ Мn2+является окислителем, а восстановленная форма пары Fe3+/Fe2+ - восстановителем. Определение эквивалента окислителей и восстановителей в методах оксидиметрии В ОВ-реакциях эквивалент окислителей и восстановителей определяется по количеству электронов, отданных или принятых одной молекулой вещества в данной реакции: Э = M : n, где Э – молекулярная масса эквивалента, М - молекулярная масса вещества, n – число отданных или принятых электронов. Например, в реакции между КМn04 и солью Мора (NH4)2Fe(SO4)2·6H2O МnО4- + 5 Fe2+ + 8Н+ = Мn2+ + 5Fe3+ + 4Н20 Ион марганца принимает пять электронов, а ион железа отдает 1 электрон: МnО4- + 8Н+ + 5è ↔ Мn2+ + 4Н20 Fe2+ - 1è ↔ Fe3+ ЭКМп04 = M : 5 = 158,04 : 5 = 31,61 г/моль Э(NH4)2Fe(SO4)2·6H2O = М : 1 = 392,16 г/моль Классификация методов оксидиметрии. Все методы оксидиметрии классифицируют в зависи мости от окислителя или восстановителя, применяемого в рабочем растворе, на следующие виды: 1) перманганатометрия: основным титрантом служит раствор КМn04; наряду с ним обычно используются рас творы сульфата железа (II) FeS04 или щавелевой кислоты Н2С2О4; 2) йодометрия: титранты - растворы йода и тиосульфа та натрия Na2S203; 3) хроматометрия: основной титрант - раствор дихро мата калия К2Сг207; 4) броматометрия: титрант - раствор бромата калия КВг03; Характеристика отдельных методов окислительно-восстановительного титрования Перманганатометрия Метод перманганатометрии основан на реакциях окис ления различных веществ перманганатом калия. Окисление восстановителей можно проводить в различных средах, при чем марганец (VII) восстанавливается в кислой среде до Мn2+-ионов, в нейтральной — до марганца (IV) и в ще лочной — до марганца (VI). Расчет эквивалента перманганата калия в различных средах
Обычно окисле ние проводят в сильнокислой среде, в которой перманганат-ион проявляет наиболее сильные окислительные свойства. Стандартный окислительный потенциал пары Мn04 /Мn2+ составляет 1,51В, поэтому перманганат калия способен реагировать с большинством восстановите лей. Продуктом восстановления КМn04 в кислой среде яв ляется почти бесцветный ион Мn2+: Мn04 + 8Н+ + 5è → Мn2+ + 4Н20, что очень удобно для фиксирования точки эквивалентнос ти. При титровании розовая окраска иона Мn04становит ся заметной от одной избыточной капли рабочего раствора КМn04, поэтому никакого специального индикатора не требуется. Индикато ром служит сам перманганат, окрашенный в красно-фио летовый цвет. Для создания сильнокислой среды пользуются раство рами H2S04. Метод перманганатометрии широко применяют на практике для определения восстановителей и окислите лей. Для определения восстановителей, как правило, ис пользуют методы прямого титрования, для определения окислителей - методы обратного титрования. Например, для определения ионов железа (II) и других восстановителей проводят прямое титро вание их растворов стандартизированным раствором КМп04. Для определения окислителей, таких, как К2Сг207 и другие, используют метод обратного титрования, суть ко торого заключается в том, что к раствору окислителя до бавляют заведомо избыточный и точно измеренный объем рабочего раствора восстановителя, например FeS04. Затем остаток FeS04, не прореагировавший с определяемым окислителем, оттитровывают рабочим раствором КМп04. Приготовление рабочего раствора КМn04 и его стандартизация. Перманганат калия КМn04 содержит примеси. Среди них имеется и соединение оксид марганца (ΙV) Mn02. Это соединение катализирует реакцию окисления воды перманганатом: 4Mn04- + 2H20 = 4Mn02 + 302 + 40H-. Кроме этого, при растворении в воде перманганат ка лия окисляет органические вещества, которые содержат ся в дистиллированной воде. На устойчивость раствора КМn04 влияет даже свет. Все эти факторы изменяют кон центрацию раствора КМn04 и вследствие этого нельзя при готовить его первичный стандартный раствор. В этом случае сначала готовят раствор КМn04 с концентрацией, прибли зительно равной требуемой (обычно 0,02 или 0,05 моль/л). Раствор переливают в бутыль из темного стекла и оставляют на несколько дней до полного осаждения Мn02. После этого раствор КМn04 берут для работы с по мощью сифона так, чтобы осадок Мn02 остался на дне бутылки. В качестве исходных веществ для установки точной концентрации рабочего раствора КМn04 обычно применя ют оксалат аммония (NH4)2C204•Н20, оксалат натрия Na2C204 и щавелевую кислоту Н2С20·2Н20. Наиболее удобным из этих веществ является оксалат натрия, так как он кристаллизуется без воды и не гигроскопичен. Йодометрия Метод йодометрии основан на ОВ-реакциях, связанных с превращением I2 в ионы I- и обратно: I2 + 2е ↔ 21- Е0(I2/2I-) = + 0,54В Окислитель восстановитель Особенности йодометрии обусловлены в первую очередь хорошей обратимостью записанной полуреакции и невысо ким значением стандартного окислительного потенциала пары I2/2I-. Значение окислительного потенциала этой пары характеризует йод как окислитель средней силы, а ионы I- - как восстановитель средней силы. Поэтому йодометрические методы применяются как для определения окислителей, так и для определения восстановителей. Рабочими растворами в йодометрии являются стандар тизированные растворы йода I2 (окислитель метода) и тио сульфата натрия Na2S203 (восстановитель метода). Основ ной титриметрической реакцией в методе является взаи модействие раствора йода и рабочего раствора тиосульфа та натрия: I2 + 2Na2S203 = 2NaI + Na2S406 Тиосульфат Тетратионат натрия натрия В качестве индикатора в йодометрии используется водный раствор крахмала, который образует с молеку лярным йодом йодкрахмальное соединение синего цвета. При титровании восстановителей рабочим раствором йода точка эквивалентности определяется по появлению интенсивно-синего окрашивания. При титровании йода рабочим раствором тиосульфата натрия конец реакции определяется по исчезновению синей окраски от одной капли раствора тиосульфата натрия. Крахмал необходи мо добавлять в самом конце титрования, когда йода в растворе становится мало и раствор приобретает соло менно-желтый цвет. Крахмал, добавленный к раствору с высокой концентрацией йода, становится черным и раз рушается, что вносит ошибку в определение точки экви валентности. Очень высокая чувствительность крахмала к йоду и резкое изменение окраски раствора в точке эквивалентно сти позволяют использовать рабочие растворы меньшей концентрации, чем в других методах титриметрического анализа (от 0,01000 н. до 0,05000 н.). Многие йодометрические реакции обратимы и проте кают до конца только при создании следующих усло вий: 1) титрование необходимо проводить на холоде, так как, во-первых, йод - летучее соединение и, во-вторых, при нагревании чувствительность крахмала к йоду умень шается; 2) рН раствора не должен превышать 9, так как в ще лочной среде йод диспропорционирует: I2 + 20Н- ↔ I- + IO- + Н20, а IO-, являясь более сильным окислителем, чем I2, окис ляет тиосульфат-ион до сульфат-иона: S2032- + 20Н- + 4I0- = 2SO42- + Н20 + 4I- Большим преимуществом йодометрического метода является доступность чувствительного и обратимого к йоду индикатора. К недостаткам относится низкая устой чивость раствора йода и неполное протекание реакций йода со многими восстановителями. Йодометрическое определение восстановителей прово дят по методу прямого или обратного титрования. Окис лители определяют путем заместительного (косвенного) титрования. При определении восстановителей методом прямого титрования рабочим раствором является раствор йода. Этим методом определяют соединения мышьяка (III), сурьмы (III), олова (II), тиосульфаты, небольшие количе ства H2S (например, в минеральных водах), сульфидов и сульфитов. В качестве примеров реакций, протекающих при прямом титровании восстановителей йодом, можно привести следующие: SO32- + I2 + Н20 = SO42- + 2I- + 2Н+; As02- + I2 + 2Н20 = HAsO42- + 2I-+ ЗН+. В тех случаях, когда прямое титрование осложнено (на пример, восстановитель летучий или реакция протекает очень медленно), для определения восстановителей исполь зуют метод обратного титрования. Для этого нужны два рабо чих раствора - йода и тиосульфата натрия. К определяемому восстановителю добавляют точно отмеренный объем раство ра йода, взятого в избытке по отношению к восстановителю. Между йодом и восстановителем происходит реакция, затем остаток непрореагировавшего йода оттитровывается раство ром тиосульфата. Например, при определении H2S: H2S + I2 = 2I- + S + 2H+; Избыток I2 + 2 S2032- = 2I- + S4062- Остаток Этим методом определяют большие концентрации H2S, сульфидов, сульфитов, ряда металлов в порошках (напри мер, цинка), некоторых органических соединений. Для определения окислителей методом заместитель ного титрования поступают следующим образом. К под кисленному серной кислотой раствору KI, взятому в из бытке, прибавляют точно отмеренный пипеткой Мора объем раствора определяемого окислителя (например, КСlO3) и выделившийся йод оттитровывают тиосульфа том натрия: СlO3- + 6I- + 6Н+ = Сl- + 3I2 + ЗН20; I2 + 2S2032- = 2I- + S4062-. Число молей эквивалентов Na2S203 равно числу молей эквивалентов йода, а последнее равно числу молей эквива лентов определяемого окислителя (КСlO3). Таким обра зом, хотя определяемый окислитель и Na2S203непосред ственно друг с другом не реагируют, тем не менее их коли чества эквивалентны. Поэтому для вычисления можно пользоваться обычной формулой, применяемой при пря мом титровании: С(1/6КСlO3) • V(КСl03) = C(Na2S203) • V(Na2S203). Этим методом определяют многие окислители, напри мер Сl2, Вг2, КМп04, СаОС12, нитриты, Н202, соли Fe(III), Cu(II), соединения мышьяка (V).
Гравиметрический анализ (гравиметрия, весовой анализ) — метод количественного химического анализа, основанный на точном измерении массы вещества. Использует закон сохранения массы веществ при химических превращениях. Сыграл большую роль в становлении закона постоянства состава химических соединений, закона кратных отношений, периодического закона и др. Применяется для определения химического состава различных объектов (горных пород и минералов), качества сырья и готовой продукции, содержания кристаллизационной воды в солях, зольности топлива и так далее. К достоинствам гравиметрического анализа относят высокую точность (обычно погрешность составляет 0,1—0,2 %) и отсутствие необходимости в предварительной градуировке измерительных приборов. С другой стороны, его проведение зачастую более трудоёмко и занимает больше времени по сравнению с другими методами При выполнении гравиметрического анализа методом осаждения обычно требуется следующая химическая посуда: стеклянный бюкс, для взвешивания твердых и жидких веществ; фарфоровый тигель для озоления фильтров и прокаливания осадков; тонкостенные химические стаканы объемом 100, 200 и 400 мл для осаждения, растворения веществ и т.п.; часовые стекла стеклянные палочки с резиновыми наконечниками для перенесения жидкостей при фильтровании, для перемешивания, собирания частичек осадка со стенок стакана и т.п.; воронка для фильтрования и промывания осадков; беззольные бумажные фильтры; промывалка с бидистиллированной водой и эксикатор с осушителем для охлаждения и хранения осадков. Кроме того, необходимы электрическая плитка, сушильный шкаф и муфельная печь для термической обработки, сушки и прокаливания продуктов анализа. Прежде чем приступить к анализу, необходимо тщательно подготовить соответствующую посуду, так как от ее чистоты в значительной степени зависят результаты анализа. Стеклянную посуду промывают водопроводной водой и загрязненные места оттирают ершами, затем моют ее раствором мыла или соды. Если при этом стекло не отмывается, то его моют хромовой смесью. С хромовой смесью надо обращаться очень осторожно! Фарфоровые тигли тщательно очищают, протирают сухой тряпочкой, а затем прокаливают, доводя их до постоянной массы. Для анализа обычно используют не все вещество, а только его часть, называемую «пробой». Проба должна быть представительной, то есть отражать средний химический состав всего анализируемого объекта. Природные вещества или продукты производства, состав которых следует определить, в большинстве случаев являются неоднородными по составу. Поэтому состав пробы, взятой в какой-нибудь одной части исследуемого объекта не будет отражать его средний химический состав. Чтобы результаты анализа точнее отражали состав всей партии материала, отбирают среднюю пробу. Существуют различные способы отбора средней пробы. Но во всех случаях при отборе средней пробы придерживаются следующего правила: чем больше порций вещества взято из различных мест исследуемой партии, тем больше вероятность, что данная проба будет отражать средний состав анализируемого вещества. Одним из способов усреднения пробы является квартование, заключающееся в том, что пробы, отобранные в нескольких местах анализируемого объекта, измельчают, смешивают и, полученную смесь, высыпают на лист бумаги равномерным слоем в виде квадрата или круга. Затем шпателем делят этот слой на четыре сектора. Два противоположных сектора убирают, а с остальными повторяют вышеописанную операцию. Уменьшение пробы квартованием продолжают до тех пор, пока она не будет составлять, такого количества анализируемого вещества, которого не только было бы достаточно для выполнения анализа, но и хватило бы на случай повторного и арбитражного, т.е. спорного анализа, выполняемого в особом порядке, установленном законом. Приготовленную пробу измельчают до необходимого размера частиц, который требуется при последующей химической обработки вещества, и помещают в подходящий сосуд для хранения. После отбора средней пробы приступают к расчету оптимальной величины навески. Навеской называется часть средней пробы, точно взвешенная на аналитических весах. Величину навески рассчитывают в зависимости от оптимального количества получаемого осадка. Слишком большие, так и слишком малые навески невыгодны. Действительно, в первом случае получится слишком много осадка, который будет невозможно хорошо промыть. При слишком малой навеске неизбежны ошибки взвешивания и других операций анализа составят слишком высокий процент определяемой величины и точность анализа окажется пониженной. Опытом установлено, что оптимальное количество осадка (гравиметрической формы) в случае кристаллических осадков (BaSO4, PbSO4) составляет около 0,5 г, а в случае объемистых аморфных осадков (Fe(OH)3, H2SiO3- nH2O) - около 0,1 - 0,3 г. Рассчитаем, например, какую необходимо взять навеску ВаС12 . 2Н2О, чтобы получить 0,5 г BaSO4. Из уравнения реакции ВаС12 + H2SO4 = BaSO4 + 2HC следует, что 1 моль BaSO4 соответствует 1 моль ВаС12 . 2Н2О 233,42 г/моль соответствуют 244,31 г/моль 0,5 г соответствуют х г следовательно, 0,52 233,42 0,5 244,31 х г. Расчет навески исследуемого вещества относится к ориентировочным вычислениям, т.к. в этом случае не требуется большой точности. Так в нашем примере для анализа можно взять точно взвешенное количество вещества в пределах от 0,5 до 0,7 г. Часто после высушивания или прокаливания химический состав осадка изменяется, поэтому в ГМА различают осаждаемую и гравиметрическую формы осадка. Осаждаемая форма - это осадок с химическим составом, в виде которого его осаждают, а гравиметрическая – взвешивают. Так, например, при определении количества бария в хлориде барии взвешивают не элементарный барий, а полученное при его анализе соединение -BaSO4, так же при определении кальция взвешивают СаО, при определении магния - Мg2P2О7 и т.д. Осаждаемая форма должна быть практически нерастворимой, образовываться в виде крупных кристаллов и легко переходить в гравиметрическую. Гравиметрическая форма должна иметь постоянный известный химический состав, быть химически устойчивой, иметь возможно большую молярную массу при возможно меньшем вкладе в нее определяемого вещества, что уменьшает погрешность ГМА за счет погрешностей взвешивания или потерь осадка. Содержание определяемого вещества X рассчитывают в граммах или массовых долях (%), используя гравиметрический фактор пересчета (F). Он выражает вклад молярной массы определяемого вещества в молярную массу гравиметрической формы. Гравиметрическое определение железа основано на осаждении иона Fe3+ раствором гидроксида аммония в виде Fe(OH)3: FeCl3 + 3NH4OH = Fe(OH)3 + 3NH4C1 Осадок отфильтровывают, промывают и прокаливают: 2Fe(OH)3 C 0 800 Fe2O3+3H2O Оксид Fe2O3 взвешивают. Оксид железа (III) является гравиметрической формой определяемого железа. По его массе рассчитывают содержание железа. При осаждении гидроокисью аммония необходимо, чтобы железо было в окисленной форме. Осадок Fe(OH)2 не осаждается количественно и очень плохо фильтруется, поэтому если в растворе может присутствовать Fe2+, его необходимо перед осаждением окислить азотной кислотой. Азотная кислота, кроме того, предотвращает образование основных солей, загрязняющих осадок. Аморфный осадок Fe(OH)3 обладает ярко выраженными адсорбционными свойствами. Количество адсорбированных примесей зависит от поверхности осадка. Поэтому при осаждении создают условия, при которых поверхность является наименьшей, т.е. производят осаждение из небольшого объема (10-15 мл) горячего раствора. Растворимость гидроокиси железа мала, поэтому для количественного осаждения достаточна очень малая концентрация гидроксильных ионов, которую легко вычислить из величины произведения растворимости Fe(OH)3: Ks(Fe(OH)3)=[Fe3+] [OH- ] =1. 10-36 Гравиметрическое определение веществ по массе их сульфатов основано на осаждении сульфат-ионов из анализируемого раствора вещества с помощью раствора хлорида бария и последующем измерении массы полученного осадка. По массе осадка рассчитывают массу серной кислоты. Определение сульфатов является одним из важнейших применений гравиметрического анализа. С определением сульфатов приходится встречаться при анализе многих природных и технических материалов. В некоторых случаях они являются одним из главных компонентов исследуемого вещества (например, в гипсе, природной воде). В других случаях сульфаты являются примесью, определение которой важно для характеристики различных минералов кислот, оснований, солей и других технических продуктов. Для определения серной кислоты к ее раствору прибавляют разбавленный раствор хлорида бария до полного осаждения сульфат-ионов: H2SO4 + BaCl2 = BaSO4↓ + 2HCl или в ионном виде SO4 2- + Ba2+ = BaSO4↓. Из реакции следует, что n(½H2SO4) = n(½BaCl2) или n(H2SO4) = n(BaCl2). Осаждение BaSO4 производят в растворе, нагретом до температуры кипения. Осадок отфильтровывают, промывают водой, прокаливают при 800-9000С и точно взвешивают.
Общая характеристика катионов третьей группы Катионы третьей группы – осаждаются серной кислотой и ее солями, которые являются групповыми реагентами. При взаимодействии с сульфатом катионы дают нерастворимые в воде сульфаты бария и стронция и плохо растворимый сульфат кальция. Они образуют также нерастворимые в воде фосфаты, сульфиты, карбонаты. Нитраты, бромиды, хлориды, гидрокарбонаты хорошо растворимы в воде. Гидроксиды кальция, бария, стронция обладают слабощелочными свойствами и в воде растворимы плохо. Катионы бесцветны, окраска их солей зависит от аниона. Соединения кальция, бария и стронция широко применяют как реактивы, минеральные краски, строительные материалы. Значение в медицине и фармации катионов 3-ей аналитической группы В медицинской и фармацевтической практике применяют соли кальция и бария. Сульфат кальция или гипс применяют для наложения повязок, при изготовлении зубных порошков. Хлорид кальция, глюконат кальция, лактат кальция используют при аллергических заболеваниях, как кровоостанавливающее средство, при пониженной свертываемости крови. Карбонат кальция или мел способен снижать повышенную кислотность желудочного сока. Он входит в состав зубных порошков и паст. Соединения кальция играют важную роль в организме, входя в состав костей, тканей, крови. Они регулируют деятельность системы свертывания крови, нервные и имунные процессы, работу сердца. Из солей бария в медицине применяется сульфат бария как рентгеноконтрасное средство при рентгеноскопии желудка и кишечника.
Общая характеристика катионов четвертой аналитической группы Групповым реагентом на катионы 4-ой группы являются щелочи, при взаимодействии с которыми образуются осадки гидроксидов, растворимые в избытке реактива. Осадки растворяются в избытке реактива, т.к. ионы обладают амфотерными свойствами. Гидроксиды катионов также растворяются в кислотах, образуя соли катионов с анионами кислот. Катионы алюминия и цинка в растворах имеют постоянную ст. окисления, остальные переменную и в зависимости от нее проявляют свойства окислителей или восстановителей. Применение в медицине и фармации солей катионов 4-ой аналитической группы Сульфат цинка применяют как антисептическое и вяжущее средство в виде глазных капель при конъюнктивитах, в виде растворов для смазывания и спринцеваний при заболеваниях горла, мочеполовых путей. Оксид цинка входит в состав присыпок, мазей, паст, используемых для лечения кожных заболеваний, т.к. оказывает вяжущее, подсушивающее и дезинфицирующее действие. Гидроксид алюминия находит применение внутрь при гиперацидных гастритах, язве желудка, двенадцатиперстной кишки – как антацидное средство: при отравлениях – как адсорбирующее средство; как наружное средство в присыпках, обладающее обволакивающими свойствами. Входит в состав препарата «Альмагель», применяемого при заболеваниях жкт. Силикат алюминия входит в состав белой глины, применяемой в виде присыпок, паст и мазей. Квасцы (сульфат калия-алюминия) в растворах применяют наружно, как вяжущее антисептическое и противовоспалительное средство; в виде карандашей – как кровоосстанавливающее средство и для прижиганий. Гидроарсенит натрия, арсенит калия и оксид мышьяка (3) применяют при малокровии, истощении, неврастении как общеукрепляющее, тонизирующее средство, стимулирующее кроветворение. Арсенат натрия применяют в виде инъекций, арсенит калия – внутрь в каплях, оксид мышьяка(3) – внутрь в пилюлях. Оксид мышьяка (3) – используется в зубоврачебной практике как некротизирующее средство. Все препараты мышьяка – ядовиты.
Реакции катионов бария Ba2+
BaCl2+K2CrO4→BaCrO4↓+2KCl Образуется желтый кристаллический осадок хромата бария, растворимый в азотной и соляной кислотах: BaCrO4+2HCl→BaCl2+H2CrO4 BaCrO4+2HNO3→Ba(NO3)2+ H2CrO4 В серной кислоте желтый осадок осадок хромата бария переходит в белый осадок сульфата бария: BaCrO4+H2SO4→BaSO4↓+ H2CrO4 В уксусной кислоте и других слабых кислотах осадок хромата бария нерастворим. При взаимодействии солей бария с солями дихромовой кислоты также образуется осадок хромата бария: 2BaCl2+K2Cr2O7+H2O→ 2BaCrO4↓+2KCl+2HCl При проведении реакции выделяется соляная кислота, которая частично растворяет осадок хромата бария, поэтому при применении дихроматов осаждение хромата бария происходит не полностью. Для полного осаждения хромата бария с помощью дихроматов используют добавку солей уксусной кислоты. Соли уксусной кислоты взаимодействует с соляной кислотой, в итоге образуется слабая уксусная кислота, в которой осадок хромата бария не растворяется: CH3COONa+HCl→CH3COOH+NaCl Ионы стронция и кальция осадка с дихроматами не образуют, так как образующиеся хроматы кальция и стронция растворяются полностью в выделяющейся соляной или уксусной кислоте.
BaCl2+(NH4)2C2O4→BaC2O4↓+NH4Cl Образуется белый кристаллический осадок оксалата бария, растворимый в соляной и азотной кислотах, при нагревании – в концентрированной уксусной кислоте.
BaCl2+(NH4)2CO3→BaCO3↓+NH4Cl Образуется белый аморфный осадок, при нагревании переходящий в кристаллический, растворимый в соляной, азотной и уксусной кислотах.
BaCl2+Na2HPO4→BaHPO4↓+2NaCl Образуется белый кристаллический осадок, растворимый в соляной, азотной и уксусной кислотах.
BaCl2+CaSO4→ BaSO4↓+CaCl2 Образуется белый осадок сульфата бария.
CO – CO – CO – Na CO – CO – CO BaCl2+ │ ║ → │ ║ Ba ↓+ 2NaCl CO – CO – CO – Na CO – CO – CO При нанесении на фильтровальную бумажку капли нейтрального раствора соли бария и раствора родизоната натрия появляется красно-бурое окрашивание вследствие выделения осадка родизоната бария. При добавлении капли соляной кислоты красно-бурое окрашивание переходит в красное, так как родизонат бария переходит в гидрородизонат бария красного цвета. CO – CO – CO CO – CO – CO - 2 │ ║ Ba+2HCl → │ ║ Ba ↓+ BaCl2 CO – CO – CO CO – CO – COH 2 В присутствии K2CrO4 родизонат бария не образуется . Реакция специфична для катионов бария.
Реакции катионов стронция Sr2+
CO – CO – CO – Na CO – CO – CO SrCl2+ │ ║ → │ ║ Sr ↓+ 2NaCl CO – CO – CO – Na CO – CO – CO При проведении этой реакции на фильтровальной бумаге образуется красно-бурое окрашивание осадка родизоната стронция, исчезающее при добавлении капли соляной кислоты (растворение осадка). Реакция катиона стронция с родизонатом натрия происходит в присутствии K2CrO4 вследствие слабой растворимости осадка SrCrO4. Это свойство используют при открытии ионов стронция в присутствии ионов бария. На фильтровальную бумагу наносят каплю раствора K2CrO4 и каплю исследуемого раствора. При этом бумага окрашивается в желтый цвет вследствие образования осадков SrCrO4 и ВаCrO4. Затем на пятно наносят каплю раствора родизоната натрия. В присутствии ионов стронция пятно окрашивается в буро-красный цвет, в отсутствии стронция окраска остается желтой, так как ВаCrO4 реакцию с родизонатом натрия не дает. Реакция с родизонатом натрия позволяет открыть катионы бария и стронция при совместном присутствии. Если при проведении этой реакции на бумаге образовалось красно-бурое пятно, исчезающее при добавлении HCl, в растворе присутствует стронций. Если красно-бурое пятно краснеет при добавлении HCl, то в растворе присутсвует барий и возможно стронций. Для подтверждения присутствия стронция проводят реакцию с родизонатом натрия в присутствииK2CrO4. Окрашивание желтого пятна в красно-бурый цвет указывает на присутствие стронция.
Реакции катионов кальция Сa2+
CaCl2+(NH4)2C2O4→CaC2O4↓+2NH4Cl Образуется кристаллический белый осадок оксалата кальция, который растворим в минеральных кислотах и нерастворим в уксусной кислоте( в отличие от оксалатов бария и стронция).
CaCl2+ K4[Fe(CN)6]+2NH4OH→ Ca(NH4)2[Fe(CN)6]↓+ 2KCl+2KOH В слабощелочной среде рН=9 образуется белый кристаллический осадок гексациано (2) феррата кальция-аммония, растворимый в минеральных кислотах, но не растворимый в уксусной кислоте. Реакцию проводят в присутствии буферной смеси NH4Cl+ NH4OH при нагревании. Проведению реакции мешает ион Ba2+.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
