Ответы по аналитике. Основные положения качественного анализа
 Скачать 0.71 Mb. Скачать 0.71 Mb.
|
2. ТИТРИМЕТРИЧЕСКИЙ АНАЛИЗТитриметрический анализ основан на точном измерении количества реактива, израсходованного на реакцию с определяемым веществом. Для рассмотрения материала настоящего раздела потребуются следующие определения. Титрованный, или стандартный, раствор – раствор, концентрация которого известна с высокой точностью. Титрование– прибавление титрованного раствора к анализируемому для определения точно эквивалентного количества. Титрующий раствор часто называют рабочим раствором или титрантом. Например, если кислота титруется щелочью, раствор щелочи называется титрантом. Момент титрования, когда количество прибавленного титранта химически эквивалентно количеству титруемого вещества, называется точкой эквивалентности (стехиометричности). В титриметрическом анализе может быть использована не любая химическая реакция. Реакции, применяемые в титриметрии, должны удовлетворять следующим основным требованиям: 1) реакция должна протекать количественно, т.е. константа равновесия реакции должна быть достаточно велика; 2) реакция должна протекать с большой скоростью; 3) реакция не должна осложняться протеканием побочных процессов; 4) должен существовать способ определения окончания реакции. Если реакция не удовлетворяет хотя бы одному из этих требований, она не может быть использована в титриметрическом анализе. Виды титриметрического анализа Титриметрический анализ может быть основан на различных типах химических реакций:
Типы титрования Различают прямое, обратное титрование и титрование заместителя.
ИндикаторыЧтобы зафиксировать момент, когда все титруемое вещество прореагировало с титрантом, применяют вещества, которые внешне заметным образом изменяются в зависимости от того, присутствует или отсутствует титруемое вещество (или титрант) в растворе. Такие вещества называют индикаторами. К таким внешне заметным изменениям относят изменение окраски раствора, образование труднорастворимых соединений, выпадающих в осадок или вызывающих помутнение раствора, окрашивание в характерный цвет осадка, образующегося при реакции, изменение поверхностного натяжения и т.д. Действие различных индикаторов основано на различных принципах. Наиболее часто судят о работе индикатора по изменению цвета раствора. Индикатор должен реагировать на изменения параметра системы и изменять свой цвет при определенном значении этого параметра. Значение, при котором наблюдается резкое изменение окраски индикатора, называют показателем индикатора или показателем титрования рТ. Значение рТ часто не совпадает со значением параметра системы в точке эквивалентности, что вызывает индикаторную ошибку. Если индикатор изменяет цвет до наступления точки эквивалентности, значит, часть титруемого вещества не прореагировала и результаты анализа занижены. Если индикатор изменяет цвет после точки эквивалентности, то добавлен избыток титранта и результаты анализа завышены. Основной характеристикой индикаторов принято считать не значение конечной точки титрования, а интервал перехода окраски индикатора. Изменение окраски индикатора становится заметным для человеческого глаза не при конкретном значении рТ, а в некотором интервале этих значений рК1т} ± 1.
Общая характеристика катионов первой аналитической группы К первой аналитической группе относятся катионы щелочных металлов - К+, Na+ NH4+. Большинство солей катионов 1-ой группы представляют собой кристаллические порошки, хорошо растворимые в воде. Вследствие этого катионы 1-ой аналитической группы не имеют группового реактива и их открывают с помощью специальных дробных реакций. Открытию катионов 1-ой аналитической группы мешают катионы других групп, поэтому при проведении качественного анализа из раствора сначала необходимо удалить катионы других групп с помощью осадочных реакций. Калий и натрий образуют сильные основания КОН и NaОН. Их соли с сильными кислотами типа соляной, серной, азотной в воде устойчивы и не подвергаются гидролизу. Гидроксид аммония NH4ОН – слабое основание, поэтому соли аммония с сильными кислотами в воде легко гидролизуют. Соли аммония летучи и в отличие от солей щелочных металлов легко удаляются при нагревании и прокаливании смесей солей. Эти свойством пользуются при удалении из смеси солей аммония. Катионы 1-ой аналитической группы широко распространены в природе, являясь важными составными частями земной коры, океанов, морей, биосферы. Их соли получили широкое распространение в химии, с.х. и т.д. Применение в медицине и фармации солей катионов 1-ой аналитической группы Катионы калия и натрия входят в состав протоплазмы, крови, тканей и органов растений и животных. Поэтому их используют в медицине и фармации. Хлорид натрия входит в состав физиологических растворов, кровозаменителей, широко применяется как вспомогательное средство при приготовлении таблеток, микстур. Бромид натрия, бромид калия и бромид аммония часто применяют как средства, действующие на нервную систему, регулирующие ее деятельность. Сульфат натрия используют как слабительное средство. Гидрокарбонат натрия применяют при повышенной кислотности желудочного сока, вводят в состав кровозаменяющих растворов, ряда лекарственных веществ для регуляции рН. Гидроксид аммония в виде 10% раствора используют при обморочных состояниях, как средство, возбуждающее при вдыхании паров деятельность дыхательных центров, для мытья рук в хирургической практике. Хлорид аммония применяют диуретическое и отхаркивающее средство. Катионы калия, натрия и аммония входят в состав многих лекарственных препаратов типа кислот. Реакции катионов натрия Na+
NaCl+ KH2SbO4→NaH2SbO4↓+KCl Образуется белый мелкокристаллический осадок дигидроантимоната натрия, растворимый в щелочах и кислотах. Проведению реакции мешают соли лития.
Na++ HZn(UO2)3(CH3COO)9→NaZn(UO2)3(CH3COO)9↓+H+ Образуется мелкокристаллический осадок цинкуранилацетата натрия. Осадок растворим в щелочах и кислотах. Проведению реакции мешают соли лития.
Реакции катионов калия К+
KCl+ NaHC4H4O6→KHC4H4O6↓+NaCl Образуется белый мелкокристаллический осадок гидротартрата калия, растворимый в щелочах и кислотах. Проведению реакции мешают катионы аммония
2KCl+ Na3[Co(NO2)6]→NaK2[Co(NO2)6]↓+3NaCl Образующийся осадок желтого цвета растворим в кислотах и щелочах. Проведению реакции мешают катионы аммония.
2KCl+ Na2Pb[Cu(NO2)6]→K2Pb[Cu(NO2)6]↓+2NaCl Образуется осадок черного цвета, растворим в кислотах и щелочах.
Реакции катионов аммония NH4+
NH4Cl+NaOH→NH4OH+NaCl NH4OH→NH3↑+H2O При проведении реакции вследствие разложения образующегося гидроксида аммония на аммиак и воду появляется запах аммиака. Выделение аммиака можно определить с помощью красной лакмусовой бумажки или фенолфталеиновой бумажки, смоченной водой. При выделении аммиака лакмусовая бумажка изменяет цвет на синий,а фенолфталеиновая бумажка краснеет.
NH4Cl+ NaHC4H4O6→(NH4)HC4H4O6↓+NaCl Образуется белый кристаллический осадок гидротартрата аммония, растворимый в щелочах и кислотах. Проведению реакции мешают катионы калия.
Hg NH4Cl+2K2[HgI4]+4KOH→[O NH2]I+3H2O+KCl+7KI Hg Образуется красно-бурый осадок, растворимый в кислотах и щелочах. Реакция очень чувствительна и специфична.
2NH4Cl+ Na3[Co(NO2)6]→ Na(NH4)2[Co(NO2)6]↓+2NaCl Образуется осадок желтого цвета, растворимый в кислотах и щелочах. Проведению реакции мешают катионы калия.
2NH4++ Na2Pb[Cu(NO2)6]→(NH Образуется осадок черного цвета, растворим в кислотах и щелочах. Проведению реакции мешают катионы калия.
Анализ смеси катионов первой аналитической группы. Смесь солей, содержащих катионы 1-ой группы, растворяют в воде и проводят качественные реакции. Ввиду того, что катионы калия и аммония дают одинаковые реакции, сначала открывают ион аммония специфичными для него реакциями с реактивом Несслера и со щелочами. В присутствии катиона аммония, калий открыть нельзя, поэтому для того, чтобы открыть калий. Необходимо удалить катион аммония. Удаление проводят, упаривая часть раствора и прокаливая осадок в тигле. Охлаждают тигель и растворяют осадок в воде. Полноту удаления аммония проверяют реактивом Несслера. Открытие катиона натрия осуществляют, используя раствор цинкуранилацетата, получившиеся кристаллы рассматривают под микроскопом Катион калия открывают реакциями с гидротартратом натрия, гексанитро(3) кобальтом натрия и гексанитро(3) купратом свинца и натрия.
Электролитическая диссоциация — процесс распада электролита на ионы при его растворении или плавлении. Классическая теория электролитической диссоциации была создана С. Аррениусом и В. Оствальдом в 1887 году. Аррениус придерживался физической теории растворов, не учитывал взаимодействие электролита с водой и считал, что в растворах находятся свободные ионы. Русские химики И. А. Каблукови В. А. Кистяковский применили для объяснения электролитической диссоциации химическую теорию растворов Д. И. Менделеева и доказали, что при растворении электролита происходит его химическое взаимодействие с водой, в результате которого электролит диссоциирует на ионы. Классическая теория электролитической диссоциации основана на предположении о неполной диссоциации растворённого вещества, характеризуемой степенью диссоциации α, т. е. долей распавшихся молекул электролита. Динамическое равновесие между недиссоциированными молекулами и ионами описывается законом действующих масс . Вещества, распадающиеся на ионы, называют электролитами. Электролиты – вещества с ионной или сильно ковалентной связью: кислоты, основания, соли. остальные вещества – неэлектролиты; к ним относятся вещества с неполярной или слабо полярной ковалентной связью; например, многие органические соединения. Основные положения ТЭД (Теории электролитической диссоциации): Молекулы распадаются на положительно и отрицательно заряженные ионы (простые и сложные). Под действием электрического тока катионы (положительно заряженные ионы движутся к катоду(-), а анионы (отрицательно заряженные ионы) к аноду(+) Степень диссоциации зависит от природы вещества и растворителя, концентрации, температуры. Если степень диссоциации зависит от природы вещества, то можно судить, что существует разграничение между определёнными группами веществ. Большая степень диссоциации присуща сильным электролитам (большинству оснований, солям, многим кислотам). Стоит учесть, что распад на ионы – обратимая реакция. Так же стоит сказать, что в данной теме не будут разобраны примеры диссоциации двойных и основных солей, их диссоциация описана в теме “соли”. Примеры сильных электролитов: NaOH, K2SO4, HClO4 Уравнения диссоциации: NaOH⇄Na++OH- K2SO4⇄2K++SO42- HClO4⇄H++ClO4- Количественной характеристикой силы электролитов является степень диссоциации (α) – отношение молярной концентрации продиссоциировавшего электролита к его общей молярной концентрации в растворе. 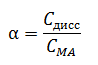 Степень диссоциации выражается в долях единицы или в процентах. Интервал значений – от 0 до 100%. α = 0% относится к неэлектролитам (диссоциация отсутствует) 0% <α < 100% относится к слабым электролитам (диссоциация неполная) α = 100% относится к сильным электролитам (полная диссоциация) Так же стоит помнить про количество ступеней диссоциации, например: Диссоциация раствора H2SO4 H2 SO4⇄H++HSO4- HSO4-⇄H++SO42- У каждой ступени диссоциации своя степень диссоциации. Например, диссоциация солей CuCl2, HgCl2: CuCl2⇄Cu2++2Cl- диссоциация протекает полностью А в случае с хлоридом ртути диссоциация идёт неполностью и то не до конца. HgCl2⇄HgCl++Cl- Возвращаясь же к раствору серной кислоты, стоит сказать, что степень диссоциации обеих ступеней разбавленной кислоты гораздо больше, чем у концентрированной. При диссоциации концентрированного раствора очень много молекул вещества и большая концентрация гидроанионов HSO4-. У многоосновных кислот и многокислотных оснований диссоциация идёт в несколько ступеней (в зависимости от основности). Перечислим сильные и слабые кислоты и приступим к уравнениям ионного обмена: Сильные кислоты ( HCl, HBr, HI, HClO3, HBrO3, HIO3, HClO4, H2SO4, H2SeO4,HNO3, HMnO4, H2Cr2O7) Слабые кислоты (HF, H2S, H2Se, HClO, HBrO, H2SeO3, HNO2,H3PO4, H4SiO4, HCN, H2CO3, CH3COOH) Химические реакции в растворах и расплавах электролитов протекают с участием ионов. В таких реакциях степени окисления элементов не изменяются, и сами реакции называются реакциями ионного обмена. Реакции ионного обмена будут протекать до конца (необратимо) , если образуются малорастворимые или практически нерастворимые вещества (они выпадают в осадок), летучие вещества (выделяются в виде газов) или слабые электролиты (например, вода). Реакции ионного обмена принято писать в три стадии: 1. Молекулярное уравнение 2. Полное ионное уравнение 3. Сокращенное ионное уравнение. При написании обязательно указывать осадки и газы, а так же руководствоваться таблицей растворимости. Реакции, где все реагенты и продукты получились растворимые в воде, не протекают. Протолитическая теория кислот и оснований Бренстеда-Лоури Протолитическая теория кислот и оснований находится на грани сразу двух наук - физики и химии. С ее помощью описываются свойства и природа всех оснований и кислот. Учеными они подразделяются на два класса веществ, которые взаимодействуют друг с другом. Задача теории Протолитическая теория кислот и оснований помогает решить важную задачу: предсказать, какие продукты образуются в результате их взаимодействия и каким образом будет протекать эта реакция. Для этого экспертами применяются количественные и качественные особенности кислоты и основания. При этом существует несколько теорий, которые по-разному трактуют, что такое кислоты и основания. По-разному они оценивают и другие их характеристики. В конечном счете от этого зависит, каким будет результат реакции. Концептуальные химические системы. Протолитическая теория кислот и оснований крайне популярна, когда нужно узнать, как они взаимодействуют в природе. Ее широко применяют в производственной практике и научной сфере. Теоретические знания о последствиях взаимодействия оснований и кислот определяют формирование концептуальных систем химии, влияют на всевозможные теоретические концепции практически во всех химических дисциплинах. |
