Ответы по аналитике. Основные положения качественного анализа
 Скачать 0.71 Mb. Скачать 0.71 Mb.
|
|
Реакции катионов железа Fe3+
4FeCl3+3K4[Fe(CN)6]→ Fe4[Fe(CN)6]3↓+ 12KCl В слабокислой среде образуется темно-синий осадок берлинской лазури. Реакция специфична.
FeCl3+NH4SCN→Fe(SCN)3+3NH4Cl Образуется роданид, имеющий кроваво-красную окраску. Реакция специфична.
ПРАВИЛА ТЕХНИКИ БЕЗОПАСНОСТИ 1. В лаборатории категорически запрещается работать одному, т.к. даже небольшая незамеченная неисправность в оборудовании или ошибка в выполнении эксперимента может привести к тяжелым последствиям. 2. Избегайте лишних движений и разговоров в лаборатории. 3. Избегайте непосредственных контактов кожи, глаз и дыхательных путей с химикатами. На занятиях постоянно носите лабораторный халат. Кроме того, если у вас длинные волосы, их следует аккуратно прибрать, чтобы они не могли соприкасаться с нагревательными приборами, реактивами и т.д. 4. Все работы с ядовитыми и сильнопахнущими веществами, с концентрированными растворами кислот, щелочей, а также упаривание их растворов следует проводить только в вытяжном шкафу. Створки шкафа во время работы должны быть опущены до 18-20 см от его рабочей поверхности. 5. Измельчение твердых веществ, дающих едкую пыль (щелочей, извести, йода и др.), разбавление концентрированных кислот и щелочей, приготовление хромовой смеси и т.п. нужно проводить в фарфоровой по суде также в вытяжном шкафу, защитив глаза очками, а руки перчатками. Разбавляя концентрированные кислоты, особенно серную, осторожно вливают кислоту в воду. 6. С легковоспламеняющимися жидкостями нельзя работать вблизи нагревательных приборов. Запрещается нагревать летучие легковоспламеняющиеся жидкости, вещества (эфиры, бензины, спирты, ацетон и т.д.) на открытом пламени. Для этого необходимо использовать водяную или масляную баню. 7. Обращение со спиртовкой. Перед использованием спиртовка должна быть заправлена этанолом (не более 2/3 объема спиртовки), диск плотно прикрывает отверстие резервуара спиртовки, фитиль в трубке должен входить не слишком плотно, но и не выпадать из трубки. Неиспользуемая спиртовка должна быть закрыта колпачком. Спиртовку зажигают только от горящей спички или лучинки. Нельзя зажигать ее от другой спиртовки или от зажигалки. Никогда не следует дуть на горящую спиртовку. Тушат ее, накрыв колпачком. Регулировка пламени производится выдвижением (увеличение пламени) или убиранием фитиля (уменьшение пламени). Нагревание на спиртовке производят следующим образом: сначала прогревают пробирку с содержимым в течение 15–20 секунд, затем приступают непосредственно к нагреванию содержимого пробирки. При нагревании нельзя прикасаться дном пробирки к фитилю. На спиртовке можно нагревать только посуду из тонкого (химического) стекла. 8. Пробирки при нагревании закрепляют либо в штативной лапке, либо в пробиркодержателе ближе к отверстию. Отверстие пробирки необходимо направлять от себя и окружающих, во избежание выброса веществ из пробирки. 9. Знакомясь с запахом вещества, нельзя наклоняться над сосудом с жидкостью и вдыхать полной грудью. Для этого нужно направить рукой струю воздуха от отверстия сосуда к себе и сделать носом легкий вдох. 10. Запрещается набирать ртом при помощи пипетки или трубки любые вещества. Для этого следует пользоваться сифоном или резиновой грушей. 11. Особенно внимательно нужно проводить сборку установок из стекла. При этом нельзя зажимать стеклянные изделия в лапки штативов без соответствующей мягкой прокладки. Особенно осторожно обращайтесь с тонкостенной посудой, термометрами и холодильниками. 12. Нельзя нагревать закупоренные любые аппараты и сосуды, кроме тех, которые специально для этого предназначены. Нельзя нагревать жидкости в толстостенной и мерной посуде (она может лопнуть). 13. При приливании реактивов нельзя наклоняться над отверстием сосуда во избежание попадания брызг на лицо и одежду. При использовании пробиркодержателя необходимо зажимать пробирку ближе к открытому концу. Нельзя также наклоняться над нагреваемой жидкостью, так как ее может выбросить. Никогда не направляйте открытый конец пробирки к себе или в сторону вашего соседа. 14. В лаборатории запрещается пробовать на вкус реактивы, а также принимать пищу, пить и курить. 15. Щелочные металлы должны храниться под слоем керосина, толуола или ксилола, не содержащих следов воды. Нельзя работать с металлическим натрием поблизости от водопроводного крана. Приступая к работе, надо насухо вытереть стол и высушить посуду, в которой будет проводиться реакция с металлическим натрием. После окончания работы нельзя сразу мыть эту посуду водой, следует сначала уничтожить остатки натрия, растворяя их в спирте. Крупные остатки натрия или его обрезки следует поместить в отдельную банку с керосином (толуолом или ксилолом). 16. Категорически запрещается хранить бром в хрупкой посуде. Для этого применяют толстостенные склянки с притертыми пробками. Все работы с бромом следует проводить в хорошо вентилируемом вытяжном шкафу, в резиновых перчатках и защитных очках. При попадании брома на кожу необходимо немедленно протереть пораженный участок спиртом, а затем смазать глицерином. 17. Нельзя класть на лабораторные столы посторонние предметы (сумки, шапки и др.), а также вешать в лаборатории верхнюю одежду. 18. О любом происшествии в лаборатории, даже самом незначительном, необходимо сообщить преподавателю или инженеру. 19. Не стесняйтесь спрашивать обо всем, в чем у вас есть сомнения!
Общая характеристика катионов четвертой аналитической группы Групповым реагентом на катионы 4-ой группы являются щелочи, при взаимодействии с которыми образуются осадки гидроксидов, растворимые в избытке реактива. Осадки растворяются в избытке реактива, т.к. ионы обладают амфотерными свойствами. Гидроксиды катионов также растворяются в кислотах, образуя соли катионов с анионами кислот. Катионы алюминия и цинка в растворах имеют постоянную ст. окисления, остальные переменную и в зависимости от нее проявляют свойства окислителей или восстановителей. Применение в медицине и фармации солей катионов 4-ой аналитической группы Сульфат цинка применяют как антисептическое и вяжущее средство в виде глазных капель при конъюнктивитах, в виде растворов для смазывания и спринцеваний при заболеваниях горла, мочеполовых путей. Оксид цинка входит в состав присыпок, мазей, паст, используемых для лечения кожных заболеваний, т.к. оказывает вяжущее, подсушивающее и дезинфицирующее действие. Гидроксид алюминия находит применение внутрь при гиперацидных гастритах, язве желудка, двенадцатиперстной кишки – как антацидное средство: при отравлениях – как адсорбирующее средство; как наружное средство в присыпках, обладающее обволакивающими свойствами. Входит в состав препарата «Альмагель», применяемого при заболеваниях жкт. Силикат алюминия входит в состав белой глины, применяемой в виде присыпок, паст и мазей. Квасцы (сульфат калия-алюминия) в растворах применяют наружно, как вяжущее антисептическое и противовоспалительное средство; в виде карандашей – как кровоосстанавливающее средство и для прижиганий. Гидроарсенит натрия, арсенит калия и оксид мышьяка (3) применяют при малокровии, истощении, неврастении как общеукрепляющее, тонизирующее средство, стимулирующее кроветворение. Арсенат натрия применяют в виде инъекций, арсенит калия – внутрь в каплях, оксид мышьяка(3) – внутрь в пилюлях. Оксид мышьяка (3) – используется в зубоврачебной практике как некротизирующее средство. Все препараты мышьяка – ядовиты.
Один из разделов количественного титриметрического (объемного) анализа целиком основан на применении окислительно-восстановительных реакций. Это — окислительно-восстановительное титрование (окси-диметрия, редокс-метрия). К наиболее распространенным методам ре-докс-метрии относятся перманганатометрия, иодиметрия и иодометрии, хлориодометрия, иодатометрия, броматометрия, бромометрия, нитрито-метрия, дихроматометрия, цериметрия. Нее они являются фармакопейными и используются в анализе различных лекарственных веществ. Бромометрию часто применяют в органическом и фармацевтическом анализе. Бромометрическое определение фенолов предложено в 1876 г. В. Коппешааром. Бромометрическое определение обычно заканчивают иодометрическим определением с применением в качестве индикатора раствора крахмала. Мышьяк (III) бромом количественно окисляется до мышьяка (V), сурьма (III) —до сурьмы (V), железо (II) — до железа (III). Сернистая кислота, тиосульфат натрия и сероводород окисляются бромом до серной кислоты и ее солей. Основной реакцией броматометрии является При появлении в растворе бромид-ионов в присутствии бромат-иона и катионов водорода начинается реакция: В нейтральных растворах данная реакция не идёт. Выделяющийся элементный бром способен стехиометрически реагировать с органическими веществами без образования побочных продуктов. В связи с этим броматометрия используется в двух типах анализа:
Индикаторами в броматометрии служат азокрасители, например, метиловый оранжевый или метиловый красный,необратимо окисляющиеся бромат-ионами с образованием бесцветных продуктов. Также могут быть использованы некоторые индикаторы, способные обратимо изменять свой цвет, в частности, хинолиновый жёлтый, α-нафтофлавон, п-этоксихризоидин. Конец титрования определяют также по появлению бурой окраски выделяющегося брома, а также потенциометрическим или фотометрическим способом.
Гидролиз солей — это химическое взаимодействие ионов соли с ионами воды, приводящее к образованию слабого электролита - кислоты (или кислой соли), или основания (или основной соли). Слово «гидролиз» означает разложение водой («гидро» - вода, «лизис» — разложение). В зависимости от того какой ион соли вступает во взаимодействие с водой, различают три типа гидролиза:
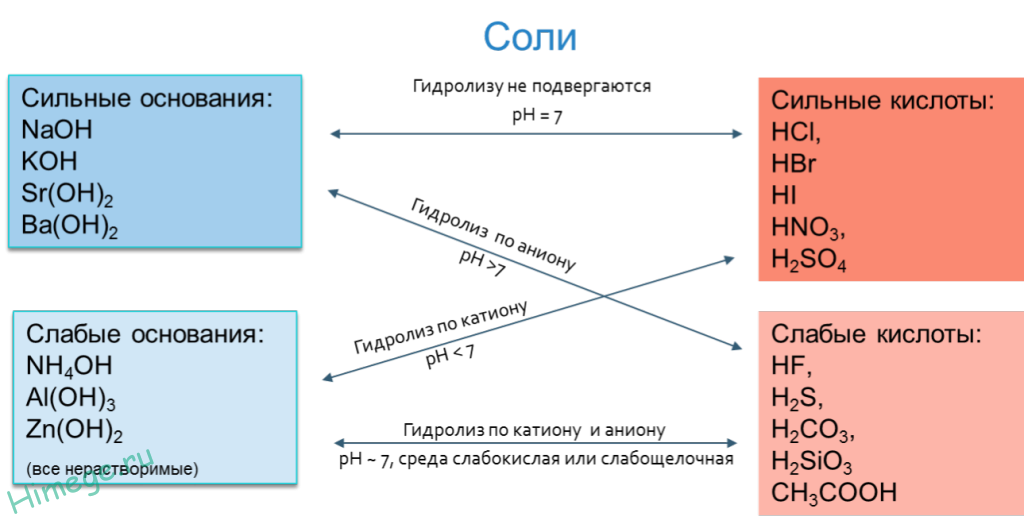 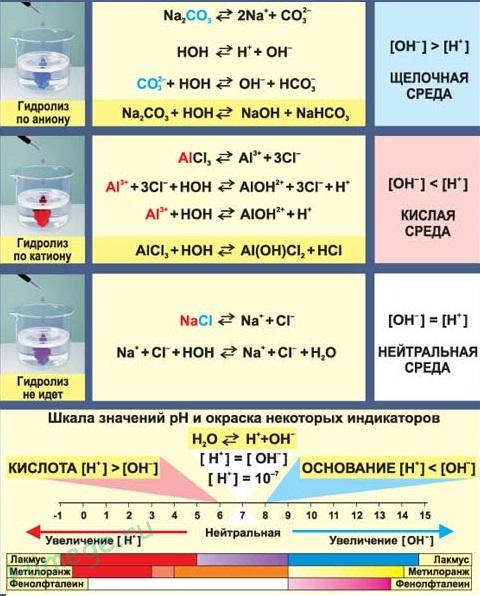 Гидролиз соли – взаимодействие ее ионов с водой, приводящее к появлению кислотной или щелочной среды, но не сопровождающееся образованием осадка или газа. Процесс гидролиза протекает только с участием растворимых солей и состоит из двух этапов: 1) диссоциация соли в растворе – необратимая реакция (степень диссоциации , или 100%); 2) собственно гидролиз, т.е. взаимодействие ионов соли с водой, — обратимая реакция (степень гидролиза ˂ 1, или 100%) Уравнения 1-го и 2-го этапов – первый из них необратим, второй обратим – складывать нельзя! Отметим, что соли, образованные катионами щелочей и анионами сильных кислот, гидролизу не подвергаются, они лишь диссоциируют при растворении в воде. В растворах солей KCl, NaNO3, NaSO4 и BaI среда нейтральная.
В перманганатометрии стандартным раствором является КМnО4. Сущность метода заключается в окислении восстановителей раствором перманганата калия. Окисление перманганатом калия можно проводить в кислой, нейтральной и щелочной среде. Но практически окисле ние проводят в сильнокислой среде, в которой перманганат-ион проявляет наиболее сильные окислительные свойства. Продуктом восстановления КМnО4 в кислой среде яв ляется почти бесцветный ион Мn2+: МnО4 + 8Н+ + 5ē → Мn2+ + 4Н2О Согласно закону эквивалентов молярная масса эквивалентов КМnО4 в кислой среде равна М/5. В нейтральной среде: MnO4- + 4H+ + 3 ē = MnO2 + 2 Н2О, тогда молярная масса эквивалентов КМnО4 равна М/3. В щелочной среде: MnO4- + ē = MnO42- Специального индикатора для титрования не требуется, так как ион МnО4 имеет хорошо заметную розовую окраску. Для создания сильнокислой среды пользуются раство рами H2SO4. Применение соляной и азотной кислот недо пустимо, поскольку соляная кислота, помимо кислотных свойств, проявляет и хорошо выраженные восстанови тельные свойства и сама способна реагировать с КМпО4 с выделением хлора. Азотная кислота, помимо кислотных свойств, проявляет окислительные свойства и может вза имодействовать с определяемыми восстановителями. Для определения восстановителей, как правило, ис пользуют методы прямого титрования, для определения окислителей — методы обратного титрования, а для опре деления индифферентных веществ — методы как обратно го, так и косвенного (заместительного) титрования. Приготовить стандартный раствор по точной навеске нельзя по ряду причин: 1. Перманганат калия КМnО4 содержит примеси. 2. При растворении в воде перманганат ка лия окисляет органические вещества, которые содержат ся в дистиллированной воде. 3. На устойчивость раствора КМnО4 влияет даже свет. Все эти факторы изменяют кон центрацию раствора КМnО4 и вследствие этого нельзя при готовить его первичный стандартный раствор. В этом случае сначала готовят раствор КМnО4 с концентрацией, прибли зительно равной требуемой (обычно 0,02 или 0,05 моль/л). Раствор оставляют на несколько дней до полного осаждения МnО2, хранят в темном месте в бутыли из темного стекла. После этого раствор КмnО4 берут для работы с по мощью сифона так, чтобы осадок МnО2 остался на дне бутылки. В качестве исходных веществ для установки точной концентрации рабочего раствора КМnО4 обычно применя ют оксалат аммония (NH4)2C2O4 • Н2О, оксалат натрия Na2C2O4 и щавелевую кислоту Н2С2О4 • 2Н2О. Наиболее удобным из этих веществ является оксалат натрия, так как он кристаллизуется без воды и не гигроскопичен.
Анионы второй аналитической группы: Cl-, Br-, I-, S 2— Большинство солей, образуемых анионами второй группы, растворимы в воде. Исключение составляют соли серебра, ртути и свинца. Групповой реактив на вторую группу анионов - нитрат серебра в присутствии азотной кислоты, который образует с анионами второй группы серебряные соли, не растворимые в воде и, в отличие от анионов первой группы, не растворимые в разбавленной азотной кислоте. Хлорид бария, групповой реактив анионов первой группы, анионы второй группы не осаждает. Все анионы второй группы бесцветны. Хлорид - ионы всегда присутствуют в почвах и в природных водах. Количество хлорид-ионов в питьевой воде не должно превышать 40мг на 1 литр. Многие хлориды используются в качестве удобрений: хлорид аммония и калия, сильвинит (KCI•NaCI) каинит (КСI•МgS04•ЗН2О). Хлорид натрия (поваренная соль) обязательный компонент рациона человека и животных, является активатором многих пищеварительных ферментов. Соляная кислота, содержащаяся в желудочном соке млекопитающих, участвует в процессе переваривания белков, активируя фермент пепсин. Хлориды бария и ртути (II) применяют как сельскохозяйственные яды. Иодид-ионы содержатся в питьевой воде и продуктах питания и играют огромную роль в процессах жизнедеятельности. Большое количество йода накапливается в щитовидной железе, секретирующей йодсодержащие гормоны. Бромиды используются в медицине как средства, успокаивающие центральную нервную систему. Сероводород образуется при разложении белковых соединений. Он очень ядовит, его вдыхание может вызвать потерю сознания и паралич дыхательного центра. Поэтому все работы с сероводородом проводятся под тягой. ОБЩАЯ ХАРАКТЕРИСТИКА АНИОНОВ II ГРУППЫ. ПРИМЕНЕНИЕ В МЕДИЦИНЕ. Ко второй группе анионов относятся анионы Cl-, Br-, I-, S2-, u SCN-. Эти анионы образуют с ионом серебра труднорастворимые в воде нерастворимые в разбавленной азотной кислоте соли. Групповым реактивом является AgNO3 в присутствии разбавленной азотной кислоты. В этих условиях AgNO3 не образует осадка с анионами первой группы. Бариевые соли анионов второй группы растворимы. Для организма большое значение имеют хлориды. Хлориды натрия и калия поддерживают осмотическое давление в клетках, участвуют в построение клеток. Хлориды определяют вкусовые качества воды. Иод участвует в образование гормонов щитовидной железы. Длительное употребление питьевой воды с избытком или отсутствием иодидов может служить причиной эндокринных заболеваний. Хлорид натрия, калия и кальция широко применяются как инъекционные растворы. Бромиды калия и натрия используются как успокаивающие средства. Иодиды калия и натрия применяются в составе микстур при заболеваний щитовидной железы и бронхиальной астме. Свободной иод применяется в растворах как антисептическое средство, а также при атеросклерозе и заболеваниях щитовидной железы. КАЧЕСТВЕННЫЕ РЕАКЦИИ
Общая характеристика катионов шестой аналитической группы Катионы 6-ой ан. группы осаждаются растворами гидроксида аммония, образуя осадки гидроксидов и основных солей. Осадки гидроксидов и основных солей растворяются в избытке раствора гидроксида аммония, образуя комплексные соли. Это свойство отличает катионы 6-ой группы. При взаимодействии катионов 6-ой гр. с едкими щелочами в осадок выпадают их гидроксиды или основные соли, растворимые в кислотах и нерастворимые в щелочах. Сероводород осаждает сульфиды катионов 6-группы – образуется осадок черного цвета. Сульфиды растворимы в минеральных кислотах. Карбонаты щелочных металлов осаждают карбонаты или основные карбонаты катионов 6-ой гр, растворимые в кислотах. Фосфаты осаждаются при взаимодействии с гидрофосфатом натрия и растворимы в кислотах. Катионы меди, кобальта и никеля в растворах окрашены соответственно в зеленый или синий, розовый и зеленый цвет. Применение в медицине и фармации солей катионов 6-ой аналитической группы Сульфат меди применяют внутрь в растворах как рвотное средство и при отравлении фосфором, наружно – как прижигающее и вяжущее средство в виде растворов и палочек. В малых дозах растворы применяют для лечения анемий. Цитрат меди назначают в виде мазей при глазных заболеваниях (трихоме, конъюнктивите). Дихлорид ртути или сулема, обладает выраженными антибактериальными свойствами и применяется для дезинфекции белья, одежды, стен и при лечении кожных заболеваний. Оксицианид ртути используется в растворах для промывания при лечении ряда глазных и урологических заболеваний. Дийодид ртути иногда применяют в виде микстур для лечения сифилиса. Хлорид меркураммония используют для приготовления антисептических и противовоспалительных мазей. Кобальт в виде комплексных соединений назначается для лечения заболеваний системы крови – анемий, для улучшения синтеза гемоглобина и усвоения железа.
Анионы третьей аналитической группы: NO3-, NO2- Соли анионов третьей аналитической группы, включая бариевые и серебряные, хорошо растворимы в воде. Поэтому группового реактива на анионы этой группы нет. Для открытия нитрат- и нитрит-ионов применяют не реакции осаждения, а окислительно-восстановительные реакции, в которых эти анионы выступают как активные окислители. Нитраты образуются в большом количестве в природе в результате нитрификации, т.е. процесса биологического превращения аммиака в окисленные неорганические соединения. Этот процесс происходит в почве и воде и осуществляется бактериями - нитрификаторами. Промежуточным продуктом химических реакций окисления аммиака являются нитриты, а конечным - нитраты. В результате этого нитраты всегда содержатся в природных водах. Предельно допустимое содержание нитратов в питьевой воде составляет 20 мг/л. Содержание нитритов в питьевой воде вообще не допустимо. Однако в результате применения больших количеств аммонийных удобрений происходит накопление и нитратов и нитритов в почвах, водах и продукции растениеводства. Кроме того, нитраты широко используются в консервной и мясоперерабатывающей промышленности в качестве добавок, сохраняющих цвет продукции. Токсическое действие нитратов и нитритов обусловлено блокадой железа в железосодержащих дыхательных ферментах, что приводит к острой гипоксии тканей и может закончиться летально. Поэтому овощи, фрукты, колбасы, копчености, консервы мясные и плодоовощные подлежат обязательному анализу на содержание нитратов и нитритов. К третьей аналитической группе анионов относятся нитрит – ион NO2-, нитрат – ион NO3- и ацетат – ион CH3COO-. Серебряные и бариевые соли этих анионов растворимы в воде, вследствие чего ни AgNO3 ни BaCl2 не осаждают анионы третьей группы. Группового реактива у этой группы нет. Определение нитратов и нитритов имеет большое значение для исследования питьевой воды. Наличие большого количества нитратов и нитритов является показателем загрязнения и непригодности воды для питья. Органические производные азотной кислоты (например, нитроглицерин) используют как сердечные средства. Нитрит натрия и некоторые производные азотистой кислоты применяют при стенокардии. Некоторые соли уксусной кислоты входят в состав различных лекарственных препаратов. КАЧЕСТВЕННЫЕ РЕАКЦИИ
|