Ответы по аналитике. Основные положения качественного анализа
 Скачать 0.71 Mb. Скачать 0.71 Mb.
|
Определение конца реакцииПри титровании употребляют не избыток реактива, а количество его, эквивалентное количеству определяемо го вещества. Ясно, что необходимым условием является точное установление того момента, когда заканчивается реакция между титруемым веществом и рабочим рас твором, то есть фиксирование точки эквивалентности. Чем точнее определяется конец реакции, тем точнее бу дет результат анализа. Для определения конца реакции применяют особые реактивы, так называемые индикаторы. Действие инди каторов в большинстве случаев сводится к тому, что они по окончании реакции между титруемым веществом и рабочим раствором в присутствии небольшого избытка последнего претерпевают изменения и меняют окраску раствора или осадка. Когда из бюретки прибавлено столько рабочего раствора, что наблюдается заметное изменение окраски титруемого раствора, говорят, что достигнута точка конца титрования. Она может точно не совпадать с точкой эквивалентности. Но так как оп ределение титра рабочего раствора проводят с тем же индикатором и в тех же условиях, что и сам анализ, не совпадение точки конца титрования с точкой эквива лентности практически не отражается на точности опре деления. Если изменение окраски индикатора в конечной точке происходит между близкими, трудно воспринима емыми человеческим глазом переходами (например, желтый — оранжевый — розовый и наоборот), рекомен дуется применение раствора — «свидетеля». Этот рас твор должен иметь примерно такой же объем и состав, что и анализируемый раствор в конце титрования. Ко личество индикатора, прибавленное в обоих случаях, должно быть также одинаковым. Имея такой «свиде тель» рядом с титруемым раствором, легко определить при титровании момент, когда окраска обоих растворов сравняется. В большинстве случаев индикаторы прибавляют к раствору исследуемого вещества и титрование происхо дит в присутствии индикатора. Это так называемые внутренние индикаторы. В некоторых случаях поступа ют иначе: по мере титрования от титруемого раствора отбирают капилляром по капле раствора, к которому на фарфоровой пластинке прибавляют каплю индикатора. Таким образом, реакция с индикатором происходит вне титруемого раствора. Применяемые в этом случае индикаторы называются внешними. Для каждого титриметрического метода имеются отдельные индикаторы. В методах нейтрализации индикаторы меняют свою окраску гари изменении рН раствора. В методах осаждения точку эквивалентности находят по прекращению образования осадка. Индикаторы, применяемые в этих методах, образуют ярко окрашенный осадок или раствор с минимальным избытком рабочего раствора. Иногда, если титруют ярко окрашенным раствором (например, раствор КМп04), окончание титрования можно заметить без индикатора, так как первая капля рабочего раствора, которая не прореагирует с определяемым веществом, изменяет окраску титруемого раствора
Метод кислотно-основного титрования(метод нейтрализации) – предназначен для определения концентрации кислот, оснований, солей и основан на реакции нейтрализации Н+ + ОН- ↔ Н2О. Реакции кислотно-основного взаимодействия являются реакциями передачи протона от титранта к определяемому веществу или наоборот; характеризуются высокой скоростью и протекают строго стехиометрически. Так как реакция нейтрализации не сопровождается изменением окраски раствора, точку эквивалентности определяют с помощью индикатора. Но обычно индикаторы меняют окраску не строго в точке эквивалентности, а с некоторым отклонением от неё. Другими словами, конечная точка титрования, (момент, в который происходит изменение окраски индикатора) не совпадает с точкой эквивалентности, а только более или менее соответствует ей. Поэтому даже при правильном выборе индикатора допускается погрешность – так называемая индикаторная ошибка титрования. Неправильный же выбор индикатора может вообще исказить результаты титрования. Индикаторы, применяемые в кислотно-основном титровании: кислотно-основные индикаторы, например, метиловый оранжевый, фенолфталеини др. Титранты кислотно-основного титрования: растворы сильных кислот при определении концентрации оснований, растворы щелочей при определении концентрации кислот. Стандартные вещества: карбонат натрия Na2CO3, тетраборат натрия Na2B4O7?10H2O для установления титра или нормальной концентрации (стандартизации) кислот. Щавелевая кислота Н2С2О4 ·2Н2О – для стандартизации щелочей. Определяемые вещества: сильные и слабые кислоты; сильные и слабые основания; соли, подвергающиеся гидролизу. Виды кислотно-основного титрования: - титрование сильной кислоты сильным основанием или наоборот; - титрование слабой кислоты сильным основанием; - титрование слабого основания сильной кислотой. Для правильного титрования, и, следовательно, получения верных результатов, необходимо правильно подобрать индикатор. Для этого следует знать: - теорию индикаторов; - как меняется рНраствора в колбе в ходе титрования, каково значение рН в точке эквивалентности и вблизи неё? Для ответа на эти вопросы строят кривые титрования. Кривая титрования – это график зависимости рН среды в колбе от объема добавленного титранта. Кривая титрования характеризуется точкой эквивалентности, точкой нейтральности, скачком титрования, линией нейтральности. Линия нейтральности – прямая, параллельная оси абсцисс и пересекающая ось ординат при рН = 7. Точка нейтральности – точка пересечения кривой титрования с линией нейтральности. Скачок титрования – участок резкого изменения рН.
Ко́мплексные соединения (лат. complexus — сочетание, обхват) или координационные соединения (лат. co — «вместе» и ordinatio — «упорядочение») — это соединения (нейтральные молекулы или ионы), которые образуются в результате присоединения к данному иону (или атому), называемому комплексообразователем, нейтральных молекул или других ионов, называемых лигандами. Теория комплексных соединений (координационная теория) была предложена в 1893 г. А. Вернером. Комплексные соединения, имеющие внешнюю сферу, в водном растворе полностью диссоцируют на комплексный малодиссоциирующий катион или анион. Комплексные соединения без внешней сферы в воде нерастворимы (например, карбонилы металлов). Комплексные соединения разнообразны и многочисленны. Комплексное соединение — химическое вещество, в состав которого входят комплексные частицы. В настоящее время строгого определения понятия «комплексная частица» нет. Обычно используется следующее определение. Комплексная частица — сложная частица, способная к самостоятельному существованию в кристалле или растворе, образованная из других, более простых частиц, также способных к самостоятельному существованию. Иногда комплексными частицами называют сложные химические частицы, все или часть связей в которых образованы по донорно-акцепторному механизму. Комплексообразователь — центральный атом комплексной частицы. Обычно комплексообразователь — атом элемента, образующего металл, но это может быть и атом кислорода, азота, серы, иода и других элементов, образующих неметаллы. Комплексообразователь обычно положительно заряжен и в таком случае именуется в современной научной литературе металлоцентром; заряд комплексообразователя может быть также отрицательным или равным нулю. Лиганды (Адденды) — атомы или изолированные группы атомов, располагающиеся вокруг комплексообразователя. Лигандами могут быть частицы, до образования комплексного соединения представлявшие собой молекулы (H2O, CO, NH3 и др.), анионы (OH−, Cl−, PO43− и др.), а также катион водорода H+. Внутренняя сфера комплексного соединения — центральный атом со связанными с ним лигандами, то есть, собственно, комплексная частица. Внешняя сфера комплексного соединения — остальные частицы, связанные с комплексной частицей ионной или межмолекулярными связями, включая водородные. Дентатность лиганда определяется числом координационных мест, занимаемых лигандом в координационной сфере комплексообразователя. Различают монодентатные (унидентатные) лиганды, связанные с центральным атомом через один из своих атомов, то есть одной ковалентной связью, бидентатные (связанные с центральным атомом через два своих атома, то есть, двумя связями), три- , тетрадентатные и т. д. Координационный полиэдр — воображаемый молекулярный многогранник, в центре которого расположен атом-комплексообразователь, а в вершинах — частицы лигандов, непосредственно связанные с центральным атомом. Координационное число (КЧ) — число связей, образуемых центральным атомом с лигандами. Для комплексных соединений с монодентантными лигандами КЧ равно числу лигандов, а в случае полидентантных лигандов — числу таких лигандов, умноженному на дентатность.
Нитритометрия — метод количественного анализа ароматических аминов, основанный на их титровании нитритом натрия. Метод основан на реакции первичных аминов с азотистой кислотой с образованием диазосоединений: 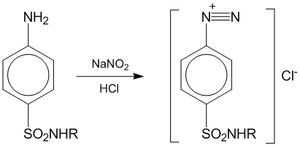 Титрантом является раствор нитрита натрия. Катализатором служит раствор бромида калия, облегчающий процесс диазотирования. Точка эквивалентности определяется при помощи индикаторов — тропеолина 00 (переход от красного цвета раствора к жёлтому), нейтрального красного (переход от красно-фиолетового цвета к синему), иодкрахмальная бумага, а также потенциометрически (с платиновым электродом в качестве индикаторного электрода, хлорсеребряного или каломельного в качестве электрода сравнения). Титрование проводят при пониженной температуре, чтобы избежать разложения азотистой кислоты и соли диазония. Для титрования обычно используют 0,1М раствор нитрита натрия. Навеску препарата (например, лекарственного средства класса сульфаниламидов) растворяют в 10 мл воды, прибавляют 10 мл 8,3%-го раствора соляной кислоты, 1 г KBr. Титрование ведут при температуре 15-20°С или 0-5°С до изменения цвета индикатора. Одновременно проводится контрольный опыт. Нитритометрия используется для количественного анализа соединений с первичной или вторичной ароматической аминогруппой, гидразидов и ароматических нитросоединений после восстановления их нитрогруппы до аминогруппы. Применяется для количественного определения соединений, содержащих первичную или вторичную ароматическую аминогруппу, для определения гидразидов, а также ароматических нитросоединений после предварительного восстановления нитрогруппы до аминогруппы. Методика. Если не указано иначе, точную навеску образца лекарственного средства, указанную в фармакопейной статье, растворяют в смеси 10 мл воды и 10 мл хлористоводородной кислоты разведенной 8,3 %. Прибавляют воду до общего объема 80 мл, 1 г калия бромида и при постоянном перемешивании титруют натрия нитрита раствором 0,1 М. В начале титрования прибавляют раствор натрия нитрита со скоростью 2 мл/мин, а в конце (за 0,5 мл до эквивалентного количества) – 0,05 мл/мин. При потенциометрическом титровании в качестве индикаторного применяют платиновый электрод, в качестве электродов сравнения используют хлорсеребряный или насыщенный каломельный электрод. При амперометрическом титровании на электроды накладывают разность потенциалов 0,3 — 0,4В, если не указано иначе в фармакопейной статье. Точку эквивалентности определяют электрометрическими методами (потенциометрическое титрование, титрование «до полного прекращения тока») или с помощью внутренних индикаторов и внешнего индикатора (йодкрахмальная бумага). В качестве внутренних индикаторов используют тропеолин ОО (4 капли раствора), тропеолин ОО в смеси с метиленовым синим (4 капли раствора тропеолина ОО и две капли раствора метиленового синего), нейтральный красный (две капли в начале и две капли в конце титрования). Титрование с тропеолином ОО проводят до перехода окраски от красной к желтой, со смесью тропеолина ОО с метиленовым синим – от красно-фиолетовой к голубой, с нейтральным красным – от красно-фиолетовой к синей. Выдержку в конце титрования с нейтральным красным увеличивают до 2 мин. Титрование с йодкрахмальной бумагой ведут до тех пор, пока капля титруемого раствора, взятая через 1 мин после прибавления натрия нитрита раствора 0,1 М, не будет немедленно вызывать синее окрашивание на бумаге. В некоторых случаях выдержка может быть увеличена, о чем должно быть указано в фармакопейной статье. Параллельно проводят контрольный опыт. |
