шпоры по бх-последняя итоговая. Основные системы межклеточной коммуникации эндокринная, паракринная, аутокринная регуляция
 Скачать 0.64 Mb. Скачать 0.64 Mb.
|
феохромоцитома, опухоль, образованная хромаффинными клетками и продуцирующая катехоламины. Клинически феохромоцитома проявляется повторяющимися приступами головной боли, сердцебиения, потливости, повышением АД и сопровождается характерными изменениями метаболизма.Гормоны поджелудочной железы и желудочно-кишечного тракта. Строение синтез и секреция инсулина. Биологические функции и механизм действия инсулина. Строение и биологическая роль глюкагона. Поджелудочная железа выполняет в организме две важнейшие функции: экзокринную и эндокринную. Экзокринная функция обеспечивает синтез и секрецию ферментов и ионов, необходимых для процессов пищеварения. Эндокринную функцию выполняют клетки островкового аппарата поджелудочной железы, которые секретируют гормоны, участвующие в регуляции многих процессов в организме. В островковой части поджелудочной железы (островки Лангерханса) выделяют 4 типа клеток, секретирующих разные гормоны: А- (или α-) клетки секретируют глюкагон, В- (или β-) - инсулин, D- (или δ-) - соматостатин, F-клетки секретируют панкреатический полипептид. Инсулин - полипептид, состоящий из двух полипептидных цепей. Цепь А содержит 21 аминокислотный остаток, цепь В - 30 аминокислотных остатков. Обе цепи соединены между собой двумя дисульфидными мостиками. Инсулин может существовать в нескольких формах: мономера, димера и гексамера. Гексамерная структура инсулина стабилизируется ионами цинка, который связывается остатками Гис в положении 10 В-цепи всех 6 субъединиц. 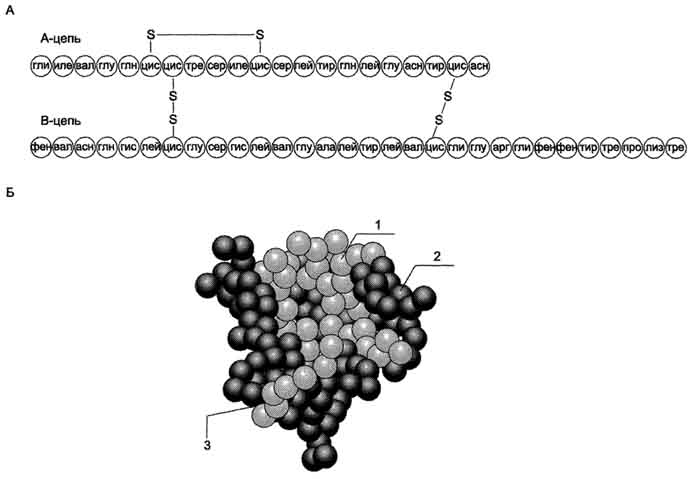 Биосинтез инсулина 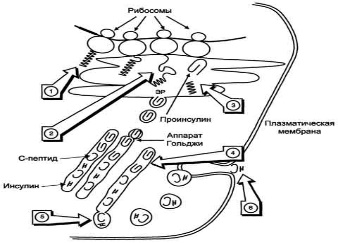 Разрушение инсулина происходит под действием фермента инсулиназы в основном в печени и в меньшей степени в почках. Инсулин - главный анаболический гормон. Он участвует в регуляции метаболизма, транспорта глюкозы, аминокислот, ионов, в синтезе белков. Инсулин влияет также на процессы репликации и транскрипции, участвуя таким образом в регуляции клеточной дифференцировки, пролиферации и трансформации клеток. Транспорт глюкозы в клетки происходит при участии специальных белков-переносчиков.Переносчик, регулируемый инсулином (ГЛЮТ-4), содержится только в мышцах и жировой ткани (инсулинзависимые ткани). В отсутствие инсулина ГЛЮТ-4 находятся в цитозольных везикулах. Под влиянием инсулина происходит транслокация везикул в плазматическую мембрану; при снижении концентрации гормона глюкотранспортёры возвращаются в цитозоль, и транспорт глюкозы прекращается. Влияние инсулина на метаболизм глюкозы. стимулирует утилизацию глюкозы в клетках разными путями, снижение концентрации глюкозы в крови. В печени и жировой ткани инсулин стимулирует синтез жиров, обеспечивая получение для этого процесса необходимых субстратов (ацетил-КоА, α-глицерофосфат и NADPH) из глюкозы. под влиянием инсулина снижается концентрация жирных кислот, циркулирующих в крови. Инсулин стимулирует потребление нейтральных аминокислот в мышцах и синтез белков в печени, мышцах и сердце. Действие инсулина начинается с его связывания со специфическим гликопротеиновым рецептором на поверхности клетки-мишени. Рецепторы инсулина обнаружены почти во всех типах клеток, но больше всего их в гепатоцитах и клетках жировой ткани. Так как концентрация инсулина в крови составляет 10-10 М, количество рецепторов, связанных с инсулином, зависит от их количества на мембране клетки. Клетки с разным содержанием рецепторов реагируют по разному на одну и ту же концентрацию гормона. Глюкагон - одноцепочечный полипептид, состоящий из 29 аминокислотных остатков. Биосинтез глюкагона происходит в α-клеткахьостровков Лангерханса, в нейроэндокринных клетках кишечника и в некоторых отделах ЦНС. Неактивный предшественник проглюкагон в результате частичного протеолиза превращается в несколько пептидов. В клетках поджелудочной железы главный пептид - глюкагон; в клетках кишечника образуются глюкагонопо-добные пептиды: GLP-1, GLP-2, глицентин и другие. GLP-1 ингибирует секрецию глюкагона и стимулирует синтез и секрецию инсулина. Стимулятором секреции GLP-1 служит другой гормон - желудочный ингибирующий полипептид, который синтезируется в клетках слизистой оболочки верхних отделов тонкого кишечника. Секреция GIP стимулируется при приёме пищи; наиболее сильным стимулятором служит глюкоза. На секрецию глюкагона влияют и многие другие соединения, включая аминокислоты, жирные кислоты, кетоновые тела и нейромедиаторы. При приёме пищи, богатой углеводами, секреция глюкагона снижается. Белковая пища стимулирует секрецию инсулина и глюкагона; однако некоторые аминокислоты в большей степени влияют на секрецию одного из них. Эффекты глюкагона в основном противоположны эффектам инсулина. Основные клетки-мишени глюкагона - печень и жировая ткань. Связываясь с рецепторами на плазматической мембране клеток-мишеней, глюкагон повышает содержание цАМФ. В гепатоцитах это приводит к активации фосфорилазы гликогена и к снижению активности гликогенсинтазы. В результате ускоряется мобилизация гликогена. В клетках жировой ткани глюкагон через аденилатциклазный каскад активирует гормончувствительную ТАГ-липазу и стимулирует липолиз. Таким образом, в противоположность инсулину глюкагон стимулирует мобилизацию основных энергоносителей - углеводов и жиров. | Регуляция обмена основных энергоносителей. Изменения метаболизма в абсорбтивный и постабсорбтивный периоды. Изменения гормонального статуса и метаболизма при голодании. Основные пищевые вещества (углеводы, жиры, белки) окисляются в организме с освобождением свободной энергии, которая используется в анаболических процессах и при осуществлении физиологических функций. Энергетическая ценность основных пищевых веществ выражается в килокалориях и составляет: для углеводов - 4 ккал/г, для жиров - 9 ккал/г, для белков - 4 ккал/г. Взрослому здоровому человеку в сутки требуется 2000-3000ккал(8000-12000 кДж) энергии.При обычном ритме питания промежутки между приёмами пищи составляют 4-5ч с8-12-часовымночным перерывом. Во время пищеварения и абсорбтивного периода(2-4ч) основные энергоносители, используемые тканями (глюкоза, жирные кислоты, аминокислоты), могут поступать непосредственно из пищеварительного тракта. В постабсорбтивном периоде и при голодании энергетические субстраты образуются в процессе катаболизма депонированных энергоносителей.Основную роль в поддержании энергетического гомеостаза играют гормоны инсулин и глюкагон. а также другие контринсулярные гормоны - адреналин, кортизол, йодтиронины и соматотропин. Инсулин и глюкагон играют главную роль в регуляции метаболизма при смене абсорбтивного и постабсорбтивного периодов и при голодании. Абсорбтивный период характеризуется временным повышением концентрации глюкозы, аминокислот и жиров в плазме крови. Клетки поджелудочной железы отвечают на это повышение усилением секреции инсулина и снижением секреции глюкагона. Увеличение отношения инсулин/глюкагон вызывает ускорение использования метаболитов для запасания энергоносителей: происходит синтез гликогена, жиров и белков. Режим запасания включается после приёма пищи и сменяется режимом мобилизации запасов после завершения пищеварения. Тип метаболитов, которые потребляются, депонируются и экспортируются, зависит от типа ткани. Главные органы, связанные с изменениями потока метаболитов при смене режимов мобилизации и запасания энергоносителей, - печень, жировая ткань и мышцы. 1. Изменения метаболизма в печени в абсорбтивном периоде После приёма пищи печень становится главным потребителем глюкозы, поступающей из пищеварительного тракта. Излишек аминокислот либо поступает в кровь и транспортируется в другие ткани, либо дезаминируется с последующим включением безазотистых остатков в общий путь катаболизма . 2. Изменения метаболизма в адипоцитах Основная функция жировой ткани - запасание энергоносителей в форме триацилгли-церолов.Под влиянием инсулина ускоряется транспорт глюкозы в адипоциты 3. Изменение метаболизма в мышцах в абсорбтивном периоде В абсорбтивном периоде под влиянием инсулина ускоряется транспорт глюкозы в клетки мышечной ткани. Постабсорбтивным состоянием называют период после завершения пищеварения до следующего приёма пищи. Если пища не принимается в течение суток и более, то это состояние определяют как голодание. Типичным постабсорбтивным периодом считают состояние после 12-часовогоночного перерыва в приёме пищи. В начале постабсорбтивного периода концентрация глюкозы в крови снижается, вследствие чего снижается секреция инсулина и повышается концентрация глюкагона. При снижении индекса инсулин/глюкагон ускоряются процессы мобилизации депонированных энергоносителей. 1.Изменения метаболизма в печени Впечени прежде всего ускоряется мобилизация гликогена. Однако запасы гликогена в печени истощаются в течение 18-24ч голодания. Главным источником глюкозы по мере исчерпания запасов гликогена становится глюконеогенез, который начинает ускоряться через4-6ч после последнего приёма пищи. 2.Изменения метаболизма в жировой ткани Вжировой ткани при повышении концентрации глюкагона снижается скорость синтеза ТАГ и стимулируется липолиз В. Изменение гормонального статуса и метаболизма при голодании Голодание может быть кратковременным, в течение суток (I фаза), продолжаться в течение недели (II фаза) или нескольких недель (III фаза).В отсутствие пищи в крови снижается уровень глюкозы, аминокислот и триацилглицеролов. Инсулинглюкагоновый индекс снижается, и повышается концентрация контринсулярных гормонов, в первую очередь кортизола. В этих условиях возникает состояние, для которого характерно преобладание процессов катаболизма жиров, гликогена и белков на фоне общего снижения скорости метаболизма. Под влиянием контринсулярных гормонов в этот период происходит обмен субстратами между печенью, жировой тканью, мышцами и мозгом. Этот обмен служит двум целям: 1) поддержанию концентрации глюкозы в крови для обеспечения глюкозозависимых тканей (мозга, эритроцитов); 2) мобилизации других источников энергии, в первую очередь жиров, для обеспечения энергией всех других тканей. Вследствие переключения метаболизма на режим мобилизации энергоносителей даже после 5-6нед голодания концентрация глюкозы в крови составляет не менее 60 мг/дл. 1. Обмен углеводов Так как за счёт мобилизации гликогена обеспечивается только кратковременное голодание, основным источником глюкозы при длительном голодании служит глюконеогенез, а основными субстратами глюконеогенеза - аминокислоты, лактат и глицерол. 2. Обмен жиров Жирные кислоты, образующиеся в процессе мобилизации жиров в жировых депо, становятся основными источниками энергии для большинства органов в первый период голодания. Во II фазе мобилизация жиров продолжается, и концентрация жирных кислот в крови увеличивается в 3-4раза по сравнению с постабсорбтивным состоянием. 3.Обмен белков Втечение нескольких первых дней голодания быстро распадаются мышечные белки - основной источник субстратов для глюконеогенеза. При голодании более 3 нед скорость катаболизма белков стабилизируется и составляет примерно 20 г в сутки. В этот период увеличивается потребление мозгом кетоновых тел, а скорость глюконеогенеза снижается. Снижение скорости глюконеогенеза способствует сбережению белков. В этот период и для мозга кетоновые тела становятся значительным источником энергии. Однако для окисления кетоновых тел необходимы оксало-ацетати другие компоненты ЦТК. При продолжительности голодания более 4недель развиваются атрофические процессы, в результате которых происходит потеря значительного количества белков. В теле человека массой 70 кг масса белков составляет 15 кг. При потере 1/3-1/2белков наступает смерть | Изменения гормонального статуса и метаболизма при сахарном диабете. Сахарный диабет - заболевание, возникающее вследствие абсолютного или относительного дефицита инсулина. А. Основные клинические формы сахарного диабета диабет I типа - инсулинзависимый (ИЗСД), и диабет II типа - инсулиннезависимый (ИНСД). 1.Инсулинзависимый сахарный диабет - заболевание, вызываемое разрушением р-клетокостровков Лангерханса поджелудочной железы. Деструкция β-клеток- результат аутоиммунных реакций. В аутоиммунной реакции принимают участие лимфоциты и макрофаги (моноциты). Эти клетки продуцируют цитокины, которые либо непосредственно повреждаютβ-клетки,либо опосредуют клеточные реакции противβ-клеток. Провоцировать возникновение диабета I типа может вирусная инфекция, вызывающая деструкцию b-клеток.К таким вирусам, называемымβ-цитотропными,относят вирусы оспы, краснухи, кори, цитомегаловирус, эпидемического паротита, Коксаки, аденовирус. Некоторыер-цитотропныевирусы вызывают лизисβ-клеток. 2. Инсулинонезависимый сахарный диабет Инсулинонезависимый сахарный диабет - общее название нескольких заболеваний, развивающихся в результате относительного дефицита инсулина, возникающего вследствие нарушения секреции инсулина, нарушения превращения проинсулина в инсулин, повышения скорости катаболизма инсулина, а также повреждения механизмов передачи инсулинового сигнала в клетки-мишени(например, дефекта рецептора инсулина, повреждения внутриклеточных посредников инсулинового сигнала и др Возможными причинами ИНСД могут быть: образование антител к рецепторам инсулина; генетический дефект пострецепторного аппарата инсулинзависимых тканей; нарушения регуляции секреции инсулина. К факторам, определяющим развитие и клиническое течение болезни, относят ожирение, неправильный режим питания, малоподвижный образ жизни, стресс. Б. Изменения метаболизма при сазарном диабете При сахарном диабете, как правило, соотношение инсулин/глюкагон снижено. При этом ослабевает стимуляция процессов депонирования гликогена и жиров, и усиливается мобилизация запасов энергоносителей. Печень, мышцы и жировая ткань даже после приёма пищи функционируют в режиме постабсорбтивного состояния. 1. Симптомы сахарного диабета Для всех форм диабета характерно повышение концентрации глюкозы в крови - гипергликемия. После приёма пищи концентрация глюкозы может достигать 300-500мг/дл и сохраняется на высоком уровне в постабсорбтивном периоде, т.е. снижается толерантность к глюкозе. Снижение толерантности к глюкозе наблюдают в случаях скрытой (латентной) формы, характерные для сахарного диабета, а концентрация глюкозы в крови натощак соответствует норме. Однако использование провокационных проб (например, сахарной нагрузки) выявляет снижение толерантности к глюкозе. При дефиците инсулина уменьшается количество белков-переносчиковглюкозы(ГЛЮТ-4)на мембранах инсулинзависимых клеток (жировой ткани и мышц). В мышцах и печени глюкоза не депонируется в виде гликогена, в жировой ткани уменьшается скорость синтеза и депонирования жиров. Кроме того, при снижении инсулинглюкагонового индекса активируется глюконеогенез из аминокислот, глицерола и лактата. Повышение концентрации глюкозы в крови при сахарном диабете превышает концентрационный почечный порог, что становится причиной выделения глюкозы с мочой (глюкозурия). В норме проксимальные канальцы почек реабсорбируют всю фильтрующуюся в клубочках глюкозу, если её уровень не превышает 8,9 ммоль/л (160 мг/дл).К характерным признакам сахарного диабета относят также повышение концентрации в крови кетоновых тел - кетонемия. При низком соотношении инсулин/глюкагон жиры не депонируются, а ускоряется их катаболизм, так как гормончувствительная липаза в жировой ткани находится в фосфорилированной активной форме Ещё один характерный признак сахарного диабета - повышенный уровень в крови ли-попротеинов(в основном, ЛПОНП) -гипер-липопротеинемия.Пищевые жиры не депонируются в жировой ткани вследствие ослабления процессов запасания, а поступают в печень, где частично превращаются в триацилглицеролы, которые транспортируются из печени в составе ЛПОНП. При сахарном диабете дефицит инсулина приводит к снижению скорости синтеза белков в организме и усилению распада белков. Это вызывает повышение концентрации аминокислот в крови. Аминокислоты поступают в печень и дезаминируются. Высокие концентрации глюкозы, кетоновых тел, мочевины требуют усиленной экскреции их из организма. Поскольку концентрационная способность почек ограничена, резко увеличивается выделение большого количества воды, в результате чего может наступить обезвоживание организма. Выделение мочи у больных возрастает в несколько раз и в некоторых случаях достигает 8-9л в сутки, но чаще не превышает3-4л - полиурия. Потеря воды вызывает постоянную жажду - полидипсия. | Мужские и женские половые гормоны. Химическая природа. Биологическая роль. Репродуктивные функции организма регулируются половыми гормонами: у мужчин - тестостероном, у женщин - эстрогенами и прогестинами. Синтез и секреция половых гормонов, в свою очередь, находятся под контролем фол-ликулостимулирующегои лютеинизирующего гормонов. Мужские половые гормоны вырабатываются в основном в мужских половых железах - в интерстициальных клетках Лейдига семенников (95%). Небольшое количество андрогенов образуется в коре надпочечников. К мишеням тестостерона относят эмбриональные вольфовы структуры, сперматогонии, мышцы, кости, почки, мозг. Подобно другим стероидным гормонам, андрогены образуют внутри клетки комплекс с рецептором, который связывается с определённым участком хроматина, активируя специфические гены, белковые продукты которых опосредуют биологические эффекты андрогенов. Физиологическое действие андрогенов различно в разные периоды жизни организма. У эмбриона под действием андрогенов из вольфова протока образуются придаток яичка (эпидидимис), семявыносящий проток и семенной пузырёк. У плода мужского пола происходит маскулинизация мозга. Поскольку андрогены в организме обладают мощным анаболическим действием и стимулируют клеточное деление, повышенный уровень андрогенов в препубертатный период приводит к скачкообразному увеличению линейных размеров тела, увеличению скелетных мышц, росту костей, но одновременно способствуют и остановке роста, так как стимулируют сращение эпифизов длинных костей с их стволами. Андрогены вызывают изменение структуры кожи и волос, снижение тембра голоса вследствие утолщения голосовых связок и увеличения объёма гортани, стимулируют секрецию сальных желёз. Эстрогены связываются с внутриклеточными рецепторами и, подобно другим стероидным гормонам, регулируют транскрипцию структурных генов. Предполагается, что эстрогены индуцируют синтез свыше 50 различных белков, участвующих в проявлении физиологических эффектов эстрогенов. Эстрогены стимулируют развитие тканей, участвующих в размножении, определяют развитие многих женских вторичных половых признаков, регулируют транскрипцию гена рецептора прогестина. В лютеиновой фазе под действием эстрогенов вместе с прогестинами пролиферативный эндометрий (эпителий матки) превращается в секреторный, подготавливая его к имплантации оплодотворённой яйцеклетки. Эстрогены оказывают влияние на обмен липидов. Так, увеличение скорости синтеза ЛПВП и торможение образования ЛПНП, вызываемое эстрогенами, приводит к снижению содержания холестерола в крови. 5. Биологические эффекты прогестерона Действие прогестерона в основном направлено на репродуктивную функцию организма. Образование прогестерона отвечает за увеличение базальной температуры тела на 0,2-0,5°С, которое происходит сразу после овуляции и сохраняется на протяжении лютеиновой фазы менструального цикла. При высоких концентрациях прогестерон взаимодействует с рецепторами, локализованными в клетках почечных канальцев, конкурируя таким образом с альдостероном. В результате конкурентного игибирования альдостерон теряет возможность стимулировать реабсорбцию натрия. Прогестерон может также оказывать действие и на ЦНС, в частности вызывать некоторые особенности поведения в предменструальный период | Эйкозаноиды. Их синтез. Химическая природа. Биологическая роль. Эйкозаноиды, включающие в себя простагландины, тромбоксаны, лейкотриены и ряд других веществ, - высокоактивные регуляторы клеточных функций. Они имеют очень короткий Т1/2, поэтому оказывают эффекты как "гормоны местного действия", влияя на метаболизм продуцирующей их клетки по аугокзэинному механизму, и на окружающие клетки - по паракринному механизму. Эйкозаноиды участвуют во многих процессах: регулируют тонус ГМК и вследствие этого влияют на АД, состояние бронхов, кишечника, матки. Эйкозаноиды регулируют секрецию воды и натрия почками, влияют на образование тромбов. Разные типы эйкозаноидов участвуют в развитии воспалительного процесса, происходящего после повреждения тканей или инфекции. Такие признаки воспаления, как боль, отёк, лихорадка, в значительной мере обусловлены действием эйкозаноидов. Избыточная секреция эйкозаноидов приводит к ряду заболеваний, например бронхиальной астме и аллергическим реакциям. Главный субстрат для синтеза эйкозаноидов у человека - арахидоновая кислота,так как её содержание в организме человека значительно больше остальных полиеновыхкислот-предшественниковэйкозаноидов В меньшем количестве для синтеза эйкозаноидов используются эйкозапентаеновая (20:5, ω-3)и эйкозатриеновая (20:3,ω-6)жирные кислоты. Хотя субстраты для синтеза эйкозаноидов имеют довольно простую структуру (полистовые жирные кислоты), из них образуется большая и разнообразная группа веществ. Наиболее распространены в организме человека простагландины, которые впервые были выделены из предстательной железы, откуда и получили свое название. Позже было показано, что и другие ткани организма синтезируют простагландины и другие эйкозаноиды.  Эйкозаноиды - гормоны местного действия по ряду признаков: образуются в различных тканях и органах, а не только в эндокринных железах; действуют по аутокринному или паракринному механизмам; концентрация эйкозаноидов в крови меньше, чем необходимо, чтобы вызвать ответ в клетках-мишенях.Только при некоторых патологических состояниях эйкозаноиды могут оказывать системное действие, если их концентрация в крови увеличивается до количеств, когда они могут оказать действие на ГМК всего органа, например кишечника, лёгких, кровеносных сосудов. Один и тот же тип эйкозаноида может действовать по паракринному и по аутокринному механизму. Например, ТХ А2, продуцируемый тромбоцитами при их активации, действует на сами тромбоциты, увеличивая их способность к агрегации, ив то же время действует на окружающие ГМК кровеносных сосудов, способствуя их сокращению. Таким образом создаются условия для образования тромба и предотвращения кровотечения в области повреждения сосудов.Эйкозаноиды действуют на клетки через специальные рецепторы. Некоторые рецепторы эйкозаноидов связаны с аденилатциклазной системой и протеинкиназой А - это рецепторы PGE, PG D, PC I. PG F2α, ТХ А2 эндоперекиси (ГПЭТЕ) и лейкотриены действуют через механизмы, увеличивающие уровень кальция в цитозоле клеток-мишеней.Во многих клетках эйкозаноиды влияют на степень активации аденилатциклазной системы в ответ на действие других факторов, например гормонов. В этих случаях эйкозаноиды влияют на конформациюG-белковв плазматической мембране клеток. Если эйкозаноид связывается со стимулирующимиGs-белками,то эффект основного стимулирующего агента увеличивается; если с Giингибирующими - эффект снижается. Эйкозаноиды действуют на клетки почти всех тканей организма. | Гистамин. Синтез. Химическая природа. Биологическая роль.Гистамин образуется путем декарбоксилирования гистидина в тучных клетках соединительной ткани. Гистамин образует комплекс с белками и сохраняется в секреторных гранулах тучных клеток. Секретируется в кровь при повреждении ткани (удар, ожог, воздействие эндо- и экзогенных веществ), развитии иммунных и аллергических реакций. Гистамин выполняет в организме человека следующие функции: стимулирует секрецию желудочного сока, слюны (т.е. играет роль пищеварительного гормона); повышает проницаемость капилляров, вызывает отёки, снижает АД (но увеличивает внутричерепное давление, вызывает головную боль);  Биологически активные пептиды: брадикинины, нейропептиды, атриопептиды. Биологическая роль. Нейропептиды (НП) присутствуют в немиелинизированных волокнах С-типаи небольших миелинизированных волокнахА-дельта-типа.Они синтезируются клетками дорзальных рогов ганглиев, а затем транспортируются вдоль аксонов в нервные окончания, где накапливаются в плотных везикулах. Вначале было изучено влияние НП на сосудистый тонус. Однако впоследствии было обнаружено, что некоторые из них генерируют и поддерживают воспалительный процесс, называемый «нейрогенным». Брадикинин (англ. Bradykinin) — пептид, расширяющий кровеносные сосуды и потому снижающий артериальное давление. Ингибиторы АПФ[1], которые используются для снижения артериального давления, повышают уровень брадикинина. Брадикинин воздействует на кровеносные сосуды, высвобождая простациклин, оксид азота(II). Брадикинин — это физиологически и фармакологически активный пептид из кининовой группы белков, состоящий из девяти аминокислот. Считается, что брадикинин является основным фактором, обеспечивающим болевую чувствительность, являясь плазменным алгогеном. Брадикинин открыт в 1948 году коллективом бразильских учёных, руководил которым М. Роша э Силва (англ.)русск., они же исследовали свойства пептида, включая гипотензивные. 4) атриопептиды - выделенные из ткани предсердия, усиливают клубочковую фильтрацию и выделение натрия и хлоридов почками; 5) нейропептиды - выделенные из тканей мозга. Некоторые из них имеют отношение к обезболивания, сна, механизмов памяти, обучения и т.д.; | Серотонин. Синтез. Химическая природа. Биологическая роль. Синтез и биологическая роль серотонина Серотонин - нейромедиатор проводящих путей. Образуется в надпочечниках и ЦНС из аминокислоты 5- гидрокситриптофана в результате действия декарбоксилазы ароматических аминокислот. Этот фермент обладает широкой специфичностью и способен также декарбоксилировать триптофан и ДОФА, образующийся из тирозина. 5-Гидрокситриптофансинтезируется из триптофана под действием фенилаланингидроксилазы с коферментом Н4БП (этот фермент обладает специфичностью к ароматическим аминокислотам и гидроксидирует также фенилаланин. Серотонин может превращаться в гормон мелатонин, регулирующий суточные и сезонные изменения метаболизма организма и участвующий в регуляции репродуктивной функции.  Серотонин - биологически активное вещество широкого спектра действия. Он стимулирует сокращение гладкой мускулатуры, оказывает сосудосуживающий эффект, регулирует АД, температуру тела, дыхание, обладает антидепрессантным действием. По некоторым данным он может принимать участие в аллергических реакциях, поскольку в небольших количествах синтезируется в тучных клетках. Особенности развития, строения и метаболизма эритроцитов. Эритроциты - высокоспециализированные клетки, которые переносят кислород от лёгких к тканям и диоксид углерода, образующийся при метаболизме, из тканей к альвеолам лёгких. Транспорт О2 и СО2 в этих клетках осуществляет гемоглобин, составляющий 95% их сухого остатка. 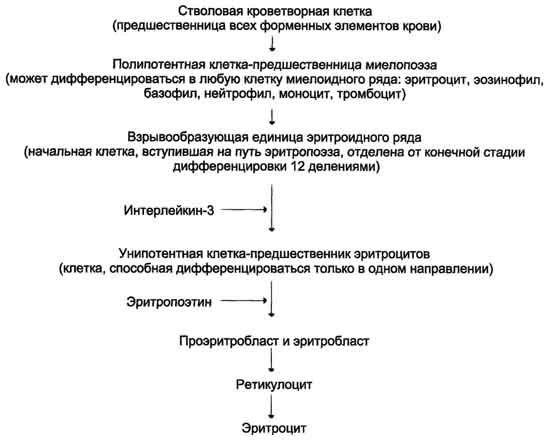 Двояковогнутая форма эритроцитов имеет большую площадь поверхности по сравнению с клетками сферической формы такого же размера. Это облегчает газообмен между клеткой и внеклеточной средой. Кроме того, такая форма, а также особенности строения мембраны и цитоскелета обеспечивают большую пластичность эритроцитов при прохождении ими мелких капилляров.Важную роль в сохранении формы и способности к обратимой деформации эритроцитов играют липиды и белки плазматической мембраны.Липиды бислоя плазматической мембраны эритроцитов, так же, как плазматические мембраны других клеток, содержат глицерофосфолипиды, сфингофосфолипиды, гликолипиды и холестерол. Увеличение содержания холестерола в составе мембраны, которое может наблюдаться при некоторых заболеваниях, снижает её текучесть и эластичность, а следовательно, и способность к обратимой деформации. Это, в свою очередь, затрудняет движение эритроцитов через капилляры и может способствовать развитию гемостаза. Двояковогнутая форма эритроцитов имеет большую площадь поверхности по сравнению с клетками сферической формы такого же размера. Это облегчает газообмен между клеткой и внеклеточной средой. Кроме того, такая форма, а также особенности строения мембраны и цитоскелета обеспечивают большую пластичность эритроцитов при прохождении ими мелких капилляров.Важную роль в сохранении формы и способности к обратимой деформации эритроцитов играют липиды и белки плазматической мембраны.Липиды бислоя плазматической мембраны эритроцитов, так же, как плазматические мембраны других клеток, содержат глицерофосфолипиды, сфингофосфолипиды, гликолипиды и холестерол. Увеличение содержания холестерола в составе мембраны, которое может наблюдаться при некоторых заболеваниях, снижает её текучесть и эластичность, а следовательно, и способность к обратимой деформации. Это, в свою очередь, затрудняет движение эритроцитов через капилляры и может способствовать развитию гемостаза. |
