шпоры по бх-последняя итоговая. Основные системы межклеточной коммуникации эндокринная, паракринная, аутокринная регуляция
 Скачать 0.64 Mb. Скачать 0.64 Mb.
|
|
Спектрин - периферический мембранный белок, нековалентно связанный с цитоплазматической поверхностью липидного бислоя мембраны. Он представляет собой длинную, тонкую, гибкую фибриллу и является основным белком цитоскелета эритроцитов. Спектрин состоит из α- и β-полипептидных цепей, имеющих доменное строение; α- и β-цепи димера расположены антипараллельно, перекручены друг с другом и нековалентно взаимодействуют во многих точках. Спектрин может прикрепляться к мембране и с помощью белка анкирина. Этот крупный белок соединяется с β-цепью спектрина и цитоплазматическим доменом интегрального белка мембраны - белка полосы 3. Анкирин не только фиксирует спектрин на мембране, но и уменьшает скорость диффузии белка полосы 3 в липидном слое. Таким образом, на цитоплазматической поверхности эритроцитов образуется гибкая се-тевидная структура, которая обеспечивает сохранение их формы при прохождении через узкие капилляры сосудов. Интегральный белок полосы 3 - белок-переносчик ионов С1- и НСО3- через плазматическую мембрану эритроцитов по механизму пассивного антипорта. В разделе 1 подробно описана роль эритроцитов в газообмене. Поступающий из тканей в эритроциты СО2 под действием фермента карбоангидразы превращается в слабую угольную кислоту, которая распадается на Н+ и НСО3-. Са2+-АТФ-аза - ещё один мембранный фермент, осуществляющий выведение из эритроцитов ионов кальция и поддерживающий градиент концентрации этого иона по обе стороны мембраны. | |
| Образование и обезвреживание активных форм кислорода в эритроцитах. Большое содержание кислорода в эритроцитах определяет высокую скорость образования супероксидного анион-радикала (О2-), пероксида водорода (Н2О2) и гидроксил радикала (ОН.). Эритроциты содержат ферментативную систему, предотвращающую токсическое действие активных форм кислорода и разрушение мембран эритроцитов. Постоянный источник активных форм кислорода в эритроцитах - неферментативное окисление гемоглобина в метгемоглобин: 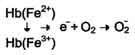 В течение суток до 3% гемоглобина может окисляться в метгемоглобин. Однако постоянно метгемоглобинредуктазная сисгема восстанавливает метгемоглобин в гемоглобин. Метгемоглобинредуктазная сисгема состоит из цитохрома B5 и флавопротеина цитохром B5редуктазы, донором водорода для которой служит NADH, образующийся в глицеральдегиддегидрогеназной реакции гликолиза . Цитохром B5 восстанавливает Fe3+ метгемог-лобина в Fe2+: Hb-Fe3+ + цит. b5 восст. → HbFe2+ + цит. b5 ок. . Окисленный цитохром B5 далее восстанавливается цитохром B5 редуктазой: Цит. B5 ок + NADH → цит. B5 восст. + NAD+. Супероксидный анион с помощью фермента супероксидцисмутазы превращается в пероксид водорода: O2- + O2- + Н+ → H2О2 + O2 . Пероксид водорода разрушается каталазой и содержащим селен ферментом глутатионпероксидазой. Донором водорода в этой реакции служит глутатион - трипептид глутамилцистеинилглицин (GSH). 2Н2О → 2Н2О + О2; 2GSH + 2Н2О2 → GSSG + 2Н2О . Окисленный глутатион (GSSG) восстанавливается NADPH-зависимой глутатионредуктазой. Восстановление NADP для этой реакции обеспечивают окислительные реакции пентозофосфатного пути. | Гемоглобин плода и его физиологическое значение. Полиморфные формы гемоглобинов человека Гемоглобины, синтезирующиеся в период внутриутробного развития плода: Эмбриональный гемоглобин синтезируется в эмбриональном желточном мешке через несколько недель после оплодотворения. Гемоглобин F - фетальный гемоглобин, синтезируется в печени и костном мозге плода до периода его рождения. Имеет тетрамерную структуру, состоящую из 2 ?- и 2 ?-цепей.После рождения ребёнка постепенно замещается на гемоглобин А, который начинает синтезироваться в клетках костного мозга уже на 8-ммесяце развития плода.Гемоглобин плода обладает выраженным сродством к кислороду. Фетальный гемоглобин отличается повышенной способностью поглощать кислород, поступающий из крови матери; эта способность гемоглобина плода имеет важное значение в обеспечении кислородом всех его тканей и органов.Фетальный («эмбриональный») гемоглобин постепенно замещается гемоглобином обычного типа. НЬА, или гемоглобин взрослых (сс2р2). Его отличительная черта строение р-цепи(рис. 4.35). а- иР-цепиразличаются по многим аминокислотным остаткам. У всех взрослых есть небольшое количество(2-3%)гемоглобина НЬА2(сс252). Характерная для него5-цепьотличается отр-цепитолько по десяти аминокислотным остаткам. После рождения у всех детей обнаруживается также небольшое количество (меньше 1%) фетального гемоглобина HbF:a2y2 (см. ниже), у- цепь значительно отличается от а- и(3-цепей.a-цепиНЬА, НЬА2 и HbF идентичны. Все нормальные гемоглобины человека, которые были исследованы, имеют идентичную трехмерную структуру, существенную для переноса кислорода. Все глобиновые цепи различных гемоглобинов имеют общее эволюционное происхождение и возникли в результате последовательных дупликаций генов Варианты гемоглобинов. Варианты гемоглобина возникают вследствие различных мутационных событий в конкретном глоби-новомгене. Чаще всего разные варианты гемоглобина отличаются друг от друга одной аминокислотой в глобиновой цепи. Описано около 350 таких единичных замен . Эти аминокислотные замены вызываются замещением всего одного нуклеотида в триплете. Мутации, которые не влияют на заряд полипептида, обычно удается обнаружить только в том случае, если они существенно нарушают функционирование гемоглобина и приводят к болезни. Большинство мутаций гемоглобина независимо от того, меняют они заряд молекулы или нет, не влияют на функции гемоглобина и не приводят к патологии. |
| Транспорт кислорода и диоксида углерода. 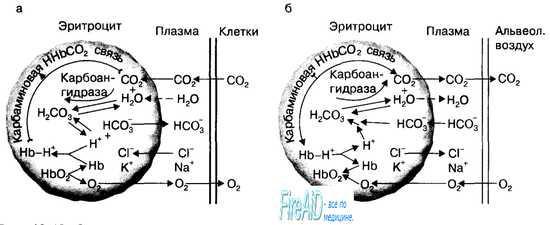 В крови капилляров тканей организма напряжение углекислого газа составляет (40 мм рт. ст.), а в самих тканях — (60—80мм рт. ст.). В результате С02 диффундирует из тканей в плазму крови, а из нее — в эритроциты по градиенту парциального давления С02. В эритроцитах С02 образует с водой угольную кислоту, которая диссоциирует на Н+ и HCO3. (С02 + Н20 = Н2СО3 = Н+ + HCO3). Эта реакция протекает быстро, поскольку С02 + Н20 = Н2СОэ катализируется ферментом карбоангидразой мембраны эритроцитов, которая содержится в них в высокой концентрации . Процессы газообмена углекислого газа между клетками тканей и плазмой крови. С02 поступает путем диффузии в плазму крови из тканей и дифференцирует внутрь эритроцитов. В эритроцитах С02 превращается при участии фермента карбоангидразы мембраны эритроцитов в НСОз и в виде этого иона вновь активно транспортируется в плазму крови, в которой в составе бикарбонатов (NaHC03) переносится к капиллярам легких. Водородные ионы, образующиеся при реакции дегидратации Н2С03, захватываются молекулами гемоглобина и также транспортируются кровью от тканей к легким. При транспорте из эритроцитов НСОз-ионноепостоянство внутри эритроцитов поддерживается хлорным сдвигом. Кроме того, С02 в эритроцитах непосредственно соединяется с Nh2 группами белков гемоглобина. Процессы газообмена углекислого газа между плазмой крови и альвеолами легких. В капиллярах легких в эритроцитах под влиянием эффекта Бора происходит диссоциация карбаминовых соединений и С02 диффундирует через мембрану эритроцитов и альвеолярную мембрану в просвет альвеол легких. Диссоциация углекислого газа в эритроцитах может быть лимитирована только буферной емкостью молекул гемоглобина. Образующиеся внутри эритроцитов в результате диссоциации С02 ионы НСОз с помощью специальногобелка-переносчикамембраны эритроцитов выводятся из эритроцитов в плазму, а на их место из плазмы крови закачиваются ионы СГ (феномен «хлорного» сдвига) (рис. 10.19). Основная роль реакции С02 внутри эритроцитов заключается в обмене ионами СГ и НСОз между плазмой и внутренней средой эритроцитов. В результате этого обмена продукты диссоциации углекислого газа Н+ и НСОз будут транспортироваться внутри эритроцитов в виде соединения(Нb-Н+),а плазмой крови — в виде бикарбонатов. Эритроциты участвуют в транспорте углекислого газа от тканей к легким, поскольку С02 образует прямую комбинацию с —NН2-группамибелковых субъединиц гемоглобина: С02 + Нb->НbС02 или карбаминовое соединение. Транспорт кровью С02 в виде карбаминового соединения и ионов водорода гемоглобином зависит от свойств молекул последнего; обе реакции обусловлены величиной парциального давления кислорода в плазме крови на основе эффекта Холдена. В количественном отношении транспорт углекислого газа в растворенной форме и в форме карбаминового соединения является незначительным, по сравнению с его переносом С02 кровью в виде бикарбонатов. Однако при газообмене С02 в легких между кровью и альвеолярным воздухом эти две формы приобретают основное значение. Когда венозная кровь возвращается от тканей к легким, С02 диффундирует из крови в альвеолы и РС02 в крови снижается с 46 мм рт. ст. (венозная кровь) до 40 мм рт.ст. (артериальная кровь). При этом в величине общего количества С02 (6 мл/100 мл крови), диффундирующего из крови в альвеолы, доля растворенной формы С02 и карбаминовых соединений становится более значительной относительно бикарбонатной. Так, доля растворенной формы составляет 0,6 мл/100 мл крови, или 10 %, карбаминовых соединений — 1,8 мл/100 мл крови, или 30%, а бикарбонатов — 3,6 мл/100 мл крови, или 60 %. В эритроцитах капилляров легких по мере насыщения молекул гемоглобина кислородом начинают освобождаться ионы водорода, диссоциировать карбаминовые соединения и НСОз вновь превращается в С02 (Н+ + НСОз = = Н2С03 = С02 +Н20), который путем диффузии выводится через легкие по градиенту его парциальных давлений между венозной кровью и альвеолярным пространством. Таким образом, гемоглобин эритроцитов играет основную роль в транспорте кислорода от легких к тканям, и углекислого газа в обратном направлении, поскольку способен связываться с 02 и Н+. В состоянии покоя через легкие из организма человека за минуту удаляется примерно 300 мл С02: 6 мл/100 мл крови х 5000 мл/мин минутного объема кровообращения. | Гемоглобинопатии. Анемические гипоксии. Важность первичной структуры белков для формирования их конформации и функции можно проследить на примерах наследственных заболеваний, связанных с изменением первичной структуры гемоглобина. В аномальных гемоглобинах изменения могут затрагивать аминокислоты: находящиеся на поверхности белка; участвующие в формировании активного центра; замена которых нарушает общую трёхмерную конформацию молекулы; изменяющие четвертичную структуру белка и его регуляторные свойства. Так как "серповидные" эритроциты плохо проходят через капилляры тканей, они часто закупоривают сосуды и создают тем самым локальную гипоксию. Это повышает концентрацию дезоксигемоглобина S в эритроцитах, скорость образования агрегатов гемоглобина S и ещё большую деформацию эритроцитов. Нарушение доставки О2 в ткани вызывает боли "даже некроз клеток в данной области. Серповидно-клеточнаяанемия - гомозиготное рецессивное заболевание; проявляется только в том случае, когда от обоих родителей наследуются 2 мутантных гена?-цепейглобина. После рождения ребёнка болезнь не проявляется до тех пор, пока значительные количества HbF не заместятся на HbS. У больных выявляют клинические симптомы, характерные для анемии: головокружение и головные боли, одышка, учащённое сердцебиение, боли в конечностях, повышенную восприимчивость к инфекционным заболеваниям.Гетерозиготные индивидуумы, имеющие один нормальный ген НЬА, а другой ген HbS, в крови имеют лишь следовые количества серповидных клеток и нормальную продолжительность жизни; клинические симптомы болезни у них обычно не проявляются. 2. Изменения аминокислотного состава в области активного центра гемоглобина Между гемом и белковой частью гемоглобина существует около 60 межатомных контактов. Большинство мутаций, нарушающих в той или иной мере эти контакты, приводят к развитию гемоглобинопатии и анемии. Гемоглобин М - вариант гемоглобина А, где в результате мутации в генах происходит замена Гис Е7 или Гис F8 тирозином. В результате Fe2+ окисляется в Fe3+ и стабилизируется в этой форме. Гемоглобин, содержащий в теме Fe3+, называют метгемоглобином (отсюда и название - гемоглобин М). Вместо О2 к Fe3+ присоединяется Н2О. 3.Изменения аминокислотного состава, деформирующие третичную структуру гемоглобина Во всех нормальных гемоглобинах и в миоглобине в месте пересечения двух ?-спиралейВ и Е находится аминокислота глицин. Так как глицин вместо радикала содержит атом водорода, в этом месте две спирали плотно прилегают друг к другу. В гемоглобине Ривердейла-Бронкса(вариант гемоглобина А) вместо глицина в положении В6 находится аминокислота аргинин, имеющая объёмный радикал. В результате он не умещается в столь узком пространстве, молекула меняет конформацию и становится нестабильной. |
| Белковые фракции крови и клинико-диагностическоезначение их определения (при воспалительном процессе, циррозе печени и нефротическом синдроме). Диспротеинемии. Белковые фракции – количественное соотношение фракций общего белка сыворотки крови: альбуминов, α-1-глобулинов,α-2-глобулинов,β-глобулиновиγ-глобулинов.Фракция альбуминов однородна, в норме составляет 50-65%от общего количества белка. Глобулиновые фракции по составу более разнородны.Фракция α-1-глобулиноввключает в себяальфа-1-антитрипсин(основной компонент этой фракции) – ингибитор протеолитических ферментов,альфа-1-кислыйгликопротеин (орозомукоид) – обладает широким спектром функций, в зоне воспаления способствует фибриллогенезу,альфа-1-липопротеины(функция– участие в транспорте липидов), протромбин и транспортные белки: тироксинсвязывающий глобулин, транкортин (функция – связывание и транспорт кортизола и тироксина соответственно).Фракция α-2-глобулиновпреимущественно включает белки острой фазы –альфа-2макроглобулин, гаптоглобин, церулоплазмин, а также аполипопротеин В.Альфа-2-макроглобулин,являющийся основным компонентом фракции, участвует в развитии инфекционных и воспалительных реакций. Гаптоглобин – это гликопротеин, который образует комплекс с гемоглобином, высвобождающемся из эритроцитов при внутрисосудистом гемолизе. Церулоплазмин специфически связывает ионы меди, а также является оксидазой аскорбиновой кислоты, адреналина, диоксифенилаланина (ДОФА), способен инактивировать свободные радикалы.Альфа-липопротеиныучаствуют в транспорте липидов.Фракция β-глобулиновсодержит трансферрин (главный плазменный белок – переносчик железа), гемопексин (связывает гемм/метгем, вследствие чего предотвращает выведение его почками и потерю железа), компоненты комплемента (которые учавствуют в реакциях иммунитета),бета-липопротеины(принимают участие в транспорте холестерина и фосфолипидов) и часть иммуноглобулинов. Фракция γ-глобулиновсостоит из иммуноглобулинов (соответственно порядку количественного убывания – IgG, IgA, IgM, IgE). Функционально иммуноглобулины представляют собой антитела, обеспечивающие гуморальный иммунитет.Изменение соотношения белковых фракций плазмы крови наблюдается при многих заболеваниях при нормальном содержании общего белка (диспротеинемии). Диспротеинемии отмечаются чаще, чем изменение общего количества белка. При наблюдении в динамике могут характеризовать стадию заболевания, его длительность, эффективность проводимых лечебных мероприятий. Характерные варианты сдвигов содержания белковых фракций.Острофазный ответ (изменения, связанные с воспалением и некрозом тканей) – повышение содержания α-1-иα-2-глобулинов.Наблюдается при острой вирусной инфекции, острой пневмонии, остром бронхите, остром пиелонефрите, инфаркте миокарда, травмах (включая хирургические), новообразованиях. |
