|
|
шпоры по бх-последняя итоговая. Основные системы межклеточной коммуникации эндокринная, паракринная, аутокринная регуляция
Основные системы межклеточной коммуникации: эндокринная, паракринная, аутокринная регуляция.
По расстоянию от клетки—продуцента гормона до клетки-мишени различают эндокринный, паракринный и аутокринный варианты регуляции. • Эндокринная, или дистантная, регуляция. Секреция гормона происходит в жидкие среды организма. Клетки-мишени могут отстоять от эндокринной клетки сколь угодно далеко. Пример: секреторные клетки эндокринных желёз, гормоны из которых поступают в систему общего кровотока. •Паракринная регуляция. Продуцент биологически активного вещества и клетка-мишень расположены рядом. Молекулы гормона достигают мишени путём диффузии в межклеточном веществе. Например, в париетальных клетках желёз желудка секрецию Н+стимулируют гастрин и гистамин, а подавляют соматостатин и Пг, секретируемые рядом расположенными клетками.• Аутокринная регуляция. При аутокринной регуляции клетка—продуцент гормона имеет рецепторы к этому же гормону (другими словами, клетка—продуцент гормона в то же время является его мишенью). Примеры: эндотелины, вырабатываемые клетками эндотелия и воздействующие на эти же эндотелиальные клетки; Т-лимфоциты, секретирующие интерлейкины, имеющие мишенями разные клетки, в том числе и Т-лимфоциты.
|
Нервная и гуморальная регуляция как единая система регуляции обмена веществ. Гормоны- первичные посредники в передачи информации.
Системы регуляции обмена веществ и функций организма образуют 3 иерархических уровня.
Первый уровень - ЦНС. Нервные клетки получают сигналы, поступающие из внешней и внутренней среды, преобразуют их в форму нервного импульса и передают через синапсы, используя химические сигналы - медиаторы. Медиаторы вызывают изменения метаболизма в эффекторных клетках.
Второй уровень - эндокринная система. Включает гипоталамус, гипофиз, периферические эндокринные железы (а также отдельные клетки), синтезирующие гормоны и высвобождающие их в кровь при действии соответствующего стимула.
Третий уровень - внутриклеточный. Его составляют изменения метаболизма в пределах клетки или отдельного метаболического пути, происходящие в результате:изменения активности ферментов путём активации или ингибирования;изменения количества ферментов по механизму индукции или репрессии синтеза белков или изменения скорости их разрушения,изменения скорости транспорта веществ через мембраны клеток.
Интегрирующими регуляторами, связывающими различные регуляторные механизмы и метаболизм в разных органах, являются гормоны. Они функционируют как химические посредники, переносящие сигналы, возникающие в различных органах и ЦНС. В крови гормоны присутствуют в очень низкой концентрации. Для того чтобы передавать сигналы в клетки, гормоны должны распознаваться и связываться особыми белками клетки - рецепторами, обладающими высокой специфичностью.
Физиологический эффект гормона определяется разными факторами, например концентрацией гормона (которая определяется скоростью инактивации в результате распада гормонов, протекающего в основном в печени, и скоростью выведения гормонов и его метаболитов из организма), его сродством к белкам-переносчикам (стероидные и тиреоидные гормоны транспортируются по кровеносному руслу В комплексе с белками), количеством и типом рецепторов на поверхности клеток-мишеней.
|
Регуляция синтеза и секреции гормонов по принципу обратной связи
Поддержание уровня гормонов в организме обеспечивает механизм отрицательной обратной связи. Изменение концентрации метаболитов в клетках-мишенях по механизму отрицательной обратной связи подавляет синтез гормонов, действуя либо на эндокринные железы, либо на гипоталамус. Синтез и секреция тропных гормонов подавляется гормонами эндокринных периферических желёз. Такие петли обратной связи действуют в системах регуляции гормонов надпочечников, щитовидной железы, половых желёз.
Не все эндокринные железы регулируются подобным образом. Гормоны задней доли гипофиза (вазопрессин и окситоцин) синтезируются в гипоталамусе в виде предшественников и хранятся в гранулах терминальных аксонов нейрогипофиза. Секреция гормонов поджелудочной железы (инсулина и глюкагона) напрямую зависит от концентрации глюкозы в крови.
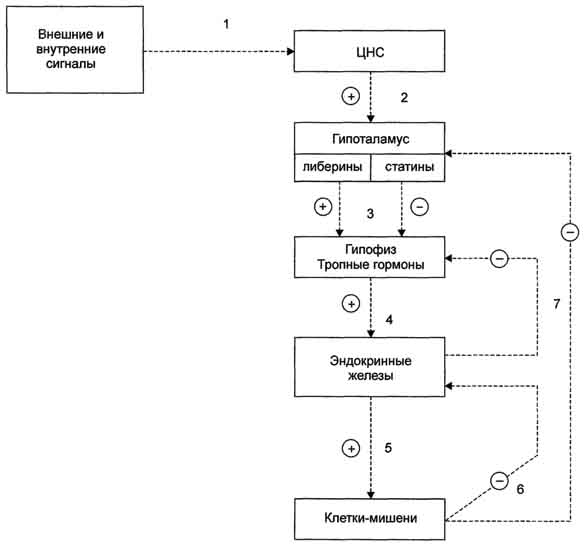 1 - синтез и секреция гормонов стимулируется внешними и внутренними сигналами; 2 - сигналы по нейронам поступают в гипоталамус, где стимулируют синтез и секрецию рилизинг-гормо-нов; 3 - рилизинг-гормоны стимулируют (либерины) или ингибируют (статины) синтез и секрецию тройных гормонов.гипофиза; 4 - тройные гормоны стимулируют синтез и секрецию гормонов периферических эндокринных желез; 5 - гормоны эндокринных желез поступают в кровоток и взаимодействуют с клетками-мишенями; 6 - изменение концентрации метаболитов в клетках-мишенях по механизму отрицательной обратной связи подавляет синтез гормонов эндокринных желез и гипоталамуса; 7 - синтез и секреция тройных гормонов подавляется гормонами эндокринных желез; ⊕ - стимуляция синтеза и секреции гормонов; ⊝ - подавление синтеза и секреции гормонов (отрицательная обратная связь). 1 - синтез и секреция гормонов стимулируется внешними и внутренними сигналами; 2 - сигналы по нейронам поступают в гипоталамус, где стимулируют синтез и секрецию рилизинг-гормо-нов; 3 - рилизинг-гормоны стимулируют (либерины) или ингибируют (статины) синтез и секрецию тройных гормонов.гипофиза; 4 - тройные гормоны стимулируют синтез и секрецию гормонов периферических эндокринных желез; 5 - гормоны эндокринных желез поступают в кровоток и взаимодействуют с клетками-мишенями; 6 - изменение концентрации метаболитов в клетках-мишенях по механизму отрицательной обратной связи подавляет синтез гормонов эндокринных желез и гипоталамуса; 7 - синтез и секреция тройных гормонов подавляется гормонами эндокринных желез; ⊕ - стимуляция синтеза и секреции гормонов; ⊝ - подавление синтеза и секреции гормонов (отрицательная обратная связь).
|
Клетки-мишени и клеточные рецепторы гормонов. Рецепторы цитоплазматической мембраны. Рецепторы, локализованные в цитоплазме. Рецепторы сопряженные с ионными каналами. Регуляция работы рецепторного аппарата
Концентрация гормонов во внеклеточной жидкости очень низка и обычно колеблется в пределах 10-6-10-11 ммоль/л. Клетки-мишени отличают соответствующий гормон от множества других молекул и гормонов благодаря наличию на клетке-мишени соответствующего рецептора со специфическим центром связывания с гормоном.
Рецепторы пептидных гормонов и адреналина располагаются на поверхности клеточной мембраны. Рецепторы стероидных и тиреоидных гормонов находятся внутри клетки. Причём внутриклеточные рецепторы для одних гормонов, например глюкокортикоидов, локализованы в цитозоле, для других, таких как андрогены, эстрогены, тиреоидные гормоны, расположены в ядре клетки Рецепторы по своей химической природе являются белками и, как правило, состоят из нескольких доменов.
В структуре мембранных рецепторов можно выделить 3 функционально разных участка. Первый домен (домен узнавания) расположен в N-концевой части полипептидной цепи на внешней стороне клеточной мембраны; он содержит гликозилированные участки и обеспечивает узнавание и связывание гормона. Второй домен - трансмембранный. У рецепторов одного типа, сопряжённых с G-белками, он состоит из 7 плотно упакованных α-спиральныхполипептидных последовательностей. У рецепторов другого типа трансмембранный домен включает только одну α-спирадизованную полипептидную цепь (например, обе β-субъединицы гетеротетрамерного рецептора инсулина α2β2). Третий (цитоплазматический) домен создаёт химический сигнал в клетке, который сопрягает узнавание и связывание гормона с определённым внутриклеточным ответом.
Рецепторы стероидных и тиреоидных гормонов содержат 3 функциональные области. На С-концевом участке полипептидной цепи рецептора находится домен узнавания и связывания гормона. Центральная часть рецептора включает домен связывания ДНК. На N-концевом участке полипептидной цепи располагается домен, называемый вариабельной областью рецептора, отвечающий за связывание с другими белками, вместе с которыми участвует в регуляции транскрипции.
Концентрация рецепторов внутри клетки или на её поверхности и их сродство к данному гормону в норме регулируются различными способами, а также могут меняться при заболеваниях или при использовании гормонов или их агонистов в качестве лекарственных средств. Например, при воздействии β-адренергических агонистов на клетки в течение нескольких минут в ответ на новое добавление агониста прекращается активация аденилатциклазы, и биологический ответ исчезает. Такое снижение чувствительности рецептора к гормону (десенситизация) может происходить в результате изменения количества рецепторов по механизму понижающей регуляции. Гормон связывается с рецептором, комплекс гормон-рецептор путём эндоцитоза проникает в клетку (интернализуется), где часть рецепторов подвергается протеолитическому расщеплению под действием ферментов лизосом, а часть инактивируется, отделяясь от других мембранных компонентов. Это приводит к уменьшению количества рецепторов на плазматической мембране. Например, в случае инсулина, глюкагона, катехоламинов это происходит в течение нескольких минут или часов. При снижении концентрации гормона рецепторы возвращаются на поверхность клетки, и чувствительность к гормону восстанавливается. Активность рецептора, т.е. его сродство к гормону, может изменяться также в результате ковалентной модификации, главным образом путём фосфорилирования.
|
Механизмы передачи гормональных сигналов в клетки: G-белки, циклические АМФ и ГМФ как вторичные посредники. Протеинкиназа А и протеинкиназа G
По механизму действия гормоны можно разделить на 2 группы. К первой группе относят гормоны, взаимодействующие с мембранными рецепторами (пептидные гормоны, адреналин, а также гормоны местного действия - цитокины, эйкозаноиды). Вторая группа включает гормоны, взаимодействующие с внутриклеточными рецепторами.
Связывание гормона (первичного посредника) с рецептором приводит к изменению кон-формации рецептора. Это изменение улавливается другими макромолекулами, т.е. связывание гормона с рецептором приводит к сопряжению одних молекул с другими (трансдукция сигнала). Таким образом, генерируется сигнал, который регулирует клеточный ответ путём изменения активности или количества ферментов и других белков. 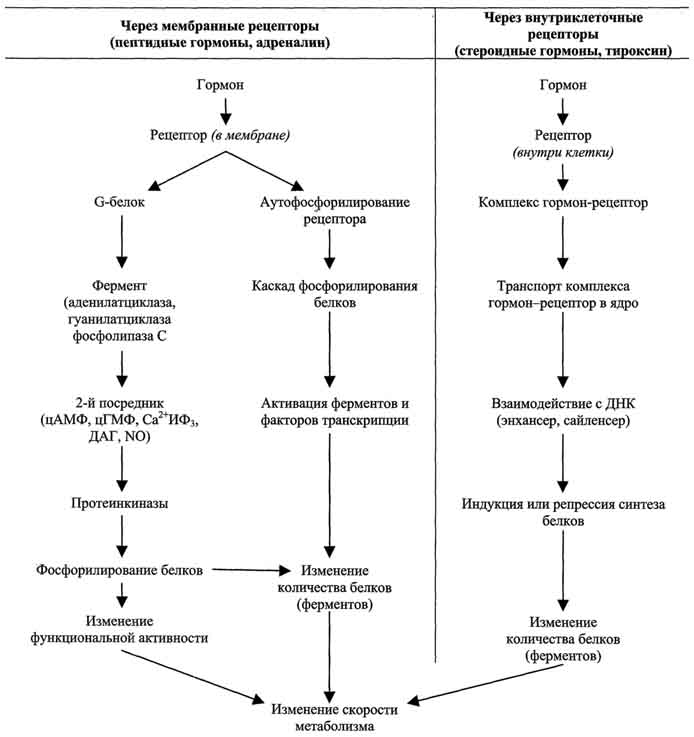
Гормоны (первичные посредники), связываясь с рецепторами на поверхности клеточной мембраны, образуют комплекс гормон-рецептор, который трансформирует сигнал первичного посредника в изменение концентрации особых молекул внутри клетки - вторичных посредников. Вторичными посредниками могут быть следующие молекулы: цАМФ, цГМФ, ИФ3, ДАТ, Са2+, NO.
Гормоны, взаимодействие которых с рецептором клетки-мишени приводит к образованию цАМФ, действуют через трёхкомпонентную систему, которая включает белок-рецептор, G-белок и фермент аденилатциклазу. Образующийся под действием аденилатциклазы цАМФ активирует протеинкиназу А, фосфорилируюшую ферменты и другие белки Известно более 200 различных G-белков, в структуре которых обнаружены 3 субъединицы α, β и γ (см. раздел 5). В отсутствие гормона α-субъединица G-белка связана с ГДФ. Образование комплекса гормонрецептора приводит к конформационным изменениям α-субъединицы, замене ГДФ на ГТФ и отщеплению димера βγ от α-ГТФ. В случае рецепторов, сопряжённых с Gs-белком, субъединица αs-ГТФ активирует аденилатциклазу .
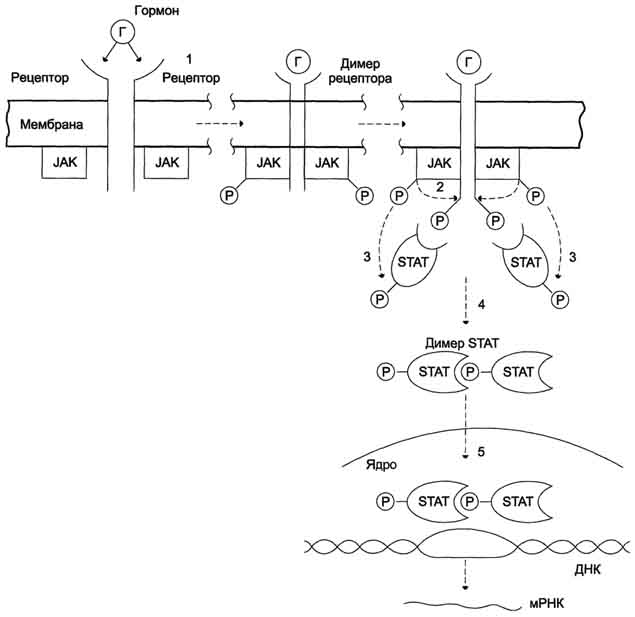
G-белки (ГТФ-связывающие белки) - универсальные посредники при передаче сигналов от рецепторов к ферментам клеточной мембраны, катализирующим образование вторичных посредников гормонального сигнала. G-белки - олигомеры, состоящие из α, β и γ-субъединиц. Состав димеров βγ незначительно различаются в разных тканях, но в пределах одной клетки все G-белки, как правило, имеют одинаковый комплект βγ-субъединиц. Поэтому G-белки принято различать по их α-субъединицам. Выявлено 16 генов, кодирующих различные α-субъединицы G-белков. Некоторые из генов имеют более одного белка,, вследствие альтернативного сплайсинга РНК.
Каждая α-субъединица в составе G-белка имеет специфические центры:
связывания ГТФ или ГДФ;
взаимодействия с рецептором;
связывания с βγ-субъединицами;
фосфорилирования под действием протеинкиназы С;
взаимодействия с ферментом аденилатциклазой или фосфолипазой С.
В структуре G-белков отсутствуют α-спиральные, пронизывающие мембрану домены. G-белки относят к группе "заякоренных" белков. 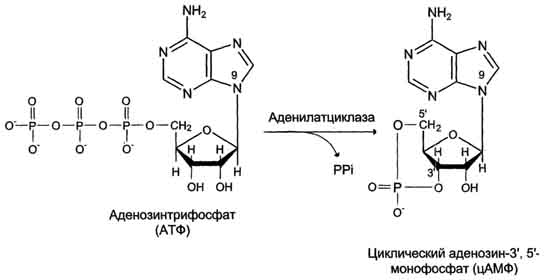 Образование циклического аденозинмонофосфата (цАМФ). Образование циклического аденозинмонофосфата (цАМФ).
Фермент аденилатциклаза, катализирующий превращение АТФ в цАМФ , - ключевой фермент аденилатциклазной системы передачи сигнала. Аденилатциклаза обнаружена во всех типах клеток.
Фермент относят к группе интегральных белков клеточной мембраны, он имеет 12 трансмембранных доменов. Внеклеточные фрагменты аденилатциклазы гликозилированы. Цитоплазматические домены аденилатциклазы имеют два каталитических центра, ответственных за образование цАМФ - вторичного посредника, участвующего в регуляции активности фермента протеинкиназы А.
Все полярные сигнальные молекулы, действующие на клетку-мишень через мембранные рецепторы, осуществляют свою биологическую функцию путём фосфорилирования специфических белков и ферментов, регулирующих метаболизм в клетке. Фосфорилирование изменяет (увеличивает или уменьшает) их активность. Катализируют фосфорилирование белков (протеинов) протеинкиназы по аминокислотным остаткам серина, треонина, тирозина. Протеинкиназы могут быть субъединицей мембранного рецептора, например тирозиновая протеинкиназа рецептора инсулина, активность которой регулируется гормоном. Другая группа - Протеинкиназы, регулируемые вторичными вестниками гормонального сигнала (цАМФ, цГМФ, Са2+, ДАТ), например протеинкиназа А, протеинкиназа С, протеинкиназа G, кальмодулинзависимые Протеинкиназы и др.
1. Протеинкиназы А
Протеинкиназы А (цАМФ-стимулируемые) участвуют в аденилатциклазной системе передачи сигнала. Протеинкиназа А состоит из 4 субъединиц R2C2 - двух регуляторных субъединиц (R2) и двух каталитических (С2. Комплекс R2C2 нe обладает ферментативной активностью.
Комплекс R2C2 разными способами прикрепляется к мембране. Некоторые формы Протеинкиназы А "заякориваются" с помощью алифатического остатка миристиновой кислоты каталитических субъединиц. Во многих тканях протеинкиназа А связана с "заякоренным" белком AKAPS (от англ. cAMP-dependent protein kinase anchoring proteins). AKAPs имеет центр связывания для регуляторных субъединиц Протеинкиназы А. С помощью белка AKAPS протеинкиназа А связывается с мембраной в области локализации ферментов, катализирующих образование цАМФ (аденилатциклаза) или его гидролиз (фосфодиэс-тераза), а также белков, в регуляции активности которых фермент принимает участие, например потенциалзависимые Са2+-каналы.
Регуляторные субъединицы Протеинкиназы А имеют специфические центры для связывания цАМФ. Присоединение цАМФ к регуляторным субъединицам приводит к изменению конформации последних и снижению сродства к каталитическим субъединицам С, происходит диссоциация по схеме:
цАМФ4 + R2C2 → цАМФ4R2+ С + С
3.Протеинкиназы G
В отличие от Протеинкиназы А, протеинкиназа G присутствует не во всех тканях, её обнаруживают в лёгких, мозжечке, гладких мышцах и тромбоцитах. Изоформы Протеинкиназы G могут быть связаны с мембраной или находиться в цитоплазме. Растворимая протеинкиназа G состоит из двух идентичных субъединиц, каждая из которых имеет два центра для связывания цГМФ. Присоединение цГМФ к регуляторным центрам вызывает конформационные изменения субъединиц и повышает каталитическую активность фермента. Протеинкиназа G, подобно протеинкиназе А и С, специфична в отношении определённых белковых субстратов, которые она фосфорилирует по остаткам серина и треонина.
|
Фосфатидилинозитольный цикл как механизм внутриклеточной коммуникации. Инозитолтрифосфаты и диацилглицерол- вторичные посредники в передачи сигнала
Это еще одна система вторичных мессенджеров, используемая G-белокассоциированными мембранными рецепторами, которая применяет для передачи сигнала продукты реакции расщепления одного из фосфолипидных компонентов клеточной мембраны — фосфатидилинозитола. Эту реакцию катализирует фосфолипаза С — фермент, который связан с мембраной и активируется под влиянием G-белка. После связывания гормона с рецептором фосфолипаза С расщепляет фосфатидилинозитол на диацилглицерин (ДАГ) и инозитолтрифосфат, каждое из этих веществ индуцирует клеточный ответ. Инозитолтрифосфат переходит в цитоплазму клетки и, взаимодействуя с эндоплазматическим ретикулумом, стимулирует выброс кальция в цитоплазму. Увеличение концентрации кальция в цитоплазме является одним из основных способов стимуляции различных клеточных процессов посредством активации кальцийзависимых ферментов.
В отличие от инозитолтрифосфата диацилглицерин остается в связанном состоянии на внутренней стороне клеточной мембраны, где он активирует мембранную протеинкиназу С (РКС). Активация протеинкипазы С происходит только под воздействием ДАГ в присутствии повышенных концентраций кальция в цитоплазме, т. е. действие инозитолтрифосфата и ДАГ являются синергичными. Как и другие киназы, РКС осуществляет активацию ферментов клетки путем их фосфорилирования.
Процессы, стимулированные фосфатидилинозитольной системой передачи сигнала, затухают после дефосфорилирования инозитолтрифосфата и превращения его в ииозитол, а также инактивации ДАГ путем фосфорилирования этого соединения. Снижение концентрации ионов кальция в цитоплазме к исходному уровню приводит к подавлению активности внутриклеточных ферментов, стимулированных РКС.
Инозитолфосфатная система
Функционирование инозитолфосфатной системы трансмембранной передачи сигнала обеспечивают: R (рецептор), фосфолипаза С, Gplc - белок, активирующий фосфолипазу С, белки и ферменты мембран и цитозоля. 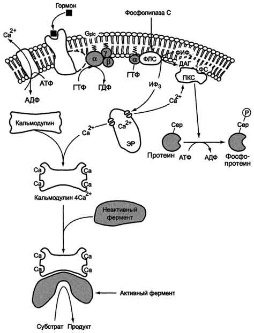
Присутствующие в цитозоле инозитол-1,4,5-трифосфат (ИФ3) и диацилглицерол (ДАТ) в мембране могут в результате серии реакций опять превращаться в фосфатидилинозитол-4,5-бисфосфат (ФИФ2). Ферменты катализирующие восстановление фосфолипида, активируются фосфорилированием протеинкиназой С. 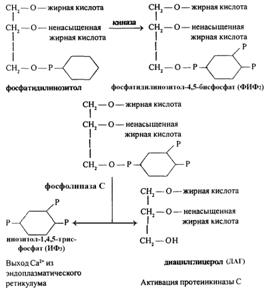
Фосфоинозитольный путь передачи сигнала
Диацилглицерол фосфорилируется диацилглицеролкиназой в[A54] фосфатидную кислоту (реакция требует присутствия АТФ). Фос-фатидная кислота взаимодействует с цитидинтрифосфатом и образует цитидиндиацилглицеролдифосфат. Это соединение после рекомбинации с инозитом восстанавливает гидролизуемые фосфодиэстеразой фосфоинозитиды. Инозит, необходимый для этой реакции, образуется из инозитолмонофосфата. Реакция катализируется инозитол-1-монофосфатазой, активность которой блокируется ионами лития.
Именно этим процессом объясняется эффективное лечение ионами лития маниакально-депрессивных психозов и некоторых других заболеваний нервной системы. Блокада литием инозитол-1-монофосфатазы замедляет синтез в организме инозита и ослабляет протекающие в нейронах процессы, зависящие от метаболизма фосфоинозитидов.
Диацилглицерол (ДАГ) выступает в качестве вторичного мессенджера, так как он инициирует механизмы, в результате которых активируются два типа протеинкиназ: протеинкиназа С и цГМФ-зависимая киназа. При этом фосфолипаза С играет ключевую роль в процессе переноса сигналов с рецепторов, которые непосредственно не связаны с аденилатциклазой, но регулируют скорость метаболизма фосфоинозитидов[A55] .
Диацилглицерол может подвергаться дальнейшей деградации под действием диацилглицероллипазы до арахидоновой кислоты, которая превращается в разнообразные биологически активных метаболиты, в том числе эйкозаноиды и простагландины.
Суммируя сказанное выше, можно утверждать, что при функционировании рассмотренной регуляторной системы образуются по меньшей мере три вторичных посредника: диацилглицерол, ИФ3 и арахидоновая кислота. Каждый из них выполняет специфические функции, включая увеличение содержания внутриклеточного Са2+ и активацию Са2+-зависимых протеинкиназ.
|
Ионы кальция- вторичный посредник в передачи сигнала. Регуляция уровня концентрации ионов кальция в цитоплазме клетки. Биологическая роль кальция. Кальмодулин. Протеинкиназа С и кальмодулин-зависимые протеинкиназы.
Уровень ионов кальция. Концентрация ионов Са2+ в цитоплазме нестимулированной клетки очень низка (10100 нМ). Низкий уровень поддерживается кальциевыми АТФ-азами(кальциевыми насосами) и натрийкальциевыми обменниками. Резкое повышение концентрации ионов Са2+ в цитоплазме (до500-1000нМ) происходит в результате открывания кальциевых каналов плазматической мембраны или внутриклеточных кальциевых депо (гладкого и шероховатого эндоплазматического ретикулума). Открывание каналов может быть вызвано деполяризацией мембран или действием сигнальных веществ, нейромедиаторов (глутамат и АТФ, см. с. 342), вторичных мессенджеров (ИФ3 и цАМФ), а также вещества растительного происхождения рианодина.
При высокой концентрации в цитоплазме ионы Са2+ оказывает на клетку цитотоксическое действие.
Действие кальция опосредовано специальными Са2+-связывающимибелками («кальциевыми сенсорами»), к которым принадлежат аннексин, кальмодулин и тропонин . Кальмодулин — сравнительно небольшой белок (17 кДа) — присутствует во всех животных клетках. При связывании четырех ионов Са2+ (на схеме голубые кружочки) кальмодулин переходит в активную форму, способную взаимодействовать с многочисленными белками. За счет активации кальмодулина ионы Са2+ оказывают влияние на активность ферментов, ионных насосов и компонентов цитоскелета.
Протеинкиназа С
Протеинкиназы С — это семейство протеинкиназ, содержащее порядка десяти изоферментов, которые классифицируют по вторичным посредникам на три семейства: традиционные, или классические, оригинальные, или нестандартные и нетипичные. Традиционным протеинкиназам С для активации требуется Ca, диацилглицерол или фосфатидилхолин.
Оригинальные протеинкиназы С активируются молекулами диацилглицерола, и не требуют Ca. Традиционные и оригинальные протеинкиназы С активируются через сходные пути сигнальной трансдукции, например, с помощью фосфолипазы С. Нетипичные изоформы, не требуют ни Ca, ни диацилглицерола для активации.
Все протеинкиназы С состоят из регуляторного и каталитического доменов, связанных шарнирной областью. Каталитические районы высоко консервативны между разными изоформами, и значительно отличаются от каталитических районов других серин-треониновыхпротеинкиназ. Консервативность каталитических доменов связано с выполняемыми функциями, различия в регуляторных районах обуславливают различия во вторичных посредниках.
аминокислот в молекуле протеинкиназы С сходна с таковой для протеинкиназы А, и содержит остатки основных аминокислот вблизи остатков серина и треонина, подвергающихся фосфорилированию. Субстратами протеинкиназы С являются следующие белки: MAP-киназы,Raf-киназы,MARCKS.Белки-субстратыпротеинкиназы С играют важную роль в поддержании формы клеток, способности к движению, секреции, трансмембранном транспорте, регуляции клеточного цикла. MARCKS вовлечены в процессы экзоцитоза некоторых секреторных пузырьков, содержащих, муцин и хромафин. MARCKS — кислые белки, содержат большое количество остатков аланина, глицина, пролина и глутаминовой кислоты. MARCKS связаныN-концомс липидами мембраны, регулируются ионами Ca, кальмодулином, протеинкиназой С.
Ca/кальмодулин — зависимые протеинкиназы
Ca2+/кальмодулин-зависимаякиназа II
Са/кальмодулин-зависимыекиназы, или СаМ киназы, регулируются Са/кальмодулиновым комплексом. СаМ киназы классифицируют на два класса: специализированные СаМ киназы и многофункциональные СаМ киназы, порядка 2 % белков головного мозга представлены СаМ второго типа.
Кальмодулин — это вездесущий, кальций-связывающийбелок, который связывается с многими другими белками и регулирует их активность. Это маленький кислый белок, состоит из 148 аминокислотных остатков, содержит четыре домена связывания кальция.
СаМ служит промежуточным звеном в воспалении, апоптозе, мышечных сокращениях, развитии кратковременной и длительной памяти, росте нервов и иммунном ответе. Кальмодулин экспрессируется во многих типах клеток и находится в цитоплазме, внутри органелл, а также находится в плазматической мембране и мембранах органелл. Многие белки, которые связываются с кальмодулином, не могут сами связывать кальций и используют кальмодулин как «датчик» кальция и компонент системы передачи сигнала.
|
Механизм действия стероидных гормонов. Ядерные рецепторы гормонов.
Стероидные гормоны легко проникают внутрь клетки через поверхностную плазматическую мембрану в силу своей липофильности и взаимодействуют в цитозоле со специфическими рецепторами. В цитозоле образуется комплекс «гормон-рецептор»,движущейся в ядро. В ядре комплекс распадается и гормон взаимодействует с ядерным хроматином. В результате этого происходит взаимодействие с ДНК, а затем — индукция матричной РНК. первый этап действия стероидных гормонов — активация транскрипции. Одновременно происходит активация РНКполимеразы, осуществляющего синтез рибосомальной РНК(р-РНК).За счет этого образуется дополнительное количество рибосом, которые связываются с мембранами эндоплазматического ретикулума и образуют полисомы. Вследствие всего комплекса событий (транскрипции и трансляции) через2-3часа после воздействия стероида наблюдается усиленный синтез индуцированных белков. В одной клетке стероид влияет на синтез не более5-7белков. Известно также, что в одной и той же клетке стероид может вызвать индукцию синтеза одного белка и репрессию синтеза иного белка. Это происходит вследствие того, что рецепторы данного стероида неоднородны.
Липофильные молекулы стероидов свободно проникают из крови вклетку-мишеньи быстро связываются в цитоплазме с рецепторными белками. После связывания рецептора с гормоном резко повышается его сродство к ядерному хроматину. Повышение сродства рецептора к хроматину коррелирует с его физической трансформацией, при
которой от него отделяется бтш 90 , и рецептор выявляется в форме 4S.
Взаимодействие стероидных рецепторов с ДНК осуществляется через ДНКсвязывающие участки рецептора . С другой стороны, в составе ДНК имеются специфические гормон-чувствительныеэлементы, примыкающие, как правило, с 5 - конца кгормон-зависимымгенам. Эти элементы усиливают транскрипцию, работая на расстоянии10#-10#пар оснований вниз и вверх от промоторных участков соответствующих генов.
Для рецептора прогестерона и рецептора эстрадиола показано, что с палиндромным гормончувствительным участком связываются две рецепторные молекулы, образуя функциональный димер. При этом рецептор прогестерона способен образовывать как гомодимеры (АА или ВВ), так и гетеродимеры (АВ).
Взаимодействие стероид-рецепторныхкомплексов с хроматином может приводить к изменению структуры хроматина и тем самым регулировать доступ к определенным участкам ДНК белков, участвующих в регуляции транскрипции ( транскрипционный фактор ). Кроме того, это взаимодействие может влиять на активность самих транскрипционных факторов. Лимитируя или повышая активность рецепторов, они могут играть решающую роль в осуществлении эффектов стероидов.
|
Классификация гормонов по химическому строению и биологическим функциям. Номенклатура гормонов.
Классификация гормонов
по химическому строению
Пептидные гормоны
|
Стероиды
|
Производные аминокислот
|
Адренокортикотропный гормон (кортикотропин, АКТГ)
|
Альдостерон
|
Адреналин
|
Гормон роста (соматотропин, ГР, СТГ)
|
Кортизол
|
Норадреналин
|
Тиреотропный гормон (тиреотропин, ТТГ)
|
Кальцитриол
|
Трийодтиронин (Т3)
|
Лактогенный гормон (пролактин, ЛТГ)
|
Тестостерон
|
Тироксин (Т4)
|
Лютеинизирующий гормон (лютропин, ЛГ)
|
Эстрадиол
|
|
Фолликулостимулирующий гормон (ФСГ)
|
Прогестерон
|
|
Меланоцитстимулирующий гормон (МСГ)
|
|
|
Хорионический гонадотропин (ХГ)
|
|
|
Антидиуретический гормон (вазопрессин, АДГ)
|
|
|
Окситоцин
|
|
|
Паратиреоидный гормон (паратгормон, ПТГ)
|
|
|
Кальцитонин
|
|
|
Инсулин
|
|
|
Глюкагон
|
|
| | |
|
|
 Скачать 0.64 Mb.
Скачать 0.64 Mb.