Хирургия. темы семестр. Основные структурные подразделения хирургического отделения Основные структурные подразделения хирургического отделения
 Скачать 5.73 Mb. Скачать 5.73 Mb.
|
Основные пути распространения инфекцииИнфекцию, попадающую в рану из внешней среды, называют экзогенной. Основные её источники: воздух с частицами пыли, на которых оседают микроорганизмы; выделения из носоглотки и верхних дыха- тельных путей больных, посетителей и медперсонала; раневое отделяемое из гнойных ран, различные бытовые загрязнения.  Рис. Основные пути распространения инфекции В рану больному экзогенная инфекция может проникнуть тремя основными путями: воздушно-капельным, контактным и импланта- ционным. Инфекцию, попадающую в рану из организма самого больного, называют эндогенной. Основные её источники: кожа пациента, внутренние органы, патологические очаги. Устройство операционного блока, принцип зональности, порядок работы Устройство операционного блока, принцип зональности Для предотвращения загрязнённости воздуха в непосредственной близости от операционной раны при организации операционного блока соблюдают принцип зональности. Существует четыре зоны стерильности в операционной.
• Зона абсолютной стерильности. • Зона относительной стерильности. • Зона ограниченного режима. • Зона общего больничного режима (нестерильная). Основные помещения операционной и их распределение по зонам стерильности представлены на рис. 2-2. Порядок работы Основной принцип в работе операционного блока - строжайшее соблюдение правил асептики. В связи с этим выделяют разные виды операционных: плановые и экстренные, чистые и гнойные. При составлении расписания операций в каждой операционной их порядок определяют в соответствии со степенью инфицированности: от менее инфицированной к более инфицированной. В операционной не должно быть ненужной мебели и техники, до минимума сокращают объём движений и хождений, вызывающих воз- никновение турбулентных потоков воздуха. Важным считают ограничение разговоров. В покое за 1 ч человек выделяет 10-100 тыс микробных тел, а при разговоре - до 1 млн. В операционной не должно быть лишних людей. После операции количество микроорганизмов в 1 м3 воздуха возрастает в 3-5 раз, а при присутствии, например, группы студентов из 5-6 человек - в 20-30 раз. Поэтому для просмотра операций устраивают специальные колпаки, используют систему видеотехники. Виды уборки операционной В операционной, как и в перевязочной, существует несколько видов уборки. В начале рабочего дня - вытирание пыли с горизонтальных поверхностей, подготовка стерильного стола и необходимых инструментов. Текущая - периодическое удаление во время операции использованного перевязочного материала и белья из тазов, помещение резецированных органов в специальные ёмкости и вынос их из операционной, постоянный контроль за чистотой помещения и устранение возникающих загрязнений: вытирание пола, столов и пр.
После каждой операции - вынос из операционной всех отработанных материалов, протирание операционного стола раствором антисептика, смена белья, освобождение бросалок, при необходимости - мытьё пола, горизонтальных поверхностей, подготовка инструментов и стерильного столика для следующей операции. В конце рабочего дня - дополнительно к предыдущему пункту обязательно проводят мытьё полов и горизонтальных поверхностей, выносят весь перевязочный материал и бельё, включают бактерицидные лампы. Генеральная - 1 раз в неделю операционный зал или перевязочную моют с использованием антисептических растворов, обрабатывают все поверхности: пол, стены, потолки, лампы; передвижное оборудование вывозят и обрабатывают в другом помещении, а после уборки устанавливают на рабочее место. Разделение потоков больныхРазделение «чистых» и «гнойных» больных - основной принцип асептики. Применение всех самых современных способов профилак- тики инфекции будет сведено на нет, если в одной палате чистый пос- леоперационный больной будет лежать рядом с гнойным! В зависимости от мощности стационара существуют разные способы решения этой проблемы. При наличии в больнице только одного хирургического отделения в нём специально выделяют палаты для гнойных больных, должно быть две перевязочные: чистая и гнойная, причём гнойная должна располагаться в том же отсеке, что и палаты для гнойных больных. Желательно также выделить палату для послеоперационных больных - в противоположной части отделения. Если в больнице несколько хирургических отделений, их разделяют на чистые и гнойные. В масштабе крупных городов возможно даже разделение стационаров на чистые и гнойные. При этом при госпитализации больных врач скорой помощи знает, какие чистые и какие гнойные стационары по оказанию экстренной хирургической помощи сегодня дежурят, и в соответствии с характером заболевания решает, куда везти больного. Общие принципы и способы стерилизации Стерилизация (sterilis - бесплодный, лат.) - полное освобождение какого-либо предмета от микроорганизмов и их спор путём воздействия на него физическими или химическими факторами.
Стерилизация - основа асептики. Методы и средства стерилизации должны обеспечивать гибель всех, в том числе высокоустойчивых, микроорганизмов (как патогенных, так и непатогенных). Наиболее устойчивы споры микроорганизмов. Поэтому возможность применения для стерилизации определённых средств оценивают наличием у них спороцидной активности, проявляемой в приемлемые сроки. Используемые в практике методы и средства стерилизации должны обладать следующими свойствами: • уничтожать микроорганизмы и их споры; • быть безопасными для больных и медицинского персонала; • не ухудшать рабочие свойства изделий. В современной асептике используют физические и химические методы стерилизации. Выбор того или иного способа стерилизации зависит, прежде всего, от свойств изделия. Основными считают физические методы стерилизации. Физические методы стерилизации К физическим методам относят термические способы - стерилизацию паром под давлением (автоклавирование), стерилизацию горячим воздухом (сухим жаром), а также лучевую стерилизацию. Стерилизация паром под давлением (автоклавирование) При этом способе стерилизации действующим агентом служит горячий пар. Стерилизацию просто текучим паром в настоящее время не используют, так как температура пара в обычных условиях (100 ?С) не достаточна для уничтожения всех микробов. В автоклаве (аппарат для стерилизации паром под давлением) возможно нагревание воды при повышенном давлении (рис. 2-4). Это повышает точку кипения воды и соответственно температуру пара до 132,9 ?С (при давлении 2 атм). 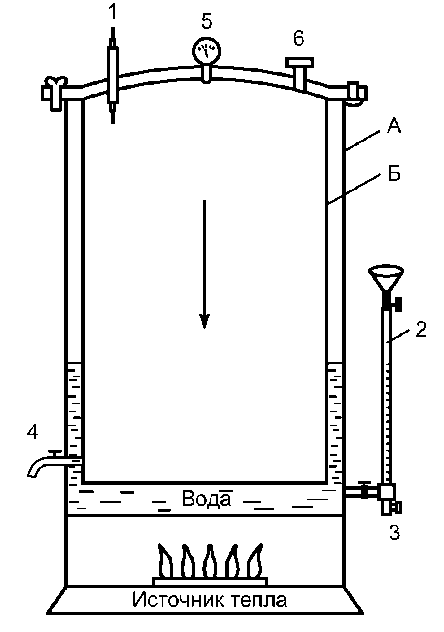 Рис. 2-4. Автоклав (схема). Аи Б - наружная и внутренняя стенки автоклава; 1 - термометр; 2 - водомерное стекло; 3 - впускной кран; 4 - выпускной кран; 5 - манометр; 6 - предохранительный клапан
Хирургические инструменты, перевязочный материал, бельё и другие материалы загружают в автоклав в специальных металлических коробках - биксах Шиммельбуша (рис. 2-5). Биксы имеют боковые отверстия, которые перед стерилизацией открывают. Крышку бикса плотно закрывают. 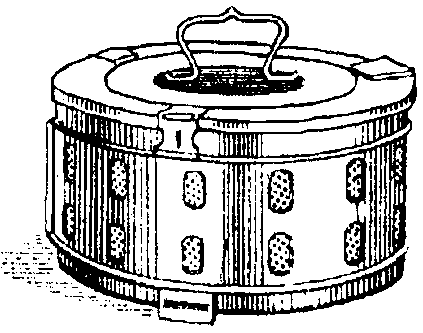 Рис. 2-5. Бикс Шиммельбуша После загрузки биксов автоклав закрывают герметичной крышкой и проводят необходимые манипуляции для начала его ра- боты в определённом режиме. Работу автоклава контролируют при помощи показателей манометра и термометра. Существует три режима стерилизации: • при давлении 1,1 атм (t = 119,6 ?С) - 1 ч; • при давлении 1,5 атм (t = 126,8 ?С) - 45 мин; • при давлении 2 атм (t = 132,9 ?С) - 30 мин. По окончании стерилизации биксы некоторое время остаются в горячем автоклаве для просушки при немного приоткрытой дверце. При извлечении биксов из автоклава закрывают отверстия в стенках биксов и отмечают дату стерилизации (обычно на прикреплённом к биксу кусочке клеёнки). Закрытый бикс сохраняет стерильность находящихся в нём предметов в течение 72 ч. Стерилизация горячим воздухом (сухим жаром) Действующим агентом при этом способе стерилизации служит нагретый воздух. Стерилизацию осуществляют в специальных аппаратах - сухожаровых шкафах-стерилизаторах (рис. 2-6). Инструменты укладывают на полки шкафа-стерилизатора и сначала высушивают в течение 30 мин при температуре 80 ?С с приоткрытой дверцей. Стерилизацию осуществляют при закрытой дверце в течение 1 ч при температуре 180 ?С. После этого при остывании шкафа-стери- лизатора до 60-70 ?С дверцу приоткрывают, при окончательном остывании разгружают камеру со стерильным инструментарием. 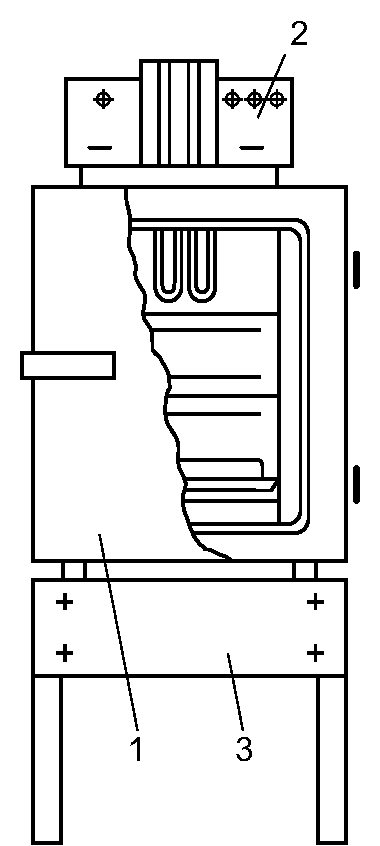 Рис. 2-6. Сухожаровой шкаф-стерилизатор (схема): 1 - кор- пус, 2 - пульт управления с термометрами и терморегуляторами; 3 - подставка
Стерилизация в автоклаве и сухожаровом шкафу в настоящее время стала главным, наиболее надёжным способом стерилизации хи- рургических инструментов. В современных стационарах обычно выделяют специальные центральные стерилизационные отделения, где с помощью этих двух методов стерилизуют наиболее простые и часто используемые предметы и инструменты всех отделений больницы (шприцы, иглы, простые хирургические наборы, зонды, катетеры и пр.). Лучевая стерилизация Антимикробную обработку можно осуществить с помощью ионизирующего излучения (γ-лучи), ультрафиолетовых лучей и ультразвука. Наибольшее применение в наше время получила стерилизация γ-лучами. Используют изотопы Со60 и Cs137. Доза проникающей радиации должна быть весьма значительной - до 20-25 мкГр, что требует соблюдения строгих мер безопасности. В связи с этим лучевую стерилизацию проводят в специальных помещениях, это заводской метод (непосредственно в стационарах её не проводят). Стерилизацию инструментов и прочих материалов осуществляют в герметичных упаковках, при целостности последних стериль- ность сохраняется до 5 лет. Благодаря герметичной упаковке удобно хранить и использовать инструменты (необходимо просто вскрыть упаковку). Метод выгоден для стерилизации несложных одноразовых инструментов (шприцев, шовного материала, катетеров, зондов, систем для переливания крови, перчаток и пр.) и получает всё более широкое распространение. Во многом это объясняется тем, что при лучевой стерилизации не изменяются свойства стерилизуемых объектов. Химические методы стерилизации К химическим методам относят газовую стерилизацию и стерилизацию растворами антисептиков. Газовая стерилизация Газовую стерилизацию осуществляют в специальных герметичных камерах. Стерилизующими агентами служат пары формалина (на дно камеры кладут таблетки формальдегида) или окись этилена. Инструменты, уложенные на сетку, считают стерильными через 6-48 ч (в зависимости от компонентов газовой смеси и температуры в камере). Отличительная особенность метода - его минимальное отрицательное влияние на качество инструментария, поэтому способ используют прежде всего для стерилизации оптических, особо точных и дорогостоящих инструментов.
В настоящее время всё большее распространение находит способ стерилизации в озоново-воздушной камере. Она состоит из генера- тора озона и рабочей части, куда помещают стерилизуемые предметы. Активным агентом служит озон, который смешивается с воздухом. В камере поддерживают температуру 40 ?С. Время стерилизации 90 мин. Преимущество этого метода состоит в его надёжности, быстроте, сохранении всех свойств обрабатываемых материалов и абсолютной экологической безопасности. В отличие от лучевой стерилизации, метод используют непосредственно в стационарах. Стерилизация растворами антисептиков Стерилизацию растворами химических антисептиков так же, как лучевую и газовую стерилизацию, относят к холодным способам стерилизации. Она не приводит к затуплению инструментов, в связи с чем её прежде всего применяют для обработки режущих хирургических инструментов. Для стерилизации чаще используют 6% раствор перекиси водорода. При замачивании в перекиси водорода инструменты считаются стерильными через 6 ч. Стерилизация хирургических инструментов Обработка всех инструментов включает последовательное выполнение двух этапов: предстерилизационной обработки и собственно стерилизации. Способ стерилизации прежде всего зависит от вида ин- струментов. Предстерилизационная подготовка Предстерилизационная подготовка складывается из обеззараживания, мытья и высушивания. Ей подвергают все виды инструментов. Вид и объём предстерилизационной обработки в недавнем прошлом зависел от степени инфицированности инструментов. Так, раньше существенно отличалась обработка инструментов после чистых операций (перевязок), гнойных операций, операций у больных, перенёсших гепатит и относимых к группе риска по СПИДу. Однако в настоящее время, учитывая высокую опасность распространения ВИЧ-инфекции, правила предстерилизационной подготовки ужес- точены и приравнены к способам обработки инструментов, предусматривающим безусловную гарантию уничтожения ВИЧ. Следует отметить, что инструменты после гнойных операций, операций у больных, перенёсших в течение последних 5 лет гепатит, а также при риске ВИЧ-инфекции обрабатывают отдельно от других.
Все процедуры предстерилизационной обработки обязательно выполняют в перчатках! Обеззараживание Непосредственно после использования инструменты погружают в ёмкость с дезинфицирующими средствами (накопитель). При этом они должны быть полностью погружены в раствор. В качестве дезинфицирующих средств используют 3% раствор хлорамина (экспозиция 40- 60 мин) или 6% раствор перекиси водорода (экспозиция 90 мин). После обеззараживания инструменты промывают проточной водой. Мытьё Инструменты погружают в специальный моющий (щелочной) раствор, в его состав входят моющее средство (стиральный порошок), пероксид водорода и вода. Температура раствора 50-60 ?С, экспозиция 20 мин. После замачивания инструменты моют щётками в том же растворе, а затем - в проточной воде. Высушивание можно осуществлять естественным путём. В последнее время, особенно при последующей стерилизации горячим воздухом, инструменты сушат в сухожаровом шкафу при температуре 80 ?С в течение 30 мин. После высушивания инструменты готовы к стерилизации. Собственно стерилизация Перевязочный материал и бельё стерилизуют автоклавированием при стандартных режимах. Перед стерилизацией перевязочный материал и бельё укладывают в биксы. Существует три основных вида укладки бикса: универсальная, целенаправленная и видовая укладки.
Универсальная укладка. Обычно используют при работе в перевязочной и при малых операциях. Бикс условно разделяют на секторы, каждый из них заполняют определённым видом перевязочного материала или белья: в один сектор помещают салфетки, в другой - шарики, в третий - тампоны и т.д. Целенаправленная укладка. Предназначена для выполнения типичных манипуляций, процедур и малых операций. Например, укладка для трахеостомии, катетеризации подключичной вены, перидуральной анестезии и пр. В бикс укладывают все инструменты, перевязочный материал и бельё, необходимые для осуществления процедуры. Видовая укладка. Обычно используют в операционных, где необходимо большое количество стерильного материала. При этом в один бикс, например, укладывают хирургические халаты, в другой - простыни, в третий - салфетки и т.д. В небольшом количестве используют перевязочный материал в упаковках, прошедший лучевую стерилизацию. Существуют и специальные наборы операционного белья одноразового использования (халаты и простыни), изготовленного из синтетических тканей, также подвергшихся лучевой стерилизации. Обработка рук хирурга Обработка (мытьё) рук хирурга - очень важная процедура. Существуют определённые правила мытья рук. Классические методы обработки рук Спасокукоцкого-Кочерги- на, Альфельда, Фюрбрингера и другие имеют лишь исторический интерес, их в настоящее время не применяют. Современные методы обработки рук хирурга Обработка рук хирурга состоит из двух этапов: мытья рук и воздействия антисептическими средствами. Мытьё рук. Применение современных способов предполагает пер- воначальное мытьё рук с мылом или с помощью жидких моющих средств (при отсутствии бытового загрязнения рук). Воздействие антисептических средств. Используемые для обработки рук химические антисептики должны иметь следующие свойства:
• обладать сильным антисептическим действием; • быть безвредными для кожи рук хирурга; • быть доступными и дешёвыми (так как их применяют в больших объёмах). Современные способы обработки рук не требуют специального дубления (используют плёнкообразующие антисептики или антисеп- тики с элементом дубления). Руки тщательно обрабатывают от кончиков пальцев до верхней трети предплечья. При этом соблюдают определённую последователь- ность, в основе которой лежит принцип - не касаться обработанными участками рук менее чистой кожи и предметов. Основными современными средствами обработки рук служат первомур, хлоргексидин, дегмин (дегмицид), церигель, АХД, евросепт и пр. Обработка рук первомуром Первомур (предложен в 1967 г. Ф.Ю. Рачинским и В.Т. Овсипяном) - смесь муравьиной кислоты, перекиси водорода и воды. При соединении компонентов образуется надмуравьиная кислота - мощный антисептик, вызывающий образование тончайшей плён- ки на поверхности кожи, закрывающей поры и исключающей необходимость дубления. Используют 2,4% раствор, приготовленный ex temporo. Методика: мытьё рук проводят в тазах в течение 1 мин, после чего руки высушивают стерильной салфеткой. Преимущество метода - его быстрота. Недостаток: возможно развитие дерматита на руках хирурга. Обработка рук хлоргексидином Используют 0,5% спиртовой раствор хлоргексидина, что исключает необходимость дополнительного воздействия спиртом с целью дубления, а также высушивания вследствие быстрого испарения спиртового раствора. Методика: руки дважды обрабатывают тампоном, смоченным антисептиком, в течение 2-3 мин. Относительный недостаток метода - его длительность. Обработка дегмином и дегмицидом Эти антисептики относят к группе поверхностно-активных веществ (детергентов).
Методика: обработку проводят в тазах в течение 5-7 мин, после чего руки высушивают стерильной салфеткой. Недостаток метода - его длительность. Обработка АХД, АХД-специаль, евросептом Действующим началом этих комбинированных антисептиков служит этанол, эфир полиольной жирной кислоты, хлоргексидин. Методика: препараты находятся в специальных флаконах, из них при нажатии на специальный рычаг определённая доза препаратов выливается на руки хирурга, и он втирает раствор в кожу рук в течение 2-3 мин. Процедуру повторяют дважды. В дополнительном дублении и высушивании нет необходимости. Метод практически ли- шён недостатков, в настоящее время его считают самым прогрессивным и распространённым. Несмотря на существующие способы обработки рук, в настоящее время все операции и манипуляции при контакте с кровью больного хирурги должны выполнять только в стерильных перчатках! При необходимости выполнения небольших манипуляций или в критических ситуациях допускают надевание стерильных перчаток без предшествующей обработки рук. При выполнении обычных хирургических операций так Обработка операционного поля Предварительно проводят санитарно-гигиеническую обработку (мытьё в ванне или под душем, смену постельного и нательного белья). В день операции сбривают волосяной покров в области операционного поля (сухое бритьё). На операционном столе операционное поле обрабатывают химическими антисептиками (органическими йодсодержащими препаратами, хлоргексидином, первомуром, АХД, стерильными клеящимися плёнками). При этом соблюдают следующие правила: • широкая обработка; • последовательность «от центра - к периферии»;
• загрязнённые участки обрабатывают в последнюю очередь; • многократность обработки в ходе операции (правило Филончи- кова-Гроссиха): обработку кожи выполняют перед отграничением стерильным бельём, непосредственно перед разрезом, а также перед наложением кожных швов и после него. Способы контроля стерильности Все действия по обработке и стерилизации инструментов, белья и прочего подлежат обязательному контролю. Контролируют как эффективность стерилизации, так и качество предстерилизационной подготовки. Контроль стерильности Методы контроля стерильности делят на прямой и непрямые. Прямой метод Прямой метод контроля стерильности - бактериологическое исследование: специальной стерильной палочкой проводят по стерильным инструментам (коже рук хирурга или операционного поля, опе- рационному белью и пр.), после чего помещают её в стерильную пробирку и отправляют в бактериологическую лабораторию, где проводят посев на различные питательные среды и таким образом определяют бактериальную загрязнённость. Бактериологический метод контроля стерильности наиболее точен. Отрицательный момент - длительность проведения исследования: результат посева бывает готов лишь через 3-5 сут, а использо- вать инструменты нужно непосредственно после стерилизации. Поэтому бактериологическое исследование проводят в плановом порядке и по его результатам судят о методических погрешностях в работе медицинского персонала или дефектах используемого оборудования. По существующим нормативам, несколько различающимся для разного вида инструментария, бактериологическое исследование необходимо проводить 1 раз в 7-10 дней. Кроме того, 2 раза в год подобные исследования во всех подразделениях больницы проводят районные и городские санитарно-эпидемиологические службы.
Непрямые методы Непрямые методы контроля используют в основном при термических способах стерилизации. С их помощью можно определить величину температуры, при которой проводили обработку, не давая точ- ный ответ на вопрос о присутствии или отсутствии микрофлоры. Преимущество непрямых методов в быстроте получения результата и возможности их использования при каждой стерилизации. При автоклавировании в бикс обычно укладывают ампулу (пробирку) с порошкообразным веществом, имеющим температуру плав- ления в пределах 110-120 ?С. После стерилизации при открытии бикса сестра прежде всего обращает внимание на эту ампулу: если вещество расплавилось, то материал (инструменты) можно считать стерильными, если же нет - нагревание было недостаточным и пользоваться таким материалом нельзя, так как он нестерилен. Для подобного метода наиболее часто используют бензойную кислоту (температура плавления 120 ?С), резорцин (температура плавления 119 ?С), антипирин (температура плавления 110?С). Вместо ампулы в бикс можно поместить термоиндикатор или максимальный термометр, по которому также можно определить, какова была температура во время обработки. Аналогичные непрямые способы используют при стерилизации в сухожаровом шкафу. Однако здесь применяют вещества с более вы- сокой температурой плавления (аскорбиновая кислота - 190 ?С, янтарная кислота - 190 ?С, тиомочевина - 180 ?С), другие термоиндикаторы или термометры. Контроль качества предстерилизационной обработки Для контроля качества предстерилизационной обработки используют химические вещества, с помощью которых можно обнаружить на инструментах следы неотмытой крови или остатки моющих средств. Реактивы обычно изменяют свой цвет в присутствии соответствующих веществ (крови, щелочных моющих средств). Методы используют после проведения обработки перед стерилизацией.
Для обнаружения так называемой скрытой крови наиболее часто применяют бензидиновую пробу. Для выявления следов моющих веществ используют кислотно-щелочные индикаторы, наиболее распространена фенолфталеиновая проба. Определение Антисептики Антисептика - система мероприятий, направленных на уничтожение микроорганизмов в ране, патологическом очаге, органах и тканях, а также в организме больного в целом, использующая механические и физические методы воздействия, активные химические вещества и биологические факторы. |
