ОТВЕТЫ НА БИЛЕТЫ ПО БИОЛОГИЧЕСКОЙ ХИМИИ. Отдельное спасибо ребятам со второго потока лечебного факультета 2012 г
 Скачать 2.33 Mb. Скачать 2.33 Mb.
|
|
Билет 33.
Многогранность функций белков обеспечивает способность белков строго избирательно, специфически соединяться с широким кругом разнообразных веществ. На долю белков приходится - 70-80 % в: мышцах, печени, селезёнке, почках. - 45 % во всём теле человека от сухой массы. Состав белков. Помимо углерода, кислорода, водорода, входящих в состав почти всех органических полимерных молекул, обязательным компонентом белков является азот. Содержание азота в белках довольно постоянно – 16% , поэтому иногда количество белка в биологических объектах определяют по содержанию белкового азота. Белки - самый многочисленный класс макромолекул, полипептиды, содержащие 100 и более АМК, соединённых пептидными связями. Пептидные связи – ковалентные, уникальны по размерам. Специфические особенности белков определяются - длиной пептидной цепи, различиями АМК состава, порядком чередования АМК. Аминокислотный состав белков. Помимо 20 АМК в некоторых белках обнаружены и другие АМК, а также их производные: оксипролин, оксилизин в коллагене, дийодтирозин в тироксине, γ-карбоксиглутаминовая кислота в протромбине, селеноцистеин в ГПО. Первичная структура белка - порядок, последовательность расположения АМК в полипептидной цепи. Свойства первичной структуры белка - уникальна, детерминирована генетически, её стабильность обеспечивается в основном пептидными связями, возможно участие небольшого числа дисульфидных связей, в первичной структуре детерминированы вторичная, третичная и четвертичная структуры белковой молекулы, в полипептидной цепи могут быть обнаружены разнообразные комбинации АМК: не во всех белках содержатся все 20 АМК, ни в одном белке АМК не содержатся в эквивалентных отношениях, некоторые АМК встречаются редко и в меньшем количестве (гли в 10 раз чаще, чем три). Принцип структурного подобия (в белках встречаются идентичные пептидные структуры), в состав полипептидной цепи входит 100-1000 АМК. По частоте обнаружения АМК делят на - постоянно встречающиеся, изредка встречающиеся. Для определения АМК состава белки гидролизуют. Даже небольшие изменения первичной структуры изменяют свойства белков. HbA1 - у здоровых людей, HbS - у больных серповидно-клеточной анемией. HbS в шестом положении β-цепи вместо глу имеет валин. Отличается по физическим, химическим и биологическим свойствам. Вторичная структура - пространственное расположение полипептидной цепи, поддерживаемое водородными связями С=О … Н-N между фрагментами цепи. Связи нековалентные, непрочные. Типы вторичной структуры - α-спираль - устойчивая винтовая лестница, закрученная по часовой стрелке, NН-группа остатка АМК взаимодействует с СО – группой четвёртого от него остатка, на виток приходится 3,6 АМК остатка, 5,4 Å – шаг спирали (расстояние между витками). АМК формирующие α-спираль: ала, лей, глн, цис, фен, тир, три, мет, вал, дестабилизирующие α-спираль: сер, иле, тре, глу, лиз, арг, гли, асп, нарушающие α-спираль: про, оксипролин. Белки с α-спиралью: гемоглобин, миоглобин. β-складчатость пептидные цепи располагаются параллельно друг другу в один слой, подобно листу, сложенному гармошкой. На каждой плоскости образуются пептидные связи и радикалы выходят из структуры. Полипептидные цепи могут формировать параллельные или антипараллельные β-структуры. Складчатые структуры. В белках встречаются области с нерегулярной вторичной структурой, которые называются беспорядочными клубками. Во многих белках присутствует и α-спираль и β-складчатость. Белки с β-складчатостью β-кератины (фиброин шёлка), фибриллярные белки волос, шёлка. Надвторичные структуры агрегаты полипептидных цепей, обладающих собственной вторичной структурой и образующихся в белках в результате их термодинамической или кинетической стабильности (βαβαβ-сегменты). Домен - компактная глобулярная структурная единица внутри полипептидных цепей. Домены создаются объединением и чередованием α-цепей и β-слоёв, между которыми находятся рыхлые структуры. Домены могут выполнять разные функции. Центры связывания белка с лигандом часто располагаются между доменами. Третичная структура - пространственное расположение пептидной цепи, поддерживаемое межрадикальными связями. Все биологические свойства белков связаны с сохранностью их третичной структуры. Связи дисульфидная – ковалентная, все остальные связи нековалентны: гидрофобные – между аминогруппами с неполярными радикалами (вал, мет, ала, фен, иле), водородные между полярными радикалами (OH, NH2, SH, COOH), ионные - между заряженными полярными радикалами (лиз, арг, гис, асп, глу). Белки с известной третичной структурой гемоглобин, трипсин, лизоцим, инсулин, цитохром. Методы изучения третичной структуры рентгеноструктурный анализ, электронное микроскопирование. Формы конформаций - Т-форма,R-форма. Фолдинг – процесс укладки синтезированной полипептидной цепи. Описан ряд наследственных заболеваний человека, развитие которых связывают с нарушением вследствие мутаций фолдинга: пигментозы, фиброзы. Белки теплового шока (шапероны) - располагаются между N-концевым сигнальным пептидом и матричным белком, стресслимитирующая система, играют роль в адаптационной стабилизации клеточных структур, в реализации стресс-реакции. Функции шаперонов способность предотвращать образование из полипептидной цепи неспецифических (хаотичных) беспорядочных клубков обеспечение транспорта их к субклеточным мишеням, создавая условия для завершения свёртывания белковой молекулы Четвертичная структура. Белок может состоять из нескольких цепей, число и взаиморасположение в пространстве которых различно. Олигомерные белки состоят из нескольких полипептидных цепей: гемоглобин -4, гексокиназа – 2, ГЛДГ -6, ферритин -24. Связи, поддерживающие четвертичную структуру - гидрофобные, ионные, водородные. Белки с известной четвертичной структурой - гемоглобин, ГЛДГ, миоглобин, ГК. Каждый белок характеризуется уникальной структурой, обеспечивающей уникальность его функций. Пептиды - органические молекулы, в состав которых входит несколько (до 30) остатков АМК, связанных пептидной связью, низкомолекулярные пептиды содержат от 2 до 10 АМК (трипептиды), пептиды со средней молекулярной массой – от 500 до 5000 Д, так называемые, «средние» молекулы, высокомолекулярные пептиды с молекулярной массой от 5000 до 16000 Д. Различают: пептиды – гормоны: вазопрессин, окситоцин, глюкагон, пептиды, участвующие в регуляции пищеварения: гастрин, секретин, пептиды крови: глутатион, каллидин, нейропептиды: пептиды памяти, сна, эндорфины, энкефалины, пептиды, участвующие в сокращении мышц, пептиды – внутренние эндотоксины («средние» молекулы). Функции белков - структурная, каталитическая, регуляторная, рецепторная, иммунологическая, защитная, транспортная, сократительная, опорная, обезвреживающая, энергетическая, геннорегуляторная, создание биопотенциалов мембран, гомеостатическая, индивидуальное строение органов, обеспечивают хорошее зрение. В соответствии с функциональным принципом различают 12 главных классов белков - ферменты, гормоны-белки, белки-регуляторы активности генома, защитные белки, токсические белки, транспортные белки, мембранные белки, сократительные белки, рецепторные белки, ингибиторы ферментов, белки вирусной оболочки, белки с иными функциями.
Жирные кислоты поступающие в гепатоциты, активируются и подвергаются b-окислению с образованием ацетилКоА. Именно этот ацетилКоА используется для синтеза ацетоновых тел. В ходе первой реакции (в первую реакцию вступают 2 молекулы ацетилКоА, фермент ацетилКоА-ацетилтрансфераза = тиолаза) образуется 4-х углеродная молекула ацетоацетилКоА. Эти соединения макроэргические поэтому в этом синтезе не принимает участие АТФ. В ходе следующей реакции (фермент b-гидрокси-b-метил-глюкоил-КоА-синтетаза) (в последующем вы увидите, что первые этапы биосинтеза ацетоновых тел и холестерина абсолютно равнозначны. Это одна из ключевых реакций синтеза ацетоновых тел) используется еще одна молекула ацетилКоА, вода. Образуется 6-и углеродная молекула - b-гидрокси-b-метил-глютарил-КоА. Последняя реакция - лиазная (катализирует фермент ГМГ-лиаза), происходит отщепление ацетилКоА и образование 4-х углеродной молекулы - ацетоацетата. Из ацетоуксусной кислоты спонтанно, чаще всего, или иногда за счет декарбоксилазы происходит отщепление карбоксильной группы в виде углекислого газа и образуется ацетон. Ацетоуксусная кислота восстанавливается в ходе реакции катализируемой ферментом b-гидроксибутератдегидрог иназой с использованием НАД+Н+, в итоге образуется b-гидроксимасляная кислота. Это третий составной элемент ацетоновых тел. Образовавшиеся ацетоновые тела поступают из гепатоцитов в кровь и разносятся к клеткам. Процесс синтеза ацетоновых тел идет постоянно и ацетоновые тела всегда присутствуют в крови в концентрации 30мг/л. При голодании их содержание может увеличиваться до 400-500 мг/л. Еще больше концентрация при сахарном диабете в тяжелой форме до 3000-4000 мг/л. Ацетоновые тела в норме хорошо утилизируются клетками периферических тканей, в особенности это касается скелетных мышц и миокарда. Скелетные мышцы и миокард значительную часть нужной им энергии получают за счет окисления ацетоновых тел. Только нервные клетки в обычных условиях не утилизируют ацетоновые тела, однако при голодании даже головной мозг 50-75% соей потребности в энергии удовлетворяет за счет окисления ацетоновых тел. Ацетоацетат, поступающий в клетки различных тканей, прежде всего подвергается активации помощью одного из двух механизмов. Ацетоацетат с участием фермента тиокиназы, за счет энергии АТФ превращается в ацетоацетилКоА. Второй путь, является превалирующим в активации, это за счет фермента тиофоразы. Реакция, в которой принимают участие сукцениКоА и ацетоацетат, приводит к образованию ацетоацетилКоА и образование сукцината, который далее окисляется в цикле Кребса. Образующийся ацетоацетилКоА далее дает 2 молекулы ацетилКоА (принимает участие НSКоА, это тиолазная реакция) АцетилКоА поступает в цикл Кребса, где ацетильные остатки окисляются до углекислого газа и воды. Биологическая роль Ацетоновые тела по значимости - 3 тип топливной энергии.В гепатоцитах нет фермента тиофоразы, поэтому образовавшийся в гепатоцитах ацетоацетат не активируется и не окисляется. Таким образом печень экспортирует ацетоацетат, другими словами синтезирует этот вид топлива для других клеток. b-гидроксибутерат окисляется путем дегидрироания в ацетоацетат, дальше ацетоацетат в ацетилКоА. Что касается ацетона, возможно 2 варианта окисления. Дело в том, что ацетон очень летуч поэтому большое количество выделяется вместе с выдыхаемым воздухом, кроме того ацетон выделяется с водой. 1 путь: Ацетон расщепляется до ацетильного и формильного остатка. 2 путь: Через пропандиол он превращается в пируват. Ацетоновые тела накапливаясь в крови и тканях оказывают ингибирующие действие на липолиз, в особенности это касается расщепление триглицеридов в липоцитах. Дело в том, что избыточное накопление в крови ацетоновых тел приводит к развитию ацидоза. Снижение уровня липолиза в клетках жировой ткани приводит к уменьшению притока жирных кислот в гепатоциты, к снижению скорости образования ацетоновых тел и следовательно к снижению содержания в крови. Кетоновые тела образуются из ацетил-КоА, синтезируются в печени. Содержание кетоновых тел в крови здоровых людей: 0,8 – 1,2 ммоль/л. Источники синтеза кетоновых тел жирные кислоты, кетопластичные АМК. Избыток ацетил-КоА, высвобожденный при окислении жирных кислот и не использованный печенью, превращается в кетоновые тела, которые переносятся кровью в периферические ткани, где используются в ЦТК. Кетоновые тела – поставщики топлива для мышц, почек, мозга. Для мозга основным энергетическим субстратом являются глюкоза и кетоновые тела. Инсулин ингибирует образование ацетоновых тел. Глюкагон - активирует синтез ацетоновых тел, тормозит синтез жирных кислот за счёт блокады ацетил-КоАкарбоксилазы, усиливает β-окисление, тормозит обмен глюкозы. Кетонемия, кетонурия наблюдаются при сахарном диабете, голодании, длительной мышечной работе, токсикозе беременных, приёме пищи, богатой жирами. Развивается метаболический ацидоз. В мозге новорожденных кетоновые тела потребляются в 3 раза интенсивнее, чем у взрослых. В раннем детстве они используются тканью мозга для синтеза жирных кислот при миелинизации мозга. Склонность к кетозу повышена у детей в возрасте от 2 до 10 лет, так как снижена концентрация глюкозы и повышена концентрация НЭЖК, нарушен АМК обмен (кетогенные кислоты).
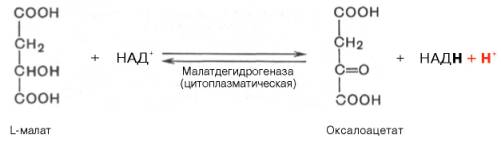 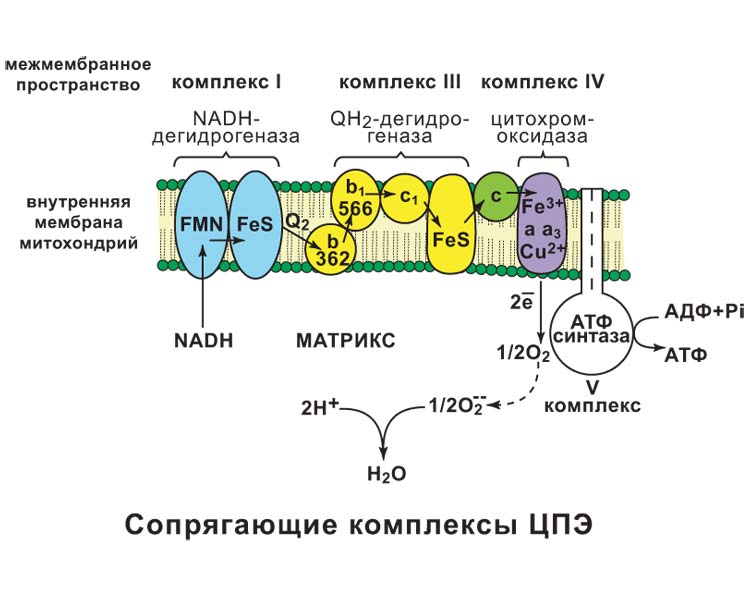 а) При добавлении амитала натрия (ингибитора NADH-дегидрогеназы) ингибируется I комплекс, следовательно P/O = 0 б) При добавлении вместе с амилатом сукцината, ингибируется I комплекс, но при этом сукцинат запускает II комплекс и P/O=2 Билет 34.
Номенклатура ферментов - название субстрата, реакция, катализируемая ферментом, аза – окончание. В основе классификации лежит тип катализируемой реакции. Оксидоредуктазы катализируют окислительно-восстановительные реакции. Трансферазы - реакции с переносом групп. Гидролазы - гидролитический разрыв связи СС, СN, СS с присоединением воды по месту разрыва. Лиазы – реакции негидролитического расщепления с образованием двойных связей, некоторые обратные реакции синтеза. Изомеразы – перенос групп внутри молекулы с образованием изомеров. Лигазы катализируют соединение двух молекул, сопряжённое с разрывом пирофосфатной связи АТФ. Гидролазы – простые белки. Подкласс определяется типом расщепляемой связи 3.1. – сложноэфирные, 3.2. – гликозильные, 3.4. – пептидные. Подподкласс уточняет тип связи: 3.1.1. – эфиры карбоновых кислот. В класс гидролаз входят - пептидогидролазы, эстеразы, гликозидазы. Пептидогидролазы - аминопептидазы, карбоксипептидазы, дипептидазы, протеиназы (пепсин, трипсин, папаин). Эстеразы расщепляют эфиры. Карбоксиэстеразы (липаза), фосфоэстеразы (КФ, ЩФ), сульфоэстеразы. Гликозидазы катализируют гидролиз гликозидов.
на 50% кетогенные, фен – незаменимая АМК, тир – условно заменимая АМК. 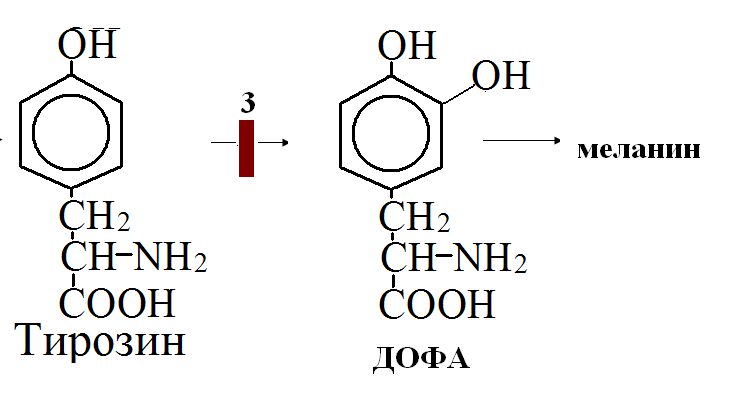 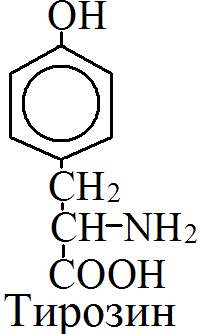 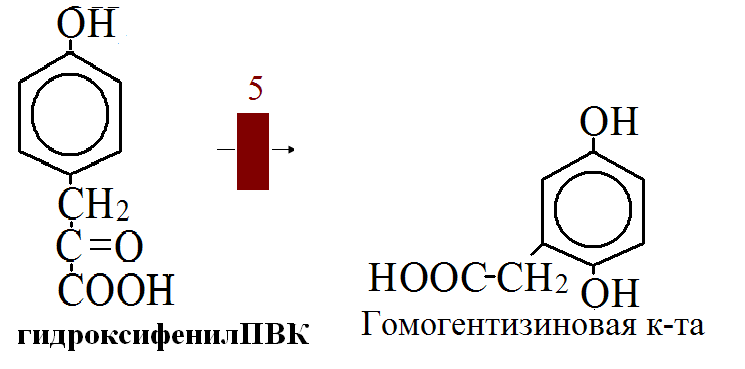 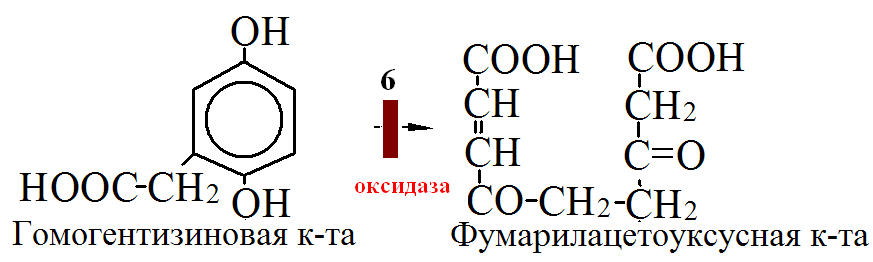 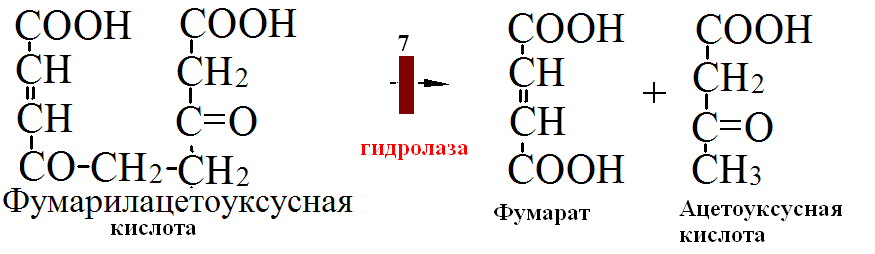 Блок 1. ФенилПВК: токсичен в первые 2-4 года жизни, ингибирует ПК, ГК, обмен триптофана, нарушает обмен серотонина, приводит к развитию фенилпировиноградной олигофрении. Фенилпировиноградная олигофрения - задержка умственного развития, меняется нейромедиаторная активность, сокращается образование нейромедиаторных производных тирозина (тирамин, катехоламины), нарушается баланс АМК, синтез белка, нейромедиаторов в нервной ткани. Скорость обмена АМК наиболее высока в нервной ткани. Наследственные аминоацидопатии – одна из основных причин слабоумия. Нарушение обмена фенилаланина. При побочном пути метаболизма фенилаланина образуются фенилэтиламин и фенилацетат. Это нейротоксины, они способны нарушать метаболизм липидов в мозге. Избыток фен и его минорные метаболиты – тератогенны. Приводят к множественным порокам у плода. Нарушения катаболизма тирозина. Блок 2. При дефекте йодтирозиназы развивается кретинизм. При этом аутосомно-рецессивном заболевании моно- и дийодтирозин не дейодируются, развивается нехватка тиреоидных гормонов. Блок 3. При дефекте тирозиназы, развивается альбинизм. При первичной болезни Паркинсона заторможено образование дофамина из ДОФА в ткани мозга. При отсутствии витамина С оксидазы не работают. Блок 4. на уровне тирозинтрансаминазы, развивается тирозинемия II типа. Симптомы: умственная отсталость, поражения глаз, кожи. Блок 5. на уровне гидроксифенилПВКгидроксилазы, развивается тирозинемия новорожденных. Блок 6. на оксидазе гомогентизиновой кислоты, развивается алкаптонурия. Симптомы: охроноз, артриты, чёрная моча. Лабораторная диагностика алкаптонурии: при подщелачивании мочи NаОН гомогентизиновая кислота окисляется с образованием соединения сине-фиолетового цвета. Гомогентизиновая кислота ингибирует лизингидроксилазу. Блок 7. на фумарилацетоацетатгидролазе, развивается тирозинемия I типа. Симптомы: в плазме повышено содержание тирозина и метионина, понос, рвота, задержка в развитии, смерть в 6-8 лет.
Глюкоза → 2 пирувата. Выход АТФ: -1 -1+2(3 + 1+ 1)+15*2=38 АТФ |
