ОТВЕТЫ НА БИЛЕТЫ ПО БИОЛОГИЧЕСКОЙ ХИМИИ. Отдельное спасибо ребятам со второго потока лечебного факультета 2012 г
 Скачать 2.33 Mb. Скачать 2.33 Mb.
|
|
анаэробный гликолиз. Выход АТФ: -1 -1+2( 1 + 1)=2 АТФ т. е. надо разрушить до лактата 19 молекул глюкозы. Билет 35.
натощак через 60 мин. Через 120 мин. 1. 4,5 8,0 4,3 2. 6,1 14,0 10,0 Оцените состояние пациентов.
Витамины - пищевые незаменимые факторы, которые, присутствуя в небольших количествах в пище обеспечивают нормальное развитие организма животных и человека и адекватную скорость протекания биохимических и физиологических процессов. Витамины, растворимые в жирах 1. Витамин А (антиксерофтальмический); ретинол 2. Витамин D (антирахитический); кальциферолы 3. Витамин Е (антистерильный, витамин размножения); токоферолы 4. Витамин К (антигеморрагический); нафтохиноны Витамины, растворимые в воде 1. Витамин B1(антиневритный); тиамин 2. Витамин В2 (витамин роста); рибофлавин 3. Витамин В6 (антидерматитный, адермин); пиридоксин 4. Витамин B12(антианемический); цианкобаламин; кобаламин 5. Витамин РР (антипеллагрический, ниацин); никотинамид 6. Витамин Вc (антианемический); фолиевая кислота 7. Витамин В3 (антидерматитный); пантотеновая кислота 8. Витамин Н (антисеборейный, фактор роста бактерий, дрожжей и грибков); биотин 9. Витамин С (антискорбутный); аскорбиновая кислота 10. Витамин Р (капилляроукрепляющий, витамин проницаемости); биофлаво-ноиды Болезни при недостатке витаминов – следствие нарушения обмена веществ из-за снижения концентрации коферментов. Авитаминозы – болезни, возникающие при полном отсутствии в пище или полном нарушении усвоения какого-либо витамина. Гиповитаминозы - болезни, возникающие из-за недостаточного поступления или неполного усвоения какого-либо витамина. Причины авитаминозов и гиповитаминозов Экзогенные: - отсутствие витамина в пище, - недостаточное, неполноценное питание, Эндогенные:
Гипервитаминозы - патологические состояния, связанные с поступлением больших количеств витаминов в организм (А, D, Е, К). Антивитамины - структурные аналоги витаминов, после введения их в организм вызывают авитаминозы или гиповитаминозы. Авитаминоз витамина B1 (тиамина) возникает при длительном питании зерновыми продуктами, освобожденными от зародыша и наружных оболочек, а также при питании полированным рисом (Япония, Китай и др.). Нарушение всасываемости тиамина при некоторых заболеваниях является частой причиной развития B1-витаминной недостаточности. В настоящее время все больше подтверждается обоснованность отнесения гиповитаминоза тиамина (витамина B1) к “болезням цивилизации”. Преимущественное потребление рафинированных углеводистых продуктов (хлебобулочных изделий из муки высшего сорта) приводит к резкому обеднению пищевого рациона тиамином. Повысившееся потребление кондитерских изделий и других сладких продуктов обусловило перегрузки пищевого рациона легкоусвояемыми низкомолекулярными углеводами, что привело к резкому повышению потребности в тиамине. Оба эти фактора способствуют распространению B1-гиповитаминозных состояний во всех странах, делая их одним из наиболее распространенных проявлений витаминной недостаточности. Ранними симптомами B1-гиповитаминоза (недостаточности тиамина) являются:
Затем появляются: ухудшение сна, вялость, мышечная слабость и первые тревожные признаки - зуд и покалывание в ногах, учащенное сердцебиение, подавленность. Гиповитаминоз В1. Нарушается окисление пировиноградной кислоты, так как витамин B1 входит в состав кофермента, участвующего в этом процессе. Пировиноградная кислота накапливается в избытке и частично переходит в молочную кислоту, содержание которой также возрастает. При нарушении окисления пировиноградной кислоты снижается синтез ацетилхолина и нарушается передача нервных импульсов. Уменьшается образование из пировиноградной кислоты ацетилкоэнзима А. Пировиноградная кислота является фармакологическим ядом для нервных окончаний. При увеличении ее концентрации в 2-3 раза возникают нарушения чувствительности, невриты, параличи и др. При гиповитаминозе B1 нарушается также и пентозофосфатный путь обмена углеводов, в частности образование рибозы. 2.БИОХИМИЯ МЫШЕЧНОЙ ТКАНИ Мышечная ткань составляет 40% от веса тела человека. Биохимические процессы, протекающие в мышцах, оказывают большое влияние на весь организм человека. ФУНКЦИЯ МЫШЦ - МЕХАНИЧЕСКОЕ ДВИЖЕНИЕ, в котором химическая энергия превращается в механическую при постоянном давлении и постоянной температуре. Ни один искусственный механизм к этому не способен. ПОПЕРЕЧНО-ПОЛОСАТАЯ МУСКУЛАТУРА Функциональная единица - САРКОМЕР. Состоит из молекул белка миозина. МИОЗИН - крупный олигомерный белок, молекулярная масса 500 кДа, состоит из 6 субъединиц, попарно одинаковых. Тяжелая цепь: на С-конце - альфа-спираль, на N-конце - глобула. При соединении двух тяжелых цепей С-концевыми участками образуется суперспираль. Две легкие цепи входят в состав глобулы (головки). Стержневой участок суперспирали имеет 2 отдела, где спирали оголены - эти места открыты для действия протеолитических ферментов и имеют повышенную подвижность. Свойства миозина. 1. В физиологических условиях (оптимальные pH, температура, концентрации солей) молекулы миозина спонтанно взаимодействуют между собой своими стержневыми участками ("конец в конец", "бок в бок") с помощью слабых типов связей. Взаимодействуют только стержни, головки остаются свободными. 2. Молекула миозина обладает ферментативной активностью (АТФ-азная активность: АТФ+Н2О----->АДФ+Ф). Активные центры расположены на головках миозина. ТОНКИЕ НИТИ В состав тонких нитей входят три белка: - сократительный белок актин - регуляторный белок тропомиозин - регуляторный белок тропонин АКТИН - небольшой глобулярный белок, его молекулярная масса - 42 кDа. G-актин представляет собой глобулу. В физиологических условиях его молекулы способны к спонтанной агрегации, образуя F-актин. В состав тонкой нити входят две F-актиновые нити, образуется суперспираль (2 перекрученные нити). В области Z-линий актин прикрепляется к a-актинину. ТРОПОМИОЗИН. Фибриллярный белок, молекулярная масса - 70 кДа. Имеет вид a-спирали. В тонкой нити на 1 молекулу тропомиозина приходится 7 молекул G-актина. Располагается тропомиозин в желобке между двумя спиралями G-актина. Соединяется тропомиозин "конец в конец", цепочка непрерывная. Молекула тропомиозина закрывает активные центры связывания актина на поверхности глобул актина. ТРОПОНИН. Глобулярный белок, молекулярная масса 80 кДа, имеет 3 субъединицы: тропонин "Т", тропонин "С" и тропонин "I". Располагается на тропомиозине с равными промежутками, длина которых равна длине молекулы тропомиозина. Тропонин Т (ТнТ) - отвечает за связывание тропонина с тропомиозином, через тропонин "Т" конформационные изменения тропонина передаются на тропомиозин. Тропонин С (ТнС) - Ca2+-связывающая субъединица, содержит 4 участка для связывания кальция, по строению похожа на белок кальмодулин. Тропонин I (ТнI) - ингибиторная субъединица - это ненастоящий ингибитор - он тоько лишь создает пространственное препятствие, мешающее взаимодействию актина и миозина в момент, когда тропонин "С" не связан с Са2+. Креатинфосфокиназная реакция. 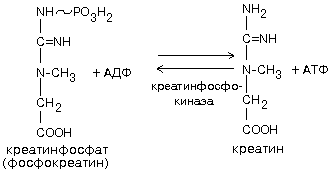 Это самый быстрый способ ресинтеза АТФ. Запасов креатинфосфата хватает для обеспечения мышечной работы в течение 20 секунд. Максимально эффективен. Не требует присутствия кислорода, не дает побочных нежелательных продуктов, включается мгновенно. Его недостаток - малый резерв субстрата (хватает только на 20 секунд работы). Обратная реакция может протекать в митохондриях с использованием АТФ, образовавшейся в процессе окислительного фосфорилирования. Мембрана митохондрий хорошо проницаема как для креатина, так и для креатин-фосфата, а креатинфосфокиназа есть и в саркоплазме, и в межмембранном пространстве митохондрий. Биосинтез и распад креатина Креатин и креатининфосфат – важные азотистые вещества мышцы. Находится креатин в мышцах, ткани мозга, миокарде в свободном состоянии и в форме фосфокреатина. При переходе от покоя к работе мышцы сначала используют АТФ, образующийся из креатинфосфата – это наиболее быстрый путь генерации АТФ. Синтез креатина Первая стадия синтеза креатина протекает в почках под действием глицин-амидинотрансферазы.  Вторая стадия – метилирование - протекает в печени. В мышцах имеется высокоэнергетическое вещество – креатинфосфат. Креатинин образуется в результате неферментативного дефосфорилирования креатинфосфата. Содержание в плазме крови. В плазме крови в небольших количествах содержатся креатин и креатинин. Содержание креатинина в плазме крови - 44-100 ммоль/л у мужчин, у женщин - чуть меньше. С мочой креатин выделяется только у детей, у взрослых – креатинин. При болезнях почек с нарушением фильтрации выделение креатинина уменьшается, а его количество в крови увеличивается. В норме суточное выделение креатинина с мочой пропорционально мышечной массе. Диагностическое значение - уровень креатинина в сыворотке – чувствительный показатель состояния функции почек, снижение выделение креатинина с мочой наблюдается при гипертиреозе и прогрессирующей мышечной дистрофии в связи со снижением скорости синтеза креатина. Физиологическая креатинурия наблюдается - у новорожденных, так как преобладает скорость синтеза креатина, у пожилых вследствие атрофии мышц, у беременных из-за развития мышечной массы матки, алиментарная креатинурия обусловлена принятием пищи, богатой креатином. Повышение выделения креатина наблюдается при переохлаждении организма, заболеваниях скелетной мускулатуры (при нарушении трофики и структуры мышц), при этом креатинурия сопровождается снижением содержания креатинина в моче, что связано с нарушением механизма превращения креатина в креатинин. 3. Ответ: 1 пациент – норма, 2 пациент – сахарный диабет. Билет 36.
1. Переваривание белков. Диагностическое значение биохимического анализа желудочного и дуоденального сока. Функции белков: структурная, каталитическая, регуляторная, рецепторная, иммунологическая, защитная, транспортная, сократительная, дыхательная, обезвреживающая, геннорегуляторная, создание биопотенциалов мембран, гомеостатическая, индивидуальное строение органов, обеспечивают хорошее зрение, энергетическая, Белковый обмен. В организме человека содержится около 15 кг белков. Количество свободных АМК примерно 35 г. АМК и белки содержат 95 % всего азота в организме. Азотистый баланс – разность между общим количеством азота, поступившим в организм человека и количеством экскретируемого азота. Азотистое равновесие наблюдается у взрослого здорового человека. При этом количество синтезируемого белка, равно количеству экскретируемого. Положительный азотистый баланс у детей, беременных, выздоравливающих, введении анаболиков. При этом синтез белка преобладает над распадом. Отрицательный азотистый баланс при голодании, старении, истощающих заболеваниях, раке. Избыток и недостаток белка. При недостаточном поступлении белка развивается белковая недостаточность. При белковых нагрузках вероятность возникновения дистрофических поражений почек, аллергических заболеваний, неопластических процессов повышается. Белковый оптимум. Для человека умственного труда при средней физической нагрузке – 100 г в сутки, при работе в жарком климате – 120 г в сутки. Оптимальная норма белка в питании обеспечивает положительный азотистый баланс. Содержание белка в пищевых продуктах неодинаково. .На потребность в белке влияют - климатические условия, характер трудовой деятельности, возраст, физиологическое состояние организма, стрессы, наличие заболеваний. Белковый минимум 30-50 г в сутки. Такое количество белка необходимо для поддержания азотистого равновесия. Даже при полном исключении из диеты всех белков с мочой выводится 4 г азота в сутки, то есть 25 г белка. Следовательно, при белковом голодании организм ежесуточно расходует примерно 25 г белков собственных тканей. Биологическая ценность белков определяется - сбалансированностью АМК состава, атакуемостью белков ферментами пищеварительного тракта (доступностью АМК). Ограниченная всасываемость АМК растительной пищи связана с высоким содержанием в ней волокон, наличием специфических ингибиторов пищеварительных ферментов если эти ингибиторы не инактивированы горячей обработкой пищи (соя, горох). Идеальный белок - 100% биологическая ценность, 100% усвоение в ЖКТ. К идеальным белкам можно отнести белок женского молока, белок цельного куриного яйца. Белки коровьего молока усваиваются на 90%, растительные белки – на 60%. Ценность белка определяется его химическим составом. Незаменимые АМК: Вал, Иле, Лей, Лиз, Мет, Тре, Три, Фен. Незаменимые АМК для детей: Вал, Иле, Лей, Лиз, Мет, Тре, Три, Фен, Гис и Арг. Скорость синтеза Гис и Арг недостаточна для того, чтобы обеспечить рост организма в детстве. Исключение какой-либо АМК из пищи сопровождается развитием отрицательного азотистого баланса, истощением, остановкой в росте, нарушениями со стороны нервной системы.При отсутствии Гис, Арг – анемия. При отсутствии Три – катаракта. При отсутствии Лиз - кариес, задержка роста. При отсутствии Мет страдает печень. Дефицит белка в пище вызывает - потерю массы тела, нарушения роста, ферментную недостаточность, нарушения иммунитета. Парентеральное белковое питание используют при ожогах, отравлениях, непроходимости пищевода, тяжёлых раковых поражениях пищевода и желудка. В ротовой полости нет переваривания белков, Переваривания белков начинается в желудке. Расщепление белка в ЖКТ. Желудочный сок - 95% - вода, 0,5% органические вещества, 2,5 литра. Состав желудочного сока - пепсин (7 изоферментов), соляная кислота, гастрин (гормон, стимулирующий желудочную секрецию), лизоцим (вырабатывается поверхностью эпителия желудка), слизь (гликопротеины) несёт защитную функцию, внутренний фактор Кастла. Пепсин образуется путём ограниченного протеолиза. рН оптимум 1,5 – 2, гидролизует пептидные связи с участием NH2 группы ароматической АМК. Соляная кислота - создаёт рН 1,5-2 у взрослого, рН 5-6 – у новорожденных. Роль соляной кислоты - вызывает денатурацию, набухание белка, активация пепсиногена, создаёт оптимум рН для пепсина, бактерицидное действие, нужна для всасывания железа, стимулирует работу внутреннего фактора Кастла, стимулирует работу секретина. Общая кислотность желудочного сока - совокупность всех кислотореагирующих веществ желудочного сока. Связанная соляная кислота - соляная кислота, связанная с белками и продуктами их переваривания. Свободная соляная кислота - соляная кислота, остающаяся в избытке. Кислотность измеряется в титрационных единицах – количество NaOH, затраченное на титрование 100 мл желудочного сока. Общая кислотность – 40-60 ТЕ. Связанная соляная кислота – 20-30 ТЕ. Свободная соляная кислота - 20-40 ТЕ. Защитные факторы слизистой желудка от соляной кислоты и пепсина - образование слизи, секреция эпителием ионов НСОз, создающих рН 5-6, наличие гетерополисахаридов на поверхности мембран клеток слизистой, быстрая регенерация повреждённого эпителия. Основные пепсины желудочного сока. Пепсин А гидролизует белки при рН 1,5-2. Часть пепсина переходит в кровеносное русло и выделяется с мочой (уропепсин). Гастриксин - оптимум рН 3,2 -3,5. Пепсин В (желатиназа) расщепляет белки соединительной ткани. Реннин (пепсин D, химозин) расщепляет казеин молока в присутствии ионов кальция. Пепсиноген активируется двумя способами - соляной кислотой – медленно, аутокаталитически –быстро, уже имеющимся пепсином. Гипохлоргидрия – снижение концентрации соляной кислоты в желудочном соке. Ахлоргидрия – отсутствие соляной кислоты в желудочном соке. Гиперхлоргидрия – повышение концентрации соляной кислоты в желудочном соке. 2. Аэробный распад глюкозы. Основной путь катаболизма глюкозы. Дихотомический распад молекулы глюкозы на 2 триозы. Происходит в нервной ткани, почках, печени, сердце. Поставляет энергию в клетку. Требуется кислород. |
