ОТВЕТЫ НА БИЛЕТЫ ПО БИОЛОГИЧЕСКОЙ ХИМИИ. Отдельное спасибо ребятам со второго потока лечебного факультета 2012 г
 Скачать 2.33 Mb. Скачать 2.33 Mb.
|
|
Билет 39.
Взаимосвязь обеспечивается различными уровнями: информационный уровень, структурный уровень, общее энергетическое обеспечение, на уровне общих метаболитов, на уровне Ц.Т.К. Информационный уровень взаимосвязи. В геноме клеток заложена информация о структуре и функциональной активности различных белков, принимающих участие в структурной и динамической организации живых систем. Структурный уровень взаимосвязи. Мембранный аппарат клеток, рибосомы. Общее энергетическое обеспечение. АТФ – универсальная энергетическая валюта, образующаяся при окислении углеводов, жиров, аминокислот. НАДФН2 – основной донор электронов в восстановительных реакциях биосинтеза. Восстановительные эквиваленты, накапливаемые в ходе катаболизма в клетке в виде восстановительных форм НАДФН2 используются в восстановительных реакциях клеточного анаболизма, связывая таким образом, катаболические и анаболические процессы в единую систему. Синтез одного соединения (жира) происходит за счёт катаболизма другого (глюкозы). Взаимосвязь на уровне общих метаболитов. Центральные метаболиты: ацетил-КоА, ПВК, ЩУК, ФГА. Ацетил-КоА образуется при окислительном декарбоксилировании ПВК, при β-окислении жирных кислот, из аминокислот. Взаимосвязь углеводного и липидного обменов осуществляется через - ацетил-КоА, ФГА, НАДФН2 из пентозного цикла идёт на синтез жирных кислот, ЩУК нужен для работы Ц.Т.К. Жиры сгорают в пламени углеводов. При избытке в пище углеводов возникает ожирение. ФГА и ацетил-КоА– источники глицерина и жирных кислот. При спячке у животных происходит образование углеводов из жиров. Взаимосвязь белкового и жирового обменов на уровне - ПВК, ацетил-КоА, кетоновых тел. Из белков осуществляется синтез жира. Взаимосвязь углеводного и белкового обменов на уровне - ПВК, ЩУК, ацетил-КоА, пентоз, глюкопластичных и кетопластичных аминокислот. Углеродные скелеты АМК вступают в Ц.Т.К. Возможно образование углеводов из белков (ГНГ) и белков из углеводов (из ПВК образуется аланин). Сопряжение на уровне Ц.Т.К. - углеродные скелеты АМК включаются в Ц.Т.К, все кислоты Ц.Т.К. превращаются в ЩУК (ГНГ), взаимосвязь Ц.Т.К. с синтезом мочевины через фумарат, асп, СО2. Ц.Т.К. обеспечивает энергией все обмены. Взаимосвязь обмена веществ на уровне цикла Кребса. Связь липидного обмена с Ц.Т.К. осуществляется через: цитрат, - активатор ацетил-КоА-карбоксилазы, - перенос в цитоплазму ацетил-КоА, Сукцинил-КоА. Жирные кислоты с нечётным числом углеродных атомов через пропионил-КоА превращаются в сукцинил-КоА, СО2, малат. Малик-реакция – источник образования НАДФН2.
Соматостатин. Он оказывает широкий спектр биологического действия; в частности, показано ингибирующее действие на синтез гормона роста в аденогипофизе, а также прямое тормозящее действие его на биосинтез инсулина и глюкагона в β- и α-клетках островков Лангерганса. Соматолиберин стимулирует синтез и секрецию гормона роста гипофиза соматотропина. Меланолиберин оказывает стимулирующее действие, а меланостатин, напротив, ингибирующее действие на синтез и секрецию меланотропина в передней доле гипофиза. Местом синтеза гипоталамических гормонов, вероятнее всего, являются нервные окончания – синаптосомы гипоталамуса, поскольку именно там отмечена наибольшая концентрация гормонов и биогенных аминов. Последние рассматриваются наряду с гормонами периферических желез внутренней секреции, действующих по принципу обратной связи, в качестве основных регуляторов секреции и синтеза гормонов гипоталамуса. Механизм биосинтеза тиролиберина, осуществляющегося, скорее всего, нерибосомальным путем, включает участие SH-содержащей синтетазы или комплекса ферментов, катализирующих циклизацию глутаминовой кислоты в пироглутаминовую, образование пептидной связи и амидирование проли-на в присутствии глутамина. Существование подобного механизма биосинтеза с участием соответствующих синтетаз допускается также в отношении гонадолиберина и соматолиберина. Гипоталамические гормоны непосредственно влияют на секрецию (точнее, освобождение) «готовых» гормонов и биосинтез этих гормонов de novo. Доказано, что цАМФ участвует в передаче гормонального сигнала. Показано существование в плазматических мембранах клеток гипофиза специфических аденогипофизарных рецепторов, с которыми связываются гормоны гипоталамуса, после чего через систему аденилатциклазы и мембранных комплексов Са2+–АТФ и Mg2+–АТФ освобождаются ионы Са2+ и цАМФ; последний действует как на освобождение, так и на синтез соответствующего гормона гипофиза путем активирования протеинкиназы. Гормоны задней доли гипофиза. Вазопрессин и окситоцин синтезируются в нейронах гипоталамуса, связываются с белками нейрофизинами и транспортируются в нейросекреторные гранулы гипоталамуса, затем вдоль аксона в заднюю долю гипофиза, где происходит пострибосомальная достройка. Вазопрессин - стимулятор аденилатциклазы: цАМФ образуется в мембране эпителия почечных канальцев, в результате повышается проницаемость для воды, повышает артериальное давление из-за стимуляции сокращения гладкой мускулатуры сосудов, способствует уменьшению диуреза из-за воздействия на канальцевый аппарат нефрона, повышения реабсорбции воды. Несахарный диабет возникает из-за нарушения: синтеза, транспорта, секреции вазопрессина. При заболевании с мочой теряется до 40 л воды в сутки, возникает жажда. Несахарный диабет бывает при атрофии задней доли гипофиза. Синдром Пархана возникает из-за повышенной секреции вазопрессина, усиливается реабсорбция воды в почках, появляются отёки. Окситоцин - стимулирует сокращения гладкой мускулатуры матки, гладких мышц кишечника, уретры, стимулирует сокращение мышц вокруг альвеол молочных желёз, способствуя молокоотдаче. Окситоциназа разрушает гормон. При родах её активность падает в 100 раз.
Коэффициент Де Ветиса < 1 – забол. печени ↑ непр. и прям. Билирубина – паренхиматозная желтуха. ↑ концентрации белков острой фазы – острое воспаление. Билет 40.
Обмен веществ и энергии - совокупность процессов превращения веществ и энергии в живых организмах и обмен веществами и энергией между организмом и окружающей средой. Обмен веществ включает 3 этапа - поступление веществ в организм, метаболизм, или промежуточный обмен, выделение конечных продуктов обмена. Основные функции метаболизма - извлечение энергии из окружающей среды (в форме химической энергии органических веществ), превращение экзогенных веществ в строительные блоки, сборка белков, нуклеиновых кислот, жиров из строительных блоков, синтез и разрушение тех биомолекул, которые необходимы для выполнения различных специфических функций данной клетки. Различают две стороны обмена веществ – анаболизм и катаболизм Катаболизм – ферментативный распад высокомолекулярных соединений до составляющих их мономеров и дальнейший распад мономеров до конечных продуктов: углекислого газа, аммиака, лактата. Главные реакции катаболизма – реакции окисления, поставляющие клетке энергию. Энергия может запасаться в двух формах: АТФ, НАДФН+Н - донор водорода в реакциях восстановления при синтезе ряда соединений. Анаболизм - ферментативный синтез основных макромолекул клетки, а также образование биологически активных соединений, требует затраты свободной энергии (АТФ, НАДФН+Н ). Отличия катаболизма и анаболизма. Катаболизм – распад, запасание АТФ. Анаболизм – синтез, но потребление АТФ. Пути не совпадают, разное число реакций. Отличаются по локализации. Разная генетическая и аллостерическая регуляция. Основной энергетический источник для человека – энергия, запасённая в химических связях пищевых продуктов. Соотношение Б:Ж:У = 1:1:4. 55% энергии человек получает за счёт углеводов, 15% - за счёт белков, 30% - за счёт жиров (80% приходится на животные жиры, а 20% - на растительные). Суточная потребность человека в энергии – 3000 ккал. Суточная потребность человека в энергии зависит от: работы (при тяжёлой физической работе выше основной обмен), пола (у женщин величина обмена ниже на 6-10%), температуры (при повышении температуры тела на один градус величина обмена возрастает на 13%), возраста (с возрастом, начиная с 5 лет, величина основного обмена снижается). За сутки в организме образуется и распадается около 60 кг АТФ. Цикл АТФ-АДФ работает постоянно. Он включает в себя использование АТФ для различных видов работы и регенерацию АТФ за счёт реакций катаболизма. Унификация питательных веществ идёт в три фазы. I. Подготовительная фаза. Высокомолекулярные соединения распадаются под действием гидролаз ЖКТ до мономеров. Протекает в ЖКТ и лизосомах. Не является поставщиком энергии (1%). II фаза. Превращение мономеров в простые соединения - центральные метаболиты (ПВК, ацетилКоА). Эти продукты связывают 3 вида обмена, до 2-3 с, протекает в цитоплазме, завершается в митохондриях, даёт 20-30% энергии, поставляемой анаэробно. III фаза. Цикл Кребса. Аэробные условия, полное окисление поступивших с пищей веществ, выделяется большое количество энергии и аккумулируется она в АТФ. Анаболические пути расходятся 1 фаза. Синтез белков начинается с образования α-кетокислот. 2 фаза. Аминирование α-кетокислот, получение АМК.
Общий путь катаболизма. После образования ПВК дальнейший путь распада веществ до углекислого газа и воды происходит одинаково в общем пути катаболизма (ОПК). ОПК включает реакции окислительного декарбоксилирования ПВК и ЦТК. Реакции ОПК происходят в матриксе митохондрий и восстановленные коферменты передают водород на компоненты дыхательной цепи. Катаболические пути сходятся, вливаясь на третьей фазе в ЦТК. На первой фазе белки дают 20 АМК. На второй фазе 20 АМК дают ацетилКоА и аммиак. На третьей фазе ЦТК даёт углекислый газ, воду и энергию. Метаболические пути – совокупность катализируемых ферментами реакций, в ходе которых происходит превращение субстрата в продукт. Главные (основные) метаболические пути – универсальные, свойственные любой клетке. Поставляют энергию, синтез основных биополимеров клетки. Добавочные пути менее универсальны, характерны для определённых тканей и органов. Синтез важных веществ. Поставляют энергию в форме НАДФН+Н. Цикл трикарбоновых кислот открыт в 1937 г Г.Кребсом, протекает в циклическом режиме в матриксе митохондрий, в каждый оборот ЦТК вступает в форме ацетилКоА одна ацетильная группа, 2 атома углерода, и при каждом обороте из цикла выводится 2 молекулы углекислого газа. Оксалоацетат в ЦТК не расходуется, так как он регенерирует. Изомеризация цитрата - α –Кетоглутарат окисляется до сукцинилКоА и углекислого газа. ЦТК – специфический механизм для расщепления ацетилКоА на 2 типа продуктов: углекислый газ – продукт полного окисления, восстановленные нуклеотиды, окисление которых является главным источником энергии. При окислении одной молекулы ацетилКоА в ЦТК и системе окислительного фосфорилирования образуется 12 молекул АТФ: 1АТФ за счёт субстратного фосфорилирования, 11АТФ за счёт окислительного фосфорилирования. Энергия окисления аккумулируется в форме восстановленных нуклеотидов и 1АТФ. Валовое уравнение ЦТК - АцетилКоА + 3НАД + ФАД+ АДФ+Фн+2Н20→ 2СО2+ 3НАД+Н +ФАДН2+ АТФ + КоАSH ЦТК – центральный метаболический путь. Функции ЦТК: интегрирующая, энергообразующая, анаболическая. Взаимосвязь обмена веществ на уровне цикла Кребса. Анаболическая функция ЦТК. Метаболиты цикла Кребса используются для синтеза различных веществ: углекислый газ в реакциях карбоксилирования, α-кетоглутарат → глу, оксалоацетат → глюкоза, сукцинат → гем. ЦТК играет роль в процессах глюконеогенеза, переаминирования, дезаминирования, липогенеза. Регуляция ЦТК. Регуляторные энзимы: цитратсинтаза, изоцитратДГ, α –кетоглутаратДГ комплекс. Положительные аллостерические эффекторы цитратсинтазы - ЩУК, ацетилКоА, НАД, АДФ. Отрицательные аллостерические эффекторы цитратсинтазы - АТФ, цитрат, НАДН+Н, жирные кислоты, повышение выше нормы концентрации сукцинилКоА. Действие АТФ заключается в повышении Км для ацетилКоА. С увеличением концентрации АТФ снижается насыщение фермента ацетилКоА и в результате снижается образование цитрата. Положительные аллостерические эффекторы изоцитратДГ - АДФ, НАД. Отрицательные аллостерические эффекторы изоцитратДГ - АТФ, НАДН+Н. Цикл Кребса регулируется по типу обратной связи: ингибируется АТФ, активируется АДФ. Гипоэнергетические состояния – состояния, при которых снижается синтез АТФ. Гипоксия тканей из-за: снижения концентрации кислорода в воздухе, нарушения работы сердечно-сосудистой и дыхательной систем, анемии, гиповитаминозы, голодание. Роль витаминов в цикле Кребса - рибофлавин (ФАД) - кофермент СДГ, α-кетоглутарат ДГ комплекса, РР (НАД) – кофермент МДГ,ИДГ, α-кетоглутарат ДГ, тиамин (ТПФ) - кофермент α-кетоглутарат ДГ комплекса, пантотеновая кислота (КоА): ацетилКоА, сукцинилКоА.
Функции нервной ткани - Генерация электрического сигнала (нервного импульса). Проведение нервного импульса. Запоминание и хранение информации. Формирование эмоций и поведения. Мышление. Функции липидов нервной ткани
В нервной ткани присутствуют: фосфолипиды, гликолипиды, холестерин, эфиры холестерина (в участках активной миелинизации). Фосфотидилинозит. Инозитол-3-фосфат. Увеличивает концентрацию кальция. Кальций активирует ферменты клетки и способствует сокращению микрофиламентов, обеспечивая передвижение веществ в теле нервной клетки и аксоне Диацилглицерол. Активируя протеинкиназу С, участвует в реакциях фосфорилирования белков клетки. Изменяет активность ферментов и скорость синтеза белков. Обмен нуклеиновых кислот в нервной ткани. ДНК не синтезируется. Содержание и скорость синтеза РНК большая. Пиримидиновые нуклеотиды поступают из крови через гематоэнцефалический барьер. Пуриновые нуклеотиды синтезируются в нервной ткани. Циклические нуклеотиды (цАМФ, цГМФ) содержатся в нервной ткани в большом количестве. Обмен углеводов и энергообеспечение нервной ткани. Основной путь получения энергии – аэробный распад глюкозы. Проникновение глюкозы в ткань мозга не зависит от действия инсулина (инсулин не проникает через гематоэнцефалический барьер). Влияние инсулина проявляется только в периферических нервах. Необходим постоянный и непрерывный приток глюкозы и кислорода из крови. Содержание гликогена в нервной ткани очень мало (0,1% от массы мозга) .Окисления неуглеводных субстратов с целью получения энергии не происходит. При гипоксии и гипогликемии в нервной ткани образуется очень мало АТФ, быстро наступает коматозное состояние и необратимые изменения в клетках головного мозга. Энергия АТФ в нервной ткани используется неравномерно во времени: резкое повышение энергозатрат происходит при быстром переходе от сна к бодрствованию Метаболизм белков и аминокислот в нервной ткани. Обмен белков и аминокислот идет очень интенсивно. Существуют специальные транспортные системы для транспорта аминокислот через мембраны. Ткань мозга способна синтезировать заменимые аминокислоты. 75% аминокислот составляют аспарагиновая и глутаминовая кислоты и их метаболиты (глутамин, глутатион, ГАМК).В спинном и головном мозге действует «ГАМК-шунт». Роль глутаминовой кислоты в нервной ткани
Нейромедиаторы - это вещества, которые накапливаются в пресинаптической мембране, освобождаются при передаче нервного импульса, вызывают после связывания с постсинаптической мембраной изменение скорости метаболических процессов и возникновение электрического импульса. Имеют систему инактивации или специальную транспортную систему для удаления нейромедиаторов из синапса. Синтез нейромедиаторов происходит в теле нейронов, а накопление – в особых везикулах, которые постепенно перемещаются с помощью нейрофиламентов и нейротрубочек по аксону к синапсам Нейромедиаторы
Нейрогипофизарные гормоны (вазопрессин, либерины, статины). Опиатоподобные пептиды – эндорфины (вызывают обезболивание, действуя на те же рецепторы, что и опиаты (морфин). Пептиды сна. Пептиды памяти (скотофобин, белок S-100). Образуются пептиды в результате реакций ограниченного протеолиза, а разрушаются под действием протеиназ.
Билет 41.
Альбумины - глобулярные белки, молекулярная масса 70 000, растворимы в воде, ИЭТ 5, высаливаются 100% сульфатом аммония, синтез в печени. Функции альбуминов - депо белка в организме, осморегуляция, неспецифическая защита, транспорт лекарств, металлов, холестерина, билирубина, желчных пигментов, гормонов. Глобулины - глобулярные белки, молекулярная масса 150 000 дальтон, растворимы в солевых растворах, ИЭТ 7, имеют ряд фракций, высаливаются 50% сульфатом аммония, синтезируются в печени и В-лимфоцитах. Функции глобулинов - ферменты, транспорт витаминов, гормонов, металлов, защита (иммунитет), γ-глобулины являются антителами. Гистоны - связаны с ДНК, молекулярная масса 20 000, ИЭТ 8, богаты лиз, арг, гис, имеют положительный заряд, содержат тирозин, защищают ДНК от нуклеаз. Протамины - молекулярная масса 5000, ИЭТ 11, содержат много арг, лиз, имеют положительный заряд, не содержат тирозин, являются белковым компонентом нуклеопротеинов. Проламины и глютелины - белки растительного происхождения, содержатся в семенах злаков, растворимы в 60-80% водном растворе, а другие простые белки выпадают в осадок, проламины содержат 20-25% глу и 10-15% пролина. Протеиноиды. Фибриллярные белки: коллаген, эластин, кератины. Треть общего белка организма приходится на коллаген – основной белок соединительной ткани, молекулярная масса коллагена 300 000, Содержится в: коже, роговице, костях. АМК состав коллагена - глицин -30%, гидроксипролин – 15%, пролин – 5%. Строение коллагена - молекула коллагена состоит из 3 полипептидных цепей, в каждой примерно 1000 АМК, вторичная структура коллагена – 3 спирали перевиты друг с другом, образуя плотный жгут (тропоколлаген), все 3 цепи параллельны, то есть на одном конце коллагена N-концы цепей, а на другом С-концы. Молекулы коллагена, соединяясь, образуют микрофибриллы, из них образуются пучки волокон. Тройная спираль коллагена стабилизируется межцепочечными сшивками между лизиновыми и гидроксилизиновыми остатками. Гидроксипролин стабилизирует тройную спираль коллагена по отношению к действию протеиназ и действию протеолитических ферментов. Уникальная особенность метаболизма гидроксипролина - эта АМК, входящая в состав белков пищи, не включается в коллаген, пищевой пролин является предшественником гидроксипролина в составе коллагена. На каждый моль гидроксилированного пролина декарбоксилируется 1 моль α-кетоглутарата с образованием сукцината. В результате реакции один атом кислорода поступает в сукцинат, а другой в пролин. Известно 19 типов коллагена. Определённую роль в синтезе коллагена играют белки-шапероны, обеспечивающие «контроль качества» коллагена. Ряд заболеваний связан с нарушением синтеза коллагена. Основная причина - мутации. Заболевания, связанные с нарушением синтеза коллагена - несовершенный остеогенез, хондродисплазии, семейная аневризма аорты. По мере старения - фибриллы коллагена становятся более жёсткими и хрупкими, меняются свойства хрящей, сухожилий, роговицы. Эластин - гликопротеин с множеством гидрофобных АМК, сеть полипептидных цепей, поперечно-связанных остатками десмозина, фибриллы эластина хорошо растягиваются, эластичность возникает за счёт наличия гибкой случайной конформации молекул эластина и большого количества эластичных сшивок, молекулярная масса 72 000 дальтон, основной структурный компонент эластических волокон, входит в состав кровеносных сосудов, связок, артерий. α-кератины образуют волосы, шерсть, перья, рога, когти, чешую, наружный слой кожи. Строение α-кератинов - 3 α-спирали в волосе скручены одна вокруг другой, нерастворимы в воде, так как в их составе преобладают АМК с неполярными радикалами, на поверхности фибрилл находится большое количество гидрофобных радикалов.
Использование кислорода в организме. До 80-90% фонда кислорода расходуется на окисление субстратов в митохондриальной дыхательной цепи. Помимо тканевого дыхания кислород расходуется в реакциях микросомального окисления, в реакциях, катализируемых оксигеназами, монооксигеназами, диоксигеназами. Свободный радикал – молекула с неспаренным электроном на орбите. Избыток кислорода повреждает мембраны. При гипероксии образуются свободные радикалы. Свободнорадикальное окисление – универсальный процесс, сопровождающий нормальную жизнедеятельность и активирующийся при патологии. Свободные радикалы образуются в живом организме в результате естественного метаболизма кислорода, а также в процессе окислительно-восстановительных превращений различных эндогенных субстратов, лекарств, ксенобиотиков. При физиологических условиях 5-6% потребляемого кислорода восстанавливается до О2. Активные формы кислорода - перекись водорода, свободные радикалы: супероксидрадикал, гидроксилрадикал, оксид азота. Активность форм кислорода. Свободные радикалы - промежуточные продукты нормального метаболизма. Образуются: при синтезе простагландинов, при синтезе стероидных гормонов, в дыхательной цепи, в цепи микросомального окисления, при фагоцитозе. Образование активных форм кислорода При восстановлении кислорода до воды образуются активные формы кислорода. Конечным этапом четырёхэлектронного восстановления кислорода является вода. Суммарно: О2 + 4ē + 4Н → 2 Н2О Токсичность кислорода. Свободные радикалы вовлекаются в механизмы, повышающие выживаемость клеток в неблагоприятных условиях, а снижение генерации свободных радикалов в организме способствует ослаблению клеточного иммунитета. Пути образования супероксидрадикалов. Ферментативные. Супероксидрадикал может продуцироваться в клетках ферментами : ксантиноксидазой, НАДФ-оксидазой, альдегидоксидазой, дигидрооротатоксидазой. Источник супероксидрадикала – убихинон. В процессе одноэлектронного восстановления кислорода. Под влиянием УФО. Путём взаимодействия кислорода с ионами металлов переменной валентности. Неферментативные пути - спонтанное окисление некоторых соединений: гидрохинонов, катехоламинов, лейкофлавинов, тетрагидроптеринов, фередоксина. Гидрофильный супероксидрадикал не может покидать клетку и накапливается в цитоплазме. Его превращения приводят к образованию ряда активных окислителей. Супероксидрадикал способен активировать NO-синтазу, которая образует в тканях NO-радикал. Оксид азота - вазодилятатор, антикоагулянт, снижает проницаемость сосудов, вторичный посредник: активирует растворимую гуанилатциклазу, продукт которой цГМФ проявляет вазодилятаторные свойства. Супероксидрадикал способен снижать содержание оксида азота, превращая его в пероксинитрит ONOOH. Пероксинитрит - может индуцировать апоптоз, в ходе распада может превращаться гидроксилрадикал. Токсичность нитратов и нитритов. Основное повреждающее и токсическое действие нитратов и нитритов осуществляется на стадии превращения нитритов в оксид азота. Нитриты стимулируют развитие лейкозов. Перекисное окисление липидов физиологически необходимо для - синтеза простагландинов, синтеза лейкотриенов, фагоцитоза, пиноцитоза. Тетрада ПОЛ - повреждение мембран и других липопротеинов, инактивация ферментов, подавление деления клеток, накопление инертных полимеров. Для развития ПОЛ необходимо образование радикала жирной кислоты, лишённого атома водорода путём его отрыва. RH→R · → ROO· → ROOH Затем кислород внедряется в ПНЖК с образованием пероксидного радикала ROO· .ROO· с другой ПНЖК приводит к образованию гидропероксида ROOH и нового радикала R1 · .Гидропероксиды липидов ROOH в присутствии ионов железа распадаются с образованием RО· и ·ОН, поддерживая СРО. В тканях ПОЛ имеет цепной характер. В клетках накапливаются вторичные продукты ПОЛ: альдегиды, кетоны, спирты. Накопление вторичных продуктов ПОЛ ведёт к гибели клетки. Фосфолипиды мембран содержат много ПНЖК, они легко окисляются. Модификация белковых фрагментов под действием альдегидов. ПОЛ in vivo катализируется гемовыми соединениями, липооксигеназами тромбоцитов, липооксигеназами лейкоцитов. Активация ПОЛ играет роль в развитии многих патологических процессов - лучевые поражения, злокачественный рост, гипоксия, ишемия, атеросклероз, старение, стресс. Резкое усиление СРО при недостаточности АОС приводит к развитию «оксидантного стресса» - один из общих механизмов повреждения тканей организма. В организме существует две системы защиты от чужеродных агентов: иммунная, фагоцитарная. Достоинство иммунной системы – специфичность её реакций. Преимущество фагоцитарной системы – быстрое реагирование. Гидрофобный АО α-токоферол прерывает ПОЛ , инициируемое в гидрофобном пространстве клеточных мембран.
Билет 42.
Все встречающиеся в природе аминокислоты обладают общим свойством – амфотерностью (от греч. amphoteros – двусторонний), т.е. каждая аминокислота содержит как минимум одну кислотную и одну основную группы. Общий тип строения α-аминокислот может быть представлен в следующем виде: 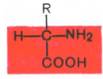 Как видно из общей формулы, аминокислоты будут отличаться друг от друга химической природой радикала R, представляющего группу атомов в молекуле аминокислоты, связанную с α-углеродным атомом и не участвующую в образовании пептидной связи при синтезе белка. Почти все α-амино- и α-карбоксильные группы участвуют в образовании пептидных связей белковой молекулы, теряя при этом свои специфические для свободных аминокислот кислотно-основные свойства. Поэтому все разнообразие особенностей структуры и функции белковых молекул связано с химической природой и физико-химическими свойствами радикалов аминокислот. Именно благодаря им белки наделены рядом уникальных функций, не свойственных другим биополимерам, и обладают химической индивидуальностью. Классификация аминокислот разработана на основе химического строения радикалов. Различают ароматические и алифатические аминокислоты, а также аминокислоты, содержащие серу или гидроксильные группы. Часто классификация основана на природе заряда аминокислоты. Если радикал нейтральный (такие аминокислоты содержат только одну амино- и одну карбоксильную группы), то они называются нейтральными аминокислотами. Если аминокислота содержит избыток амино- или карбоксильных групп, то она называется соответственно основной или кислой аминокислотой. Современная рациональная классификация аминокислот основана на полярности радикалов (R-групп), т.е. способности их к взаимодействию с водой при физиологических значениях рН (близких к рН 7,0). Различают 5 классов аминокислот, содержащих следующие радикалы: 1) неполярные (гидрофобные); 2) полярные (гидрофильные); 3) ароматические (большей частью неполярные); 4) отрицательно заряженные и 5) положительно заряженные. Существует около 28 аминокислот. В организме человека многие из них синтезируются в печени. Однако некоторые из них не могут быть синтезированы в организме, поэтому человек обязательно должен получать их с пищей. Такие аминокислоты называются незаменимыми и к ним относятся гистидин, изолейцин, лейцин, лизин, метионин, фенилаланин, треонин, триптофан и валин. Аминокислоты, которые синтезируются в печени, являются заменимыми и включают аланин, аргинин, аспарагин, аспартовую кислоту, цитруллин, цистеин, гамма-аминомасляную кислоту, глютамовую кислоту, глютамин, глицин, орнитин, пролин, серии, таурин, тирозин. Процесс синтеза белков постоянно идет в организме. В случае, когда хоть одна незаменимая аминокислота отсутствует, образование белков приостанавливается. Это может привести к самым различным серьезным проблемам — от нарушения пищеварения до депрессии и замедления роста. К дефициту аминокислот могут привести нарушение процессов всасывания из желудочно-кишечного тракта, инфекционные заболевания, травмы, стресс, прием некоторых лекарственных препаратов, процесс старения и дисбаланс других питательных веществ в организме (даже если вы потребляете достаточное количество белка).
Ресинтезированные в кишечнике липиды транспортируются в составе хиломикронов с лимфой. Липиды нерастворимы в воде, поэтому они транспортируются в ассоциации с белками. Липопротеиды – комплексы белков и липидов, транспортная форма липидов в крови. Липиды ЛП: триглицериды, фосфолипиды, холестерин. Белки ЛП – апопротеины отдельных классов ЛП. Функции апопротеинов - структурная (ЛП), транспортная, секреторная (нужны для секреции ЛП клетками печени и кишечника), необходимы для взаимодействия ЛП с рецепторами, активируют ферменты, участвующие в метаболизме ЛП, придают липидам водорастворимость, апопротеин А1 в ЛПВП активирует ЛХАТ. Структура липопротеида. Гидрофобное ядро (эфиры холестерина, ТГ) окружено снаружи фосфолипидами, свободным холестерином, апобелками. Классификация ЛП. на основании подвижности в электрическом поле: - ХМ остаются на старте, - другие мигрируют к зонам глобулинов: ß-ЛП, пре- ß-ЛП, α-ЛП. по величине гидратированной плотности (методом ультрацентрифугирования) ЛП делят на ХМ, ЛПОНП, ЛППП, ЛПНП, ЛПВП. Биологическая роль ЛП. Эндогенные ТГ доставляются в периферические клетки для обеспечения потребности в энергии, а эндогенный холестерин – для биосинтеза мембран. Состав и свойства липопротеинов. Хиломикроны транспортируют экзогенные ТГ, холестерин, фосфолипиды пищевые жиры из кишечника в ткани через лимфатическую систему. В энтероцитах синтезируются незрелые ХМ, которые сначала попадают в лимфу , а затем в кровоток. Основной апопротеин ХМ – белок В-48 синтезируется в клетках слизистой кишечника, необходим для формирования структуры ХМ. В крови незрелые ХМ получают от ЛПВП другие апобелки – С- и Е- и превращаются в зрелые ХМ. Первым органом, через который должны пройти ХМ являются лёгкие. При поступлении ХМ из кишечника в кровь происходит активация тучных клеток с выходом гепарина и активацией липопротеинлипазы. Адсорбтивная липемия - повышение количества липидов в крови, которое наступает после приёма пищи. Липопротеидлипаза (просветляющий фактор) гидролизует ТАГ в ХМ и ЛПОНП, находится в эндотелии капилляров разных органов, активируется гепарином и увеличением в крови ТАГ. ТАГ хиломикронов расщепляются на поверхности и внутри гепатоцитов, на поверхности эндотелия капилляров жировой ткани. ЛПОНП и ЛПВП - секретируются в кровь печенью, где осуществляется их синтез. ЛПНП образуются в кровотоке из ЛПОНП в результате гидролиза части ТГ ЛПОНП липопротеидлипазой. Судьба ЛПНП. На плазматических мембранах клеток имеются рецепторы к ЛПНП. ЛПНП проникают в клетки, где под влиянием гидролаз лизосом распадаются на составные компоненты, свободный холестерин включается в состав плазматической мембраны или этерифицируется и в виде эфиров откладывается в цитоплазме. Возможен неспецифический эндоцитоз ЛПНП. ЛПВП выносят холестерин в печень. В печени холестерин окисляется в желчные кислоты и удаляется через кишечник. Окисление холестерина происходит в печени монооксигеназной системой. 7а-гидроксилаза холестерина – лимитирующий фермент. ЛПВП способны акцептировать холестерин с клеточных мембран. Превращение свободного холестерина в эстерифицированный: холестерин + лецитин → лизолецитин + сложный эфир холестерина. Эфир холестерина образуется на поверхности ЛПВП и переносится в ядро ЛПВП. Снижение холестерина ЛПВП в плазме крови сопряжено со снижением ЛХАТ, количества частиц ЛПВП, лецитина, апопротеина А1. Период полураспада. ХМ – меньше часа, ЛПОНП – 2-4 часа, ЛПНП – 2-4 суток, ЛПВП – 5 суток. ЛНП и ЛВП поглощаются путём эндоцитоза клетками печени, кишечника, жировой ткани, почек, надпочечников и разрушаются в лизосомах. Неэстерифицированные жирные кислоты (НЭЖК). Жирные кислоты в плазме крови находятся в эстерифицированной форме: в составе фосфолипидов, эфиров холестерина, моно-, ди-, триглицеридов. В свободном виде жирные кислоты транспортируются в плазме из жировой ткани и печени к скелетным мышцам, в этом случае они связаны с альбумином. НЭЖК поступают в плазму крови в результате липолиза ТГ, катализируемого липазой в жировой ткани, образуются при действии липопротеидлипазы на ТГ плазмы крови в период перехода их в ткани, жирные кислоты с длиной цепи менее 1о атомов углерода всасываются в неэстерифицированной форме через систему портального кровообращения и поступают в печень (это важно для детей, так как молоко богато жирными кислотами с короткой цепью). Содержание НЭЖК - у взрослого: 0,3-0,6 ммоль/л, у ребёнка до 2,2 ммоль/л. Триацилглицериды – транспортная форма для насыщенных жирных кислот. Фосфолипиды и холестерин - транспортная форма для полиненасыщенных жирных кислот. Функции НЭЖК - дают 50% энергии при голодании, энергетический материал для миокарда, мышц, почек, печени, насыщенные жирные кислоты выполняют энергетическую, а ненасыщенные – пластическую функции. Ответ. 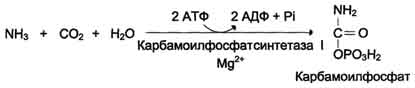 В крови больного повышается Аммиак, глутамин, ион аммония NH4+. В крови больного повышается Аммиак, глутамин, ион аммония NH4+. Билет 43.
Биосинтез заменимых АМК. Ала, глу, асп – первичные АМК. Пути синтеза: восстановительное аминирование, трансаминирование. Глутамин синтезируется из глу под действием глутаминсинтетазы. Аспарагин синтезируется из асп и глутамина. Глицин синтезируется из серина. Серин образуется из 3-фосфоглицерата. Пролин образуется из глутамата. Аргинин синтезируется в орнитиновом цикле. Гистидин синтезируется из АТФ и рибозы. Тирозин образуется из фенилаланина. Цистеин синтезируется из метионина и серина. Аланин Основной компонент соединительных тканей. Главный посредник в глюкозо-аланиновом цикле, позволяющий мышцам и другим тканям получать энергию из аминокислот. Укрепляет иммунную систему. Аспарагиновая кислота Помогает преобразовывать углеводы в мышечную энергию. Из нее строятся иммуноглобулины и антитела. Уменьшает уровень аммиака после тренировок. Глицин Помогает вырабатывать другие аминокислоты, является частью структуры гемоглобина и цитохромов (ферментов, участвующих в производстве энергии). Обладает успокаивающим эффектом, иногда применяется для лечения людей, страдающих припадками агрессивности и маниакально- депрессивным психозом. Производит глюкагон, который приводит в действие гликоген. Уменьшает желание есть сладкое. Глутаминовая кислота Главный - предшественник глутамина, пролина, агринина и глутатиона. Потенциальный источник энергии. Важная кислота для обменных процессов в мозгу и для обменных, процессов других аминокислот. Глутамин Наиболее распространенная кислота. Играет ключевую роль в работе иммунной системы. Важный источник энергии, особенно для почек и кишечника, когда приходится ограничить число калорий. Топливо для мозга - стимулирует умственную деятельность, способствует концентрации, укрепляет память. Орнитин В больших, дозах может увеличить секрецию гормона роста. Помогает работать печени и иммунной системе. Пролин Основной элемент для образования соединительных тканей и сердечной мышцы. Отвечает за мышечную энергию. Главный составной элемент коллагена. Серин Важная кислота для производства клеточной энергии. Стимулирует функции памяти и нервной системы. Укрепляет, иммунную систему. Таурин Помогает поглощению и уничтожению жиров. Может действовать как нейропередатчик в некоторых участках мозга и сетчатой оболочки глаза. Цистин Укрепляет соединительные ткани и усиливает антиокислительные процессы в организме. Способствует процессам заживления, стимулирует деятельность белых кровяных телец, помогает уменьшить болевые ощущения при воспалениях. Очень важная кислота для кожи и волос. Способствует заживлению ран. |

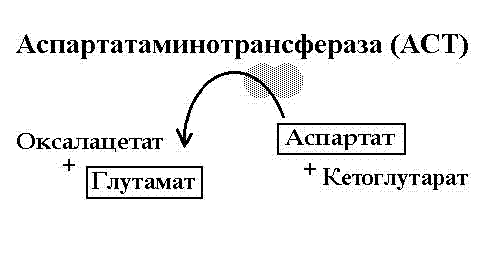 Кофермент – витамин B6.
Кофермент – витамин B6.