химия. химия ответы экз. Ответы на экзаменационные вопросы
 Скачать 0.88 Mb. Скачать 0.88 Mb.
|
[Н2О]р = 2 – 1,2 = 0,8 моль/л. | ||||||||||||||||||||
| № 39. Реакция идет согласно уравнению: А2 (г) + В2 (г) 2АВ (г). Если в системе увеличить давление, то концентрации газов увеличатся в 2 раза. Тогда: 1пр = k CА CВ , а 2пр = k 2CА 2CВ = 4k CА CВ, т.е скорость прямой реакции увеличится в 4 раза 1обр= k CАВ2 , а 2обр = k 2CАВ 2 = 4k CАВ Скорость обратной реакции также возрастет в 4 раза. При увеличении температуры на 500 С скорость прямой реакции возрастет в 32 раза, а скорость обратной – в 128 раз: 2пр/1пр = 25 = 32 2обр/1обр = 35 = 128 Равновесие будет смещено в сторону обратной реакции. | ||||||||||||||||||||
| № 40. Характеристика растворов. Растворами называются гомогенные системы переменного состава, в которых растворенное вещество находится в виде атомов, ионов или молекул, равномерно окруженных атомами, ионами или молекулами растворителя. Любой раствор состоит по меньшей мере из двух веществ, одно из которых считается растворителем, а другое - растворенным веществом. Растворителем считается компонент, агрегатное состояние которого такое же, как и агрегатное состояние раствора. Деление это довольно условно. В этом случае растворителем считается компонент, находящийся в растворе в большем количестве. Состав растворов может меняться в довольно широких пределах, в этом растворы сходны с механическими смесями. По другим признакам, таким как однородность, наличие теплового эффекта и окраски растворы сходны с химическими соединениями. Растворы могут существовать в газообразном, жидком или твердом агрегатном состоянии. Воздух, например, можно рассматривать как раствор кислорода и других газов в азоте; морская вода - это водный раствор различных солей в воде. Металлические сплавы относятся к твердым растворам одних металлов в других. Растворение веществ является следствием взаимодействия частиц растворяемого вещества и растворителя. В начальный момент времени растворение идет с большой скоростью, однако по мере увеличения количества растворенного вещества возрастает скорость обратного процесса - кристаллизации. Кристаллизацией называется выделение вещества из раствора и его осаждение. В какой-то момент скорости растворения и осаждения сравняются и наступит состояние динамического равновесия. Раствор, в котором вещество при данной температуре уже больше не растворяется, или иначе, раствор, находящийся в равновесии с растворяемым веществом, называется насыщенным. Для большинства твердых веществ растворимость в воде увеличивается с повышением температуры. Если раствор, насыщенный при нагревании, осторожно охладить так, чтобы не выделялись кристаллы, то образуется пересыщенный раствор. Пересыщенным называется раствор, в котором при данной температуре содержится большее количество растворенного вещества, чем в насыщенном растворе. Пересыщенный раствор крайне нестабилен и при изменении условий (энергичное встряхивание или внесение активных центров кристаллизации - кристалликов соли, пылинок) образуется насыщенный раствор и кристаллы соли. Раствор, содержащий меньше растворенного вещества, чем насыщенный, называется ненасыщенным раствором. В создании современной физико-химической теории растворов большую роль сыграли работы русских ученых Д.И. Менделеева, И.А. Каблукова, Д.П. Коновалова и др. В конце 19 в. все растворы считались физическими смесями веществ, в которых отсутствуют взаимодействия между растворенным веществом и растворителем. Химические явления при растворении были отмечены Д.И. Менделеевым. Взаимодействие молекул растворителя с растворенным веществом называется сольватацией, а образующиеся соединения – сольватами. Если растворителем является вода, то процесс называется гидратацией, а образующиеся соединения – гидратами. Образованием гидратов можно объяснить выделение теплоты при растворении. Образованием гидратов можно объяснить скачкообразное изменение свойств растворов при непрерывном изменении содержания растворенного вещества, что соответствует изменению состава продукта взаимодействия растворителя с растворенным веществом при увеличении содержания вещества в растворе. | ||||||||||||||||||||
| | ||||||||||||||||||||
| № 41. Понятие «растворимость» имеет качественный смысл. В качественном смысле растворимостью вещества называется его способность образовывать однородную систему с другим веществом, выполняющим функцию растворителя. Эта способность определяется характером взаимодействия между молекулами растворитель – растворитель, растворенное вещество – растворенное вещество, растворитель – растворенное вещество. Наибольшая взаимная растворимость достигается тогда, когда все эти силы имеют подобный характер. Зависимость растворимости твердых тел от температуры выражают в виде кривых (таблицы растворимости). Некоторые вещества при повышении температуры резко повышают растворимость, у других она падает. Растворимость газов падает. Неполярные или малополярные соединения хорошо растворимы в неполярных или малополярных растворителях и менее растворимы в высокополярных растворителях.. Так оксид углерода СО – малополярное соединение (дипольный момент 0,4×10-30Кл×м) – хорошо растворим в бензоле, молекулы которого неполярны, и ограниченно растворим в воде – соединении с сильно выраженным дипольным характером (дипольный момент 6,11×10-30Кл×м). Вода является хорошим растворителем полярных соединений, например аммиака или этилового спирта, не только потому, что их молекулы обладают значительной полярностью (соответственно 4,94×10-30Кл×м и 5,66×10-30Кл×м), но и потому, что при этом сохраняется характер связей, существовавших в исходных компонентах. Вместо водородных связей между молекулами каждого компонента – воды, аммиака и спирта возникают подобные вязи между растворителем и растворенным веществом. Растворимость газов в жидкостях определяется не только природой компонентов, но и изменяется в широких пределах в зависимости от давления и температуры. С увеличением давления растворимость газов в жидкостях увеличивается. Эта закономерность выражается законом Генри: рi = Кi Хi где Хi – молярная доля i –го газа в растворе; рi – парциальное давление газа над раствором; Кi – постоянная Генри для i –го компонента. Закон Генри не выполняется, если растворение газа в жидкости сопровождается образованием новых химических веществ. Закон распределения: если в системе, состоящей из 2-ух несмешиваемых растворителей ввести 3-ее вещество, которое способно раствориться в обоих растворителях, то оно распределится м/у этими растворителями, т.о. чтобы отношение его концентрации в этих растворителях при постоянной температуре оставалось величиной постоянной независящей от количества введённого 3 -го компонента. | ||||||||||||||||||||
| № 42.Растворы, в которых данное вещество при данной температуре больше не растворяется, называются насыщенными. Содержание растворенного вещества в растворе зависит от его растворимости. Такой раствор может концентрированным, а может быть и разбавленным. Важной характеристикой растворов служит их концентрация, которая выражает относительное количество компонентов в растворе. Различают массовые и объемные концентрации, размерные и безразмерные. К безразмерным концентрациям (долям) относятся следующие концентрации: Массовая доля растворенного вещества W (B) выражается в долях единицы или в процентах:
где m (B) и m (A) – масса растворенного вещества B и масса растворителя A. Мольная доля растворенного вещества χ (B) выражается соотношением
Сумма мольных долей k компонентов раствора χi равна единице 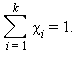 К размерным концентрациям относятся следующие концентрации: Моляльность растворенного вещества Cm (B) определяется количеством вещества n (B) в 1 кг (1000 г) растворителя, размерность моль/кг.
Молярная концентрация вещества B в растворе C (B) – содержание количества растворенного вещества B в единице объема раствора, моль/м3, или чаще моль/литр:
где μ (B) – молярная масса B, V – объем раствора. Молярная концентрация эквивалентов вещества B CЭ (B) (нормальность – устаревш.) определяется числом эквивалентов растворенного вещества в единице объема раствора, моль∙литр–1:
где nЭ (B) – количество вещества эквивалентов, μЭ – молярная масса эквивалента. Титр раствора вещества B (TB) определяется массой растворенного вещества в г, содержащегося в 1 мл раствора:
Дано: m(H2O) = 50 г Решение m(HNO3) = 50 г mр-ра(HNO3) = m(H2O) + m(HNO3) = 100 г р-ра (HNO3) = 1,52 г/см3 (HNO3) = 50 г/ 100 г = 0,5 или 50 % (массовая доля) Найти: Vр-ра (HNO3) = mр-ра(HNO3)/ р-ра (HNO3) = 100 г : 1,52 г/мл = (HNO3) = ? 65,79 мл = 0,066 л C(HNO3) = ? n (HNO3) = 50 г : 63 г/моль = 0,79 моль Cm(HNO3) = ? С (HNO3) = 0,79 моль : 0,066 л = 12 моль/л (молярность) СH(HNO3) = ? Cm(HNO3) = 0,79 моль : 0,05 кг = 15,8 моль/кг (моляльность) T(HNO3) = ? СH(HNO3) = 50 г/ 63 г/моль 0,066 л = 12 моль/л (нормальность) |
