|
|
химия. химия ответы экз. Ответы на экзаменационные вопросы
Активные вещества аккумулятора сосредоточены в электролите и положительных и отрицательных электродах, а совокупность этих веществ называется электрохимической системой. В свинцово-кислотных аккумуляторных батареях электролитом является раствор серной кислоты (H2SO4), активным веществом положительных пластин - двуокись свинца (PbO2), отрицательных пластин - свинец (Pb). Основные процессы, проходящие на электродах, описывают реакции: На отрицательном электроде:
Pb + HSO4- → PbSO4 + H+ + 2e- (разряд)
PbSO4 + H+ + 2e- → Pb + HSO4- (заряд)
На положительном электроде:
PbO2 + HSO4- + 3H+ + 2e- → PbSO4 + 2H2O (разряд)
PbSO4 + 2H2O → PbO2 + HSO4- + 3H+ + 2e- (заряд)
Суммарная реакция в свинцовом аккумуляторе имеет вид:
PbO2 + Pb + 2H2SO4 → 2PbSO4 + 2H2O (разряд)
2PbSO4 + 2H2O → PbO2 + Pb + 2H2SO4 (заряд)
Таким образом, при разряде свинцового аккумулятора на обоих электродах формируется малорастворимый сульфат свинца (двойная сульфатация) и происходит сильное разбавление серной кислоты.
Напряжение разомкнутой цепи заряженного аккумулятора равно 2,05-2,15 В, в зависимости от концентрации серной кислоты. При разряде по мере разбавления электролита напряжение разомкнутой цепи аккумулятора понижается и после полного разряда становится равным 1,95-2,03 В.
При заряде свинцово-кислотного аккумулятора, как и в других аккумуляторах с водным электролитом, имеют место побочные реакции выделения газов. Выделение водорода начинается при полном заряжении отрицательного электрода. Кислород начинает выделяться гораздо раньше: в обычных условиях заряда при 50-80% заряженности (в зависимости от тока заряда), а при температуре 0 °С уже после заряда на 30-40 %. Вследствие этого отдача положительного электрода по емкости составляет 85-90 %. Для получения полной разрядной емкости при заряде аккумулятору должен быть обеспечен перезаряд на 10-20 %. Этот перезаряд сопровождается существенным выделением водорода на отрицательном электроде и кислорода - на положительном.
Выделение водорода имеет место и при хранении заряженного свинцово-кислотного аккумулятора. Саморазряд его определяется преимущественно скоростью растворения свинца согласно реакции:
Pb + H2SO4 → PbSO4 + H2
Скорость этого процесса зависит от температуры, объема электролита и его концентрации, но более всего от чистоты компонентов. В отсутствие примесей реакция протекает медленно из-за большого перенапряжения выделения водорода на свинце. Но на практике, на поверхности свинцового электрода всегда много примесей, среди которых наибольшее влияние оказывает сурьма, количество которой в сплаве для решеток и токоведущих деталей доходит до 6 %.
На положительном электроде может также самопроизвольно проходить реакция восстановления диоксида свинца:
PbO2 + H2SO4 → PbSO4 + 1/2O2 + H2O
в результате которой выделяется кислород, но скорость ее незначительна.
В процессе эксплуатации саморазряд аккумулятора может увеличиваться из-за образования дендритных мостиков из металлического свинца. Потери емкости свежеизготовленного аккумулятора за счет саморазряда как правило не превышают 2-3 % в месяц. Но при эксплуатации они быстро увеличиваются.
В щелочных аккумуляторах положительный электрод изготавливается из никелевой решетки, пропитанной гелеобразным гидроксидом никеля II Ni(OH)2; а отрицательный – из кадмия или железа. Ионным проводником служит 20%-ый раствор гидроксида калия КОН. Суммарные токообразующие и генерирующие реакции в таких аккумуляторах имеют вид:
разряд
2NiOOH + Cd + 2H2O ◄======►2Ni(OH)2 + Cd(OH)2; ЕЭ0 = 1,45В.
заряд
разряд
2NiOOH + Fe + 2H2O ◄======►2Ni(OH)2 + Fe(OH)2; ЕЭ0 = 1,48В.
заряд
К достоинствам этих аккумуляторов относят большой срок их службы (до 10 лет) и высокую механическую прочность, а к недостаткам – невысокие КПД и рабочее напряжение. Щелочные аккумуляторы используются для питания электрокар, погрузчиков, рудничных электровозов, аппаратуры связи и электронной аппаратуры, радиоприемников. Вспомним также, что кадмий является высокотоксичным металлом, что требует соблюдения правил безопасности при утилизации отработанных устройств.
В последние годы активно разрабатываются аккумуляторы с литиевым отрицательным электродом, неводным электролитом и положительным электродом, состоящим из оксидов V2O3; NiO; CoO; MnO2. Они используются в электронной слаботоковой аппаратуре.
№ 74. Коррозия металлов – разрушение металлов и сплавов под действием окружающей среды. Это всегда окислительно-восстановительный процесс. Металл окисляется, превращаясь в положительно заряженный ион. В общем виде: Me – ne = Me+n
Известны различные виды коррозии металлов. Одним из основных её видов является химическая, которую иногда ещё называют газовой, так как иногда она происходит под воздействием газообразных компонентов из окружающей среды при высоких температурах. Химическая коррозия может происходить и под воздействием некоторых агрессивных жидкостей. Основным этого процесса является то, что она происходит без возникновения в системе электрического тока. Ей подвергаются детали и узлы машин, работающих в атмосфере кислорода при высоких температурах, например турбинные двигатели, ракетные двигатели и некоторые другие, а также подвергаются детали узлы оборудования химического производства.
Другим распространённым видом разрушения металлов является электрохимическая коррозия - поверхностное разрушение в среде электролита с возникновением в системе электрического тока. Характер разрушения поверхности металла может быть различным и зависит от свойств этого металла и условиях протекания процесса. Теперь остановимся подробнее на электрохимической коррозии.
Электрохимическая коррозия. Этот вид коррозии наиболее распространен и включает те случаи, когда процессы окисления металла и восстановления окислительного компонента протекают раздельно в среде жидкого электролита, т.е. в среде, проводящей электрический ток. Такими средами могут являться: природная вода, водные растворы солей, кислот, щелочей, а также воздух, почва и теплоизоляционные конструкции, содержащие электролит (влагу) в определенном количестве. Таким образом, процесс электрохимической коррозии представляет собой совокупность двух сопряженно протекающих реакций: анодной (окисление) Ме → Ме z+ + ze- (2),
и катодной (восстановление) D + ze- → (Dze- ) (3),
где D – деполяризатор (окислитель), присоединяющий к себе электроны металла. В качестве деполяризатора могут выступать: кислород, растворенный в электролите, ионы водорода (Н+) и некоторых металлов. Общая схема электрохимического коррозионного процесса металла приведена на рисунке 3, а частный случай ржавления железа описывается реакцией:
2Fe + 2H2O + O2 → 2Fe2+ + 4 OH- (4).
Возникновение гальванических элементов «катод – анод» на углеродистых сталях (основного конструкционного материала трубопроводов) при их контакте с электролитами происходит в основном из-за дифференциации поверхности сталей на участки с различными электродными потенциалами (теория локальных коррозионных элементов). Причины дифференциации могут быть различны:
1) неоднородность структуры металла (в углеродистых сталях присутствуют фазы – феррит и цементит, структурные составляющие – перлит, цементит и феррит, имеющие различные электродные потенциалы);
2) наличие на поверхности сталей оксидных пленок, загрязнений, неметаллических включений и т.п;
3) неравномерное распределение окислителя на границе «металл-электролит», например, различные влажность и аэрация на различных участках поверхности металла;
4) 0 неравномерность распределения температуры;
5) контакт разнородных металлов.
Защита от коррозии: изоляция металлов от агрессивной среды. Защитить металл от разрушения можно путём создания на его поверхности защитной плёнки - покрытия. Пути создания защитных плёнок различны. Например, корродирующий металл покрывают слоем другого металла, который не разрушается при тех же условиях. В качестве покрытий используются неметаллические покрытия, органические материалы - плёнки высокополимерных веществ, лаки, олифа, а также композиции из высокополимерных и неорганических красящих веществ.
Особое значение имеют плёнки из оксидов металлов, получаемые при действии кислорода или подходящих окислителей (азотная кислота HNO3, дихромат калия K2Cr2O7 и др.) на поверхность металлов. Часто такие оксидные плёнки образуются на поверхности металлов даже просто при соприкосновении с воздухом, что делает химически-активные металлы (алюминий, цинк) коррозионностойкими.
Подобную роль играют защитные нитридные покрытия, образующиеся при действии азота или аммиака на поверхность некоторых металлов. Искусственное оксидирование, азотирование, фосфатирование - хорошая защита металлов от коррозии.
Электрохимическая защита металлов основана на изменении потенциала защищаемого металла и не связана с изоляцией металла от коррозионной среды. К ней относится катодная защита. Её называют также анодная защита.
Катодная защита - заключается в том, что защищаемая конструкция "А", находящаяся в среде электролита (например, в почвенной воде), присоединяется к катоду (отрицательно заряженный электрод) источника электричества. Защищаемая конструкция становится катодом. В ту же агрессивную среду помещают кусок старого металла (рельс или балка), присоединяемый к аноду внешнего источника электричества. В процессе коррозии этот кусок старого металла становится анодом и разрушается.
Протекторная защита - отличается от катодной защиты тем, что для её осуществления используется специальный анод - протектор, в качестве которого применяют металл более активный, чем металл защищаемой конструкции (алюминий, цинк). Протектор соединяют с защищаемой конструкцией проводником электрического тока. В процессе коррозии протектор служит анодом (положительно заряженный электрод) и разрушается, тем самым предохраняя от разрушения нашу охраняемую конструкцию.
Рассмотрим коррозионный процесс повреждения металлических защитных покрытий.
1. Если металл покрыт менее активным металлом. Например, олово (Sn) хорошо покрывает железо (Fe) и достаточно стойко против действия разбавленных кислот. В случае повреждения такого покрытия возникает гальваническая пара, в которой электроны переходят от железа к олову, то есть анод - железо (оно растворяется и разрушается), а катод - олово (остаётся без изменений).
2. Если металл покрытия более активный, чем защищаемый металл. Например, покрытия железа (Fe) цинком (Zn). При механическом повреждении цинкового покрытия возникает гальваническая пара, в которой железо служит катодом (не растворяется), а цинк - анодом. В этом случае железо не будет разрушаться до тех пор, пока не разрушится весь цинк.
Из этих случаев можно сделать вывод, что белее надёжное защитное покрытие то, что из металла более активного, чем защищаемый металл.
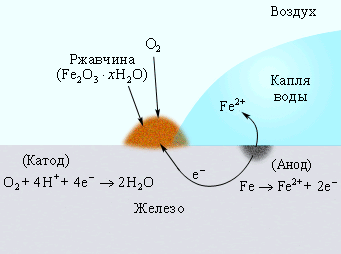 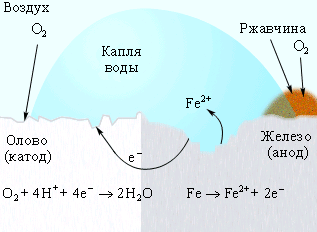 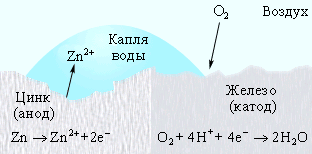
Коррозия железа кислородом Коррозия «белой жести» Катодная защита
воздуха, растворенным (железо покрыто оловом) в оцинкованном железе
в воде
№ 75. Металлические покрытия на поверхности изделия можно получить разными способами: погружением в расплавленный металл, гальванической обработкой, распылением, плакированием. При погружении деталей в расплавленный металл образуется защитная пленка, не только устойчивая к действию коррозионно-активных веществ, но и обладающая высокой механической прочностью. Таким способом покрывают изделия оловом (лужение), цинком (цинкование) и другими металлами и сплавами.
Гальваническое покрытие — осаждение слоя защитного металла на поверхности детали из раствора электролита, через который пропускают электрический ток. Это наиболее совершенный вид покрытия, обеспечивающий создание равномерной прочной защитной пленки (получение цинкованных, хромированных и других поверхностей).
Цинкование применяют для защиты от коррозии деталей машин, работающих вне помещения, а также в закрытых помещениях с умеренной влажностью, загрязненных газами и продуктами сгорания. Преимущество цинковых покрытий — сохранение защитных свойств при малой толщине, наличии пор и обнаженных участков: в первую очередь разрушается цинк, изделие коррозии не подвергается. Кадмирование (покрытие слоем кадмия толщиной 10—15 мкм, для тяжелых условий 20—25 мкм) позволяет обеспечить защиту стальных деталей в условиях контакта с кислыми растворами, щелочами, морской и горячей водой.
Распыление (электрометаллизация) заключается в нанесении на поверхность специальным аппаратом расплавленного защитного металла. На прокатных станах металлургических предприятий можно получать биметаллические материалы, например, черные металлы, покрытые тонким слоем нержавеющей стали или меди (плакирование). Эффективным способом защиты от коррозии является нанесение на поверхность металла газопламенной наплавкой нескольких слоев полимеров и др.
|
№ 76. Для изоляции металла от окружающей среды на него наносят различного рода покрытия: лаки, краски, металлические покрытия. Наиболее распространенными являются лакокрасочные покрытия, однако их механические свойства значительно ниже, чем у металлических. Последние по характеру защитного действия можно разделить на анодные и катодные.
Анодные покрытия. Если на металл нанести покрытие из другого, более электроотрицательного металла, то в случае возникновения условий для электрохимической коррозии разрушаться будет покрытие, т.к. оно будет выполнять роль анода. В этом случае покрытие называется анодным. Примером анодного покрытия может служить хром, нанесенный на железо. В случае нарушения целостности покрытия при контакте с влажным воздухом будет работать гальванический элемент:
А (–) Cr | H2O, O2 | Fe (+) К
на аноде: Cr – 2e Cr2+
на катоде: 2 H2O + O2 + 4e 4 OH–
Cr2+ + 2 OH– Cr(OH)2
Гидроксид хрома (II) окисляется кислородом воздуха до Cr(OH)3:
4 Cr(OH)2 + 2H2O + O2 4 Cr(OH)3
Таким образом, в результате электрохимической коррозии разрушается анодное покрытие.
Катодные покрытия. У катодного покрытия стандартный электродный потенциал более положителен, чем у защищаемого металла. Пока слой покрытия изолирует металл от окружающей среды, электрохимическая коррозия не протекает. При нарушении сплошности катодного покрытия оно перестает защищать металл от коррозии. Более того, оно даже интенсифицирует коррозию основного металла, т.к. в возникающей гальванопаре анодом служит основной металл, который будет разрушаться. В качестве примера можно привести оловянное покрытие на железе (луженое железо). Рассмотрим работу гальванического элемента, возникающего в этом случае.
А (–) Fe | H2O, O2 | Sn (+) К
на аноде: Fe – 2e Fe2+
на катоде: 2 H2O + O2 + 4e 4 OH–
Fe2+ + 2 OH– Fe(OH)2
Разрушается защищаемый металл. Таким образом, при сравнении свойств анодных и катодных покрытий можно сделать вывод, что наиболее эффективными являются анодные покрытия. Они защищают основной металл даже в случае нарушения целостности покрытия, тогда как катодные покрытия защищают металл лишь механически.
|
№ 77. К анодным покрытиям относят покрытия, потенциалы которых в данной среде имеют более отрицательные значения, чем потенциал защищаемого (основного) металла. Так, для анодного покрытия стали служит цинк. В этом случае основной металл будет катодом коррозионного элемента, поэтому не корродирует (рис. 8.10)
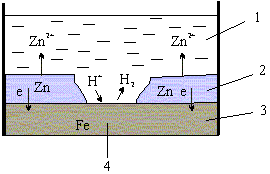  
1 - раствор; 2- покрытие;
3 - основной металл; 4 - пора.
1. Коррозия оцинкованного железа во влажном воздухе: при контакте Zn – Fe в нейтральной среде. При контакте двух металлов различной электрохимической активности возникает гальванический элемент. В нейтральной среде его схема выглядит следующим образом:
А (–) Zn| H2O, O2 | Fe (+) K
Так как цинк электрохимически более активен (см. ряд напряжений металлов), он будет окисляться (корродировать). На железе будет протекать восстановительный процесс (в нейтральной среде – кислородная деполяризация):
А (–): Zn – 2e- = Zn2+
K (+): 2H2O + O2 + 4e- = 4OH–
Продукт коррозии – Zn(OH)2.
Ответ: Zn(OH)2.
2. Коррозия оцинкованного железа в кислой среде. При контакте Zn – Fe в кислой среде (HCl).При контакте двух металлов различной электрохимической активности возникает гальванический элемент. Его схема для кислой среды раствора:
A (–) Zn | HCl | Fe (+) K
Так как цинк электрохимически более активен (см. ряд напряжений металлов), он будет окисляться (корродировать). На железе будет протекать восстановительный процесс (в кислой среде – водородная деполяризация):
А (–): Zn – 2e- = Zn2+
K (+): 2H+ + 2e- = H2.
Продукт коррозии : ZnCl2.
Ответ: ZnCl2.
3. Коррозия луженного железа во влажном воздухе: при контакте Sn – Fe в нейтральной среде. При контакте двух металлов различной электрохимической активности возникает гальванический элемент. В нейтральной среде его схема выглядит следующим образом:
А (–) Fe| H2O, O2 | Sn (+) K
Так как железо электрохимически более активно (см. ряд напряжений металлов), оно будет окисляться (корродировать). На олове будет протекать восстановительный процесс (в нейтральной среде – кислородная деполяризация):
А (–): Fe – 2e- = Fe2+
K (+): 2H2O + O2 + 4e- = 4OH–
Продукт коррозии – Fe(OH)2.
Ответ: Fe(OH)2.
4. Коррозия луженного железа в кислой среде. При контакте Sn – Fe в кислой среде (HCl).При контакте двух металлов различной электрохимической активности возникает гальванический элемент. Его схема для кислой среды раствора:
A (–) Fe | HCl | Sn (+) K
Так как железо электрохимически более активно (см. ряд напряжений металлов), оно будет окисляться (корродировать). На олове будет протекать восстановительный процесс (в кислой среде – водородная деполяризация):
А (–): Fe – 2e- = Fe2+
K (+): 2H+ + 2e- = H2.
Продукт коррозии: FeCl2.
Ответ: FeCl2. Происходит во всех случаях электрохимическая коррозия.
|
№ 78. Коррозия никелированной меди во влажном воздухе: при контакте Ni – Cu в нейтральной среде. При контакте двух металлов различной электрохимической активности возникает гальванический элемент. В нейтральной среде его схема выглядит следующим образом:
А (–) Ni | H2O, O2 | Cu (+) K
Так как никель электрохимически более активен (см. ряд напряжений металлов), он будет окисляться (корродировать). На меди будет протекать восстановительный процесс (в нейтральной среде – кислородная деполяризация):
А (–): Ni – 2e- = Ni2+
K (+): 2H2O + O2 + 4e- = 4OH–
Продукт коррозии – Ni(OH)2.
Ответ: Ni(OH)2.
Нарушение покрытия ускоряет скорость коррозии в том случае, если поверхность металла покрыта менее активным металлом. Это объясняется работой гальванического элемента менее активный металл – более активный металл. Трещины и царапины заполняются влагой, в результате чего образуются растворы, ионные процессы в которых облегчают протекание электрохимического процесса (коррозии).
|
79. Цинковая пластина:
Zn + CuSO4 → Cu↓ + ZnSO4
Zn0 - 2e → Zn2+
Cu2+ + 2e → Cu0
Железная пластина:
Fe + CuSO4 → Cu↓ + FeSO4
Fe0 - 2e → Fe2+
Cu2+ + 2e → Cu0
При замыкании пластин:
Стандартные электродные потенциалы железа и цинка:
E0Fe2+/Fe = -0,44 B
E0Zn2+/Zn = -0,76 B
Т.к. E0Zn2+/Zn < E0Fe2+/Fe, железо будет катодом, а цинк - анодом.
A: Zn0 - 2e → Zn2+ - окисление
К: Cu2+ + 2e → Cu0 - восстановление
На железе восстанавливается медь, а цинк растворяется.
|
80. Протекторная защита от коррозии. Протекторная защита является разновидностью катодной защиты. К защищаемой конструкции присоединяют более электроотрицательный металл — протектор — который, растворяясь в окружающей среде, защищает от разрушения основную конструкцию. После полного растворения протектора или потери контакта с защищаемой конструкцией, протектор необходимо заменить.
Протектор работает эффективно, если переходное сопротивление между ним и окружающей средой невелико. Действие протектора ограничивается определенным расстоянием. Максимально возможное удаление его от защищаемой конструкции называется радиусом защитного действия протектора.
Протекторную защиту применяют в тех случаях, когда получение энергии извне для организации катодной защиты связано с трудностями, а сооружение специальных электролиний экономически невыгодно. Протекторную защиту применяют для борьбы с коррозией металлических конструкций в морской и речной воде, грунте и других нейтральных средах. Использование протекторов в кислых растворах нецелесообразно вследствие высокой скорости саморастворения.
Однако использовать чистые металл в качестве протекторов не всегда целесообразно. Так, например, чистый цинк растворяется неравномерно из-за крупнозернистой дендритной структуры, поверхность чистого алюминия покрывается плотной оксидной пленкой, магний имеет высокую скорость собственной коррозии. Для придания протекторам требуемых эксплуатационных свойств в их состав вводят легирующие элементы. Cd, In, Gl,Hg,Tl,Mn,Si (от сотых до десятых долей процента), способствующие требуемому изменению параметров решетки. Магниевые протекторные сплавы в качестве легирующих добавок содержат А1 (5-7 %) и Zn (2-5 %); содержание таких примесей, как Fe, Ni, Cu,Pb, Si поддерживают на уровне десятых или сотых долей процента. Железо в качестве протекторного материала используют либо в чистом виде либо в виде углеродистых сталей.
Алюминиевые протекторы применяют для защиты сооружений, эксплуатирующихся в проточной морской воде, а также для защиты портовых сооружений и конструкций, располагающихся в прибрежном шельфе.
|
|
|
|
 Скачать 0.88 Mb.
Скачать 0.88 Mb.