химия. химия ответы экз. Ответы на экзаменационные вопросы
 Скачать 0.88 Mb. Скачать 0.88 Mb.
|
Таким образом отношение масс этиленгликоля и воды = 2:3 |
| № 50. Определим Сm в соответствии с законом Рауля t = Kкр · Сm Сm Отсюда, так как t = 250, Kкр (Н2О) = 1,86, тогда Сm = 25/1,86 = 13,44 моль/кг, m (С2Н4(ОН)2) = 13,44 · 62 = 833 г , при плотности 1116 кг/м3 V(С2Н4(ОН)2) = 746 мл. Тогда соотношение воды и этиленгликоля по объёму 1000: 746 = 4 : 3 |
| № 51.Вычислите массовую долю сахара С12Н22О11 в водном растворе, зная температуру кристаллизации раствора (–0,93°С). Криоскопическая константа воды 1,86°С. Решение. Δt = Cm(C12H22O11)·Kк Тзам. = 0 – Δt -0,93 = 0 – Δt Δt = 0,93°C 0,93 = Cm(C12H22O11)·1,86 Cm(C12H22O11) = 0,5 моль/кг ω(C12H22O11) = 342·0,5·100/(1000 + 342·0,5) = 14,6% |
№ 52. Имеется 15% водный раствор пропилового спирта. Кэ (Н2О) = 0,53.Пусть масса раствора равна 1000 г, тогда масса спирта = 150 г, молярная масса спирта = 60 г/моль n(C3H7OH) = 150 / 60 = 2,5 моль Сm = 2,5 моль/кг. Тогда t = 2,5 0,53 = 1,325 T кип = 100 + 1,325 = 101,325 0С |
| |
№ 53. Так как в 1 литре растворе неэлетролита содержится 2,01 ·1023 молекул, то можно рассчитать: количество вещества неэлектролита, разделив число молекул на число Авогадроt = Ккр (Н2О) Сm = 1,86 0,33 = 0,6 tзам = 0 – 0,6 = - 0,60С |
| № 54. Вещества, распадающиеся в растворах или расплавах на ионы, называют электролитами. Электролитами являются соли, кислоты и основания. При растворении в воде электролиты распадаются (диссоциируют) на положительно и отрицательно заряженные ионы. Положительно заряженные ионы называются катионами; например, ионы водорода и металлов. Отрицательно заряженные ионы называются анионами; к ним принадлежат ионы кислотных остатков, гидроксид-ионы. Диссоциация НС1 и NaCl выразится уравнением: HCl = H+ + Cl- NaCl =Na++ Cl- В зависимости от структуры растворяющегося вещества в безводном состоянии (ионная или полярная связь) его диссоциация протекает по-разному. Когда кристалл соли, например, хлорида калия, попадает в воду, то расположенные на его поверхности ионы притягивают к себе полярные молекулы воды (ион-дипольное взаимодействие). К ионам калия молекулы воды притягиваются своими отрицательными полюсами, а к хлорид-ионам — положительными. 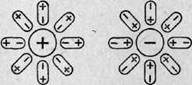 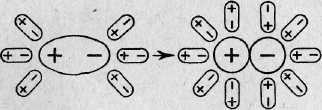 Рис. 1. Схема диссоциации полярных молекул в растворе Иначе протекает диссоциация полярных молекул (рис. 1). Молекулы воды, притянувшиеся к концам полярной молекулы (диполь-дипольное взаимодействие), вызывают расхождение ее полюсов — поляризуют молекулу. Такая поляризация в сочетании с колебательным тепловым движением атомов в молекуле, а также с тепловым движением окружающих ее молекул воды приводит к распаду полярной молекулы на ионы. Как и в случае растворения ионного кристалла, эти ионы гидратируются. Ион водорода Н+ (протон) оказывается прочно связанным с молекулой воды в ион гидроксония Н3О+. Так, при растворении в воде хлороводорода и азотной кислоты происходят процессы, которые можно выразить уравнениями Н2О + НСl = Н3О+ + Сl ˉ Н2О + HNO3 = Н3О+ + NO3ˉ В результате этого процесса молекула НСl расщепляется таким образом, что общая пара электронов остается у атома хлора, который превращается в ион Сlˉ, а протон, внедряясь в электронную оболочку атома кислорода в молекуле воды, образует ион гидроксония Н3О+ . Перешедшие в раствор ионы остаются связанными с молекулами воды и образуют гидраты ионов. В результате диссоциации образуются не свободные ионы, а соединения ионов с молекулами растворителя. В общем случае любого растворителя эти соединения называются сольватами ионов. Но в уравнениях диссоциации обычно пишут формулы ионов, а не их гидратов или сольватов, тем более, что число молекул растворителя, связанных с ионами, изменяется в зависимости от концентрации раствора и других условий. Степень диссоциации. Сила электролитов. Чаще всего в растворе лишь часть электролита диссоциирует на ионы, поэтому существует понятие степени диссоциации. Степенью диссоциации электролита называется отношение числа его молекул, распавшихся в данном растворе на ионы, к общему числу его молекул в растворе. В связи с этим электролиты можно разделить на две группы - сильные и слабые электролиты. Сильные электролиты в водных растворах диссоциированы практически полностью. Понятие степени диссоциации к ним не применимо. Слабые электролиты в водных растворах диссоциируют только частично, и в растворе устанавливается динамическое равновесие между недиссоциированными молекулами и ионами. К сильным электролитам принадлежат почти все соли; из кислот и оснований к ним относятся HNO3, HCIO4, НСI, HBr, HI, КОН, NaOH, Ba(OH)2 и Са(ОН)2. К слабым электролитам относится большинство органических кислот, а из важнейших неорганических соединений к ним принадлежат Н2СО3, H2S, HCN, H2SiО3и NH4OH. Степень диссоциации принято обозначать греческой буквой ά и выражать либо в долях единицы, либо в процентах. Так, для 0,1 н. раствора СН3СООН ά = 0,013 (или 1,3%), а для 0,1 н. раствора HCN ά = 10ˉ4 (или 0,01%). Константа диссоциации. К равновесию, которое устанавливается в растворе слабого электролита между молекулами и ионами, можно применить законы химического равновесия и записать выражение константы равновесия. Например, для диссоциации уксусной кислоты СН3СООН → Н+ + СН3СООˉ константа равновесия имеет вид: К = ([Н+] [СНзСООˉ])/[СНзСООН] Здесь в числителе дроби стоят концентрации ионов — продуктов диссоциации, а в знаменателе — концентрация недиссоциированных молекул. Константа равновесия, отвечающая диссоциации слабого электролита, называется константой диссоциации. Величина К зависит от природы электролита и растворителя, а также от температуры, но не зависит от концентрации раствора. Она характеризует способность данного вещества распадаться на ионы: чем выше К, тем легче электролит диссоциирует. |
