химия. химия ответы экз. Ответы на экзаменационные вопросы
 Скачать 0.88 Mb. Скачать 0.88 Mb.
|
|
| |||||||||||||||||||||||||||||||
| № 55. Соли – электролиты, которые диссоциируют на катионы металлов и анионы кислотных остатков Na2CO3 Û 2 Na+ + CO32- AlCl3 Û Al3+ + 3 Cl- Cr2(SO4)3 Û 2 Cr3+ + 3 SO42- Основания- электролиты, которые диссоциируют на катионы металлов и гидроксид-анионы Ba(OH)2 = Ba2+ + 2OH- Сa(OH)2 = Сa2+ + 2OH- Кислоты – электролиты, которые дисоциируют на катионы водорода (гидроксония) и анионы кислотных остатков. H Cl = H+ + Cl - Многоосновные кислоты диссоциируют ступенчато. На каждой ступени отщепляется один ион водорода. H2SO4 = H+ + HSO4- (I ступень) HSO4- = H+ + SO42- (II ступень) Химические свойства солей. 1. Взаимодействие с кислотами MgCO3 + 2HCl = MgCl2+ H2О +CO2 MgCO3 + 2H+ = Mg2+ + H2О +CO2 2. Взаимодействие со щелочами Na2SO4 + Ba(OH)2 = 2NaOH + BaSO4¯ 3. Взаимодействуют с металлами Cu + 2 Ag+ = Cu2+ + 2 Ag ¯ 4. Обменные реакции с другими солями. CaCl2 + Na2SiO3 = CaSiO3¯ + 2NaCl Ca2+ + SiO32- = CaSiO3¯ Химические свойства оснований: 1. Основания реагируют с кислотами с образованием соли и воды: 2NaOH + H2SO4 = Na2SO4 + 2H2O 2. Основания реагируют с оксидами неметаллов с образованием соли и воды. CO2 + 2 NaOH = Na2CO3 + H2O 3. Растворимые в воде основания реагируют с солями. CuSO4 + 2NaOH = Cu(OH)2¯ + Na2SO4 4. Нерастворимые в воде основания разлагаются при нагревании на оксид металла и воду: t0 Cu(OH)2 = CuO + H2O Химические свойства кислот: 1. Кислоты реагируют с основаниями с образованием соли и воды. NaOH + HCl = NaCl + H2O Н+ + ОН- = Н2О 2. Кислоты реагируют с оксидами металлов с образованием соли и воды. CuO + H2SO4 = CuSO4 + H2O CuO + 2 H+ = Cu2+ + H2O 3. Кислоты взаимодействуют с металлами, образуя соль и водород. Zn + 2 H+ = Zn2+ + H2 4. Кислоты взаимодействуют с солями. 2 H+ + CO32- = H2O + CO2 Амфотерные гидроксиды взаимодействуют как с кислотами, так и с основаниями с образованием солей. Al(OH)3 + 3HCl = AlCl3 + 3H2O Al(OH)3 + 3H+ = Al3+ + 3H2O Al(OH)3 + NaOH = NaAl(OH)4 Al(OH)3 + OH- = Al(OH)4- Кислые соли – продукты неполной нейтрализации многоосновных кислот основаниями. Например NaHCO3 – гидрокарбонат натрия. При растворении в воде дисоциирует NaHCO3 = Na + + HCO3- Основные соли – продукты неполной нейтрализации многокислотных оснований кислотами. Например Fe(OH)Cl2 гидроксохлорид железа (III). При растворении диссоциирует Fe(OH)Cl2 = Fe(OH) 2+ + 2Cl- Перманганат калия относится к средним солям. Диссоциирует: KMnO4 = K+ + MnO4 - | |||||||||||||||||||||||||||||||
| № 56. С гидроксидом калия КОН будут взаимодействовать следующие вещества: Al(OH)3, H2SO4 KOH + Al(OH)3 = KAl(OH)4 K+ + OH- + Al(OH)3 = K+ + Al(OH)4- OH- + Al(OH)3 = Al(OH)4- 2KOH + H2SO4 = K2SO4 + 2H2O 2K+ + 2OH- + 2H+ + SO42- = 2K+ + SO42-+ 2H2O 2OH- + 2H+ = 2H2O OH- + H+ = H2O С гидроксидом бария гидроксид калия не реагирует. Оба вещества являются основаниями и между ними не возможно взаимодействие | |||||||||||||||||||||||||||||||
| № 57. С раствором серной кислоты будут взаимодействовать следующие вещества: Al(OH)3, NiSO4, Na2S: 2Al(OH)3 + 3H2SO4 = Al2(SO4)3 + 6H2O 2Al(OH)3 + 6H + + 3SO42- = 2Al3+ + 3SO42-+ 6H2O 2Al(OH)3 + 6H + = 2Al3+ + 6H2O Al(OH)3 + 3H + = Al3+ + 3H2O NiSO4 + H2SO4 = Ni(HSO4)2 в этом случае образуется кислая соль гидросульфат никеля Na2S + H2SO4 = Na2SO4 + H2S 2Na+ + S2- + 2H + + SO42- = 2Na+ + SO42- + H2S S2- + 2H + - = H2S С уксусной кислотой серная кислота не реагирует (вещества одной природы) | |||||||||||||||||||||||||||||||
| № 58. С раствором гидроксида натрия будут реагировать: NiSO4, Be(OH)2, KHCO3 NiSO4 + 2NaOH = Ni(OH)2 + Na2SO4 Ni2+ + SO42- + 2Na + + 2OH- = Ni(OH)2 + 2Na + + SO42- Ni2+ + 2OH- = Ni(OH)2 2NaOH + Be(OH)2 = Na2Be(OH)4 2Na+ + 2OH- + Be(OH)2 = 2Na+ + Be(OH)42- 2OH- + Be(OH)2 = Be(OH)42- 2KHCO3 + 2NaOH = K2CO3 + Na2CO3 + 2H2O 2K+ + 2HCO3- +2Na+ + 2OH- = 2K+ + CO32- +2Na+ + CO32- + 2H2O 2HCO3- + 2OH- = 2CO32- + 2H2O HCO3- + OH- = CO32- + H2O | |||||||||||||||||||||||||||||||
| № 59. Жесткость воды отражает содержание в ней ионов кальция и магния Ca2+ и Mg2+. Жесткость, обусловленная наличием в воде гидрокарбонатов кальция и магния, называется временной, или карбонатной (Жвр). Жесткость, обусловленная хлоридами и сульфатами этих металлов, называется постоянной (Жп). Суммарная жесткость воды носит название общей жесткости. Жесткость воды (степень жесткости принято выражать в миллимолях ионов Са2+ или Mg2+ (или обоих ионов) в 1 дм3 или 1 кг воды – ммоль/дм3 или ммоль/кг. В технической литературе встречается единица измерения степени жесткости воды – мг экв/дм3 или мг-экв/кг. Зная, что молярные массы эквивалентов ионов Са2+ и Mg2+ соответственно равны 20,04 и 12,16 мг/дм3, можно рассчитать обжую жесткость воды (в ммоль/дм3) Жесткость воды
Существует множество способов устранения жёсткости: Карбонатную жёсткость устраняют: 1) Кипячением: Ca(HCO3)2→CaCO3↓+H2O+CO2 Mg(HCO3)2→MgCO3↓+H2O+CO2 2) Действием известкового молока или соды: Ca(OH)2+Ca(HCO3)2→2CaCO3↓+2H2O Ca(HCO3)2+NaCO3→CaCO3↓+2NaHCO3 Некарбонатную жёсткость устраняют действием соды: CaSO4+Na2CO3→CaCO3↓+Na2SO4 MgSO4+Na2CO3→MgCO3↓+Na2SO4 Лучшим реагентом для устранения общей жесткости воды является ортофосфат натрия Na3PO4: 3Ca(HCO3)2 + 2Na3PO4 → Ca3(PO4)2↓+ 6NaHCO3 3MgSO4 + 2Na3PO4 → Mg3(PO4)2↓ + 3Na2SO4 Ортофосфаты кальция и магния очень плохо растворимы в воде, поэтому достигается лучшее умягчение воды. Обратный осмос. Метод основан на прохождении воды через полупроницаемые мембраны (как правило, полиамидные). Вместе с солями жёсткости удаляется и большинство других солей. Эффективность очистки может достигать 99,9 %. Этот метод нашёл наибольшее применение в бытовых системах подготовки питьевой воды. В качестве недостатка данного метода следует отметить необходимость предварительной подготовки воды, подаваемой на обратноосмотическую мембрану. Электродиализ. Основан на удалении из воды солей под действием электрического поля. Удаление ионов растворенных веществ происходит за счёт специальных мембран. Так же как и при использовании технологии обратного осмоса, происходит удаление и других солей, помимо ионов жёсткости. Термический способ. Основан на нагреве воды, устраняет только временную (карбонатную) жёсткость. Находит применение в быту. В промышленности применяется, например, на ТЭЦ. Реагентное умягчение. Метод основан на добавлении в воду соды или гашеной извести. При этом соли кальция и магния переходят в нерастворимые соединения и, как следствие, выпадают в осадок. Этот метод оправдан при относительно больших расходах воды, поскольку связан с решением ряда специфических проблем: фильтрации осадка, точной дозировки реагента. Катионирование. Метод основан на использовании ионообменной гранулированной загрузки (чаще всего ионообменные смолы). Такая загрузка при контакте с водой поглощает катионы солей жёсткости (кальций и магний, железо и марганец). Взамен, в зависимости от ионной формы, отдавая ионы натрия или водорода. Эти методы соответственно называются Na-катионирование и Н-катионирование. При правильно подобранной ионообменной загрузке жёсткость воды снижается при одноступенчатом натрий-катионировании до 0,05-0,1 мг-экв/л, при двухступенчатом — до 0,01 мг-экв/л. В промышленности с помощью ионообменных фильтров заменяют ионы кальция и магния на ионы натрия и калия, получая мягкую воду. Определенное умягчение воды происходит и в бытовых фильтрах для питьевой воды. Отфильтрованная вода дает меньше накипи. Полностью очистить воду можно методом перегонки (дистилляцией). | |||||||||||||||||||||||||||||||
| № 60. Схема гальванического элемента, который состоит из марганцевого анода и стандартного водородного потенциала, следующая: анод (-) Mn |Mn2+| 2H+ |Pt, H2 (+) катод На аноде происходит процесс окисления марганца Mn – 2e = Mn 2+ На катоде восстанавливаются ионы водорода 2Н+ + 2е = Н2 Суммарное уравнение реакции: Mn + 2H+ = Mn2+ + H2 Рассчитаем ЭДС гальванического элемента, зная, что концентрация ионов марганца составляет 0,01 моль/л. E = к - а Поскольку катодом является стандартный водородный электрод, его потенциал равен 0. Потенциал анода рассчитываем по уравнению Нернста а = 0 Mn2+ /Mn + 0,059 lgNi2+/n = -1,05 + 0,059 lg10-2/2 = -1,05 – 0,059 = - 1,109 В Е = 0 – (-1,109) = 1,109 В Ответ: 1,109 В | |||||||||||||||||||||||||||||||
| № 61. Количественной характеристикой способности веществ вступать в окислительно-восстановительные реакции (ОВР) является электродный потенциал. Электродный потенциал - разность электрических потенциалов между электродом и находящимся с ним в контакте электролитом (чаще всего между металлом и раствором электролита). Возникновение электродного потенциала обусловливается переносом заряженных частиц через границу раздела фаз, специфической адсорбцией ионов, а при наличии полярных молекул (в том числе молекул растворителя) — ориентационной адсорбцией их. Величина электродного потенциала в неравновесном состоянии зависит как от природы и состава контактирующих фаз, так и от кинетических закономерностей электродных реакций на границе раздела фаз. Равновесное значение скачка потенциалов на границе раздела электрод/раствор определяется исключительно особенностями электродной реакции и не зависит от природы электрода и адсорбции на нём поверхностно-активных веществ. Эту абсолютную разность потенциалов между точками, находящимися в двух разных фазах, нельзя измерить экспериментально или рассчитать теоретически. Практическое значение имеют относительные электродные потенциалы, обычно называемые просто электродными потенциалами, представляющие собой разность электродных потенциалов рассматриваемого электрода и электрода сравнения — чаще всего нормального водородного электрода, электродный потенциал которого условно принимается равным нулю. Стандартный электродный потенциал (Е0) металла – это ЭДС гальванического элемента при условии, что один полуэлемент – водородный (СН+ = 1 моль/л, РН2 = 1атм, Т = 250С), а второй – металл, погруженный в раствор его соли с концентрацией ионов металла 1 моль/л. Металлы, расположенные в порядке возрастания их стандартных электродных потенциалов, образуют так называемый ряд стандартных электродный потенциалов. Этот ряд важен для предсказания многих свойств металлов: вытеснения металлов из солей, взаимодействия с кислотами, электролиз растворов солей и т.д. Величина электродного потенциала металла зависит от природы металла, концентрации ионов электролита, температуры. Математически эта зависимость выражается уравнением Нернста: Е = Е0 + (RT/nF) ln C Здесь Е – потенциал металла при данной концентрации ионов, В; Е0 – стандартный электродный потенциал металла, В; R – универсальная газовая постоянная (8,316 Дж/град моль); Т – абсолютная температура, К; n – заряд иона металла; F – число Фарадея (96500 Кл/моль); С – концентрация (или активность) ионов металла в растворе, М. Устройство стандартного водородного электрода: платиновый электрод, покрытый мелкодисперсной платиной (платиновой чернью), погруженный в раствор серной кислоты с активностью ионов водорода 1 моль∙л–1, обдувается струей газообразного водорода под давлением 100 кПа; при этих условиях и при T = 298 K
| |||||||||||||||||||||||||||||||

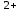
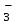
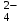
 , NO
, NO