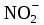Пермский национальный исследовательский политехнический университет
 Скачать 249.12 Kb. Скачать 249.12 Kb.
|
|
Следствие 2. Растворы замерзают при более низкой температуре, чем чистый растворитель, причем, чем выше концентрация растворенного вещества, тем ниже температура замерзания раствора. ΔТкрист = 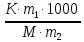 ΔТкрист = Т1 – Т2 ΔТкрист = Т1 – Т2m1 – масса растворенного вещества, г; m2 – масса растворителя, г; М – молярная масса растворенного вещества; К – криоскопическая постоянная; Т2 – температура замерзания раствора; Т1 – температура замерзания растворителя; *Криоскопические и эбулиоскопические константы (приложение 3). 2. Закон Вант-Гоффа: осмотическое давление возрастает с увеличением концентрации растворенного вещества. P = CмRT Р – осмотическое давление, Па; Cм – молярная концентрация, моль/л; Т – температура, К. R – универсальная газовая постоянная: R = 8,31 Дж/(моль·К); R = 0,083·105 Па·л/К·моль; R = 0,083л·атм/К·моль; Задачи: 211. При 250С давление насыщенного пара воды составляет 3,166 кПа. Найти при той же температуре давление насыщенного пара над 5% водным раствором хлорида натрия. 212. Рассчитать при какой температуре должен кристаллизоваться раствор, содержащий в 250 г воды 54 г глюкозы С6Н12О6 . 213. Раствор, содержащий 8г растворенного вещества в 100г диэтилового эфира кипит при 36,860С, тогда как чистый эфир кипит при 35,6 0С. Определить молекулярную массу растворенного вещества. 214. При 200С осмотическое давление раствора, в 100 мл которого содержится 6,33г вещества, равно 243,4кПа. Определить молекулярную формулу вещества, если в нем содержится 64,6%С, 5,2%Н, 8,8%N, 12,6%О, 8,8%Fe. 215. На сколько градусов повысится температура кипения, если в 100г воды растворить 9г глюкозы С6Н12О6? 216. Вычислить осмотическое давление раствора, содержащего 16г сахарозы С12Н22О11 в 350г воды при 293К. Плотность раствора считать равной единице. 217. К 100 мл 0,5М раствора сахарозы С12Н22О11 добавлено 300мл воды. Чему равно осмотическое давление полученного раствора при 250С. 218. При 250С осмотическое давление некоторого водного раствора равно 1,24 кПа. Вычислить осмотическое давление раствора при 00С. 219. При 250С осмотическое давление раствора, содержащего 2,8г высокомолекулярного соединения в 200мл раствора, равно 0,7 кПа. Найти молекулярную массу растворенного вещества. 220. Раствор, в 100мл которого находится 2,3 г вещества, обладает при 298К осмотическим давлением, равным 618,5 кПа. Определить молекулярную массу вещества. 221. Найти при 650С давление пара над раствором, содержащим 13,68г сахарозы С12Н22О11 в 90г воды, если давление насыщенного пара над водой при той же температуре равно 25 кПа. 222. Чему равно давление насыщенного пара над 10% раствором карбамида СО(NH2)2 при 1000С? 223. При 315К давление насыщенного пара над водой равно 8,2 кПа. На сколько понизится давление пара при указанной температуре, если в 540г воды растворить 36г глюкозы С6 Н12 О6? 224. При 293К давление насыщенного пара над водой равно 2,34 кПа. Сколько г глицерина С3Н5(ОН)3 надо растворить в 180г воды, чтобы понизить давление пара на 133,3 Па. 225. При какой приблизительно температуре будет кипеть 50% раствор сахарозы С12Н22 О11? 226. При какой приблизительно температуре будет кристаллизоваться 40% раствор этилового спирта С2 Н5ОН? 227. При растворении 5г вещества в 200г воды получается неэлектролит, кристаллизующийся при -1,450С. Определить молекулярную массу растворенного вещества. 228. При растворении 13г неэлектролита в 400г диэтилового эфира (С2Н5)2О температура кипения повысилась на 0,453К. Определить молекулярную массу растворенного вещества. 229.Температура кипения водного раствора сахарозы равна 101,40С. Вычислить молярную концентрацию и массовую долю сахарозы в растворе. 230. Вычислите массовую долю водного раствора сахара С12Н22О11, зная температуру кристаллизации раствора (–0,930С). 231. Вычислите массовую долю водного раствора глицерина С3Н5(ОН)3, зная, что этот раствор кипит при 100,390С. 232. Вычислите температуру кипения 5%-ного раствора нафталина С10Н8 в бензоле. Температура кипения бензола 80,20С. 233. Вычислите массовую долю водного раствора метанола СН3ОН, температура кристаллизации которого –2,790С. 234. В радиатор автомобиля налили 9 л воды и прибавили 2 л метилового спирта (ρ = 0,8 г/мл). При какой наинизшей температуре можно после этого оставлять автомобиль на открытом воздухе, не опасаясь, что вода в радиаторе замерзнет? 235. Водно-спиртовый раствор, содержащий 15% спирта (ρ = 0,97 г/мл), кристаллизуется при –10,260С. Найти молекулярную массу спирта и осмотическое давление раствора при 293 К. 236. Температура кипения водного раствора сахарозы С12Н22О11 равна 101,40С. Вычислить моляльную концентрацию и массовую долю сахарозы в растворе. При какой температуре замерзает этот раствор? 237. Водный раствор метанола имеет концентрацию растворенного вещества 4,85%. При какой температуре будет кристаллизоваться данный раствор? 238. Какой объем метилового спирта (ρ = 0,8 г/мл) нужно добавить к 9 л воды, чтобы полученный раствор не замерзал до –80С? 239. Определить температуру кристаллизации водно-спиртового раствора, плотность которого ρ = 0,97 г/мл, содержащего 15% спирта с относительной молекулярной массой 32. 240. Осмотическое давление раствора, содержащего 3 г сахара в 250мл раствора равно 0,82 атм. при 12 0С. Определить молекулярную массу сахара. 3. Электролитическая диссоциация Степень диссоциации (ионизации) – α, равна отношению концентрации вещества, распавшейся на ионы (С), к общей концентрации электролита (С0): α = 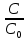 ·100% ·100%α выражают в % или долях единиц. сильные электролиты (α ≈ 1), слабые (α < 1) неэлектролиты (α ≈ 0). Константа диссоциации Кд характеризует диссоциацию слабых электролитов. Значение константы диссоциации зависит от природы электролита, природы растворителя, температуры и не зависит от концентрации раствора. Чем больше константа диссоциации кислоты (основания), тем сильнее кислота (основание). В общем виде для процесса электролитической диссоциации, выражаемого уравнением: KmAn ↔ mKn+ + nAm- константа диссоциации равна: 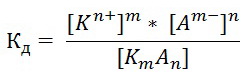 Закон разбавления Оствальда (связь α и Кд) α = 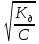 Ионное произведение воды. Водородный показатель Ионное произведение воды: [H+]·[OH_] = KH20 В чистой воде концентрации ионов водорода и гидроксид-ионов одинаковы и при 25 0С составляют 10-7 моль/л. Отсюда следует, что KH20=10-14. В нейтральном растворе [H+]=[OH-]=10-7 моль/л. В кислых растворах [H+]>[OH-], в щелочных [H+]<[OH-] Прологарифмировав [H+]·[OH_] = 10-14 , получим: –lg [H+] – lg [OH-] = 14 pH = –lg [H+] (водородный показатель); pOH = –lg [OH-] (гидроксильный показатель); pH + pOH =14 В нейтральных растворах рН = 7, в кислых рН<7, в щелочных рН>7 Задание: № 1. Напишите уравнения диссоциации и константы диссоциации для слабых электролитов. № 2. По заданным ионным уравнениям напишите соответствующие молекулярные уравнения. №3. Определите pH раствора заданной концентрации. При расчете pH раствора слабого электролита учитывайте первую стадию диссоциации. Значения констант диссоциации слабых электролитов приведены в справочных таблицах (приложение 5). Таблица 6.
5. Гидролиз солей Константа гидролиза и степень гидролиза Кг = 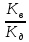 ß = ß = 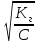 ß = ß =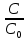 ß – степень гидролиза, (в % или долях ед.) С – концентрация соли, подвергшейся гидролизу, моль/л; С0 – концентрация раствора, моль/л Кг – константа гидролиза; Кв – константа воды, Кв=10-14 Кд – константа диссоциации слабого электролита, образовавшего данную соль, по последней стадии диссоциации. Задание: № 1. Написать уравнения гидролиза солей А и Б (по ступеням) в молекулярной и ионной формах, указать рН растворов (рН > 7 или рН < 7), тип гидролиза (по катиону, по аниону, по катиону и аниону). № 2. Вычислить степень гидролиза и рН раствора соли (Б) заданной концентрации, учитывая первую стадию гидролиза. Таблица 7.
№ 6. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ ПРОЦЕССЫ 1. Окислительно-восстановительные реакции Правила использования среды Таблица 8.
Изменение степени окисления окислителей в зависимости от среды Перманганатометрия Кислая среда (рН <7): МnО4- + 8Н+ + 5 е- → Мn2+ + 4Н2О Среда щелочная (рН > 7): МnО4- + е- → МnО42- Среда нейтральная (рН = 7): МnО42- + 2Н2О + 2е- → МnО2 + 4ОН-. Хроматометрия Cr2O72- + 14H+ +6e- → 2Cr3+ + 7H2O Йодометрия I2 + 2S2O32-→ 2I- + S4O62- Задание: Расставить коэффициенты электронно-ионным методом в окислительно-восстановительной реакции: Таблица 9.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

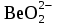 + 2H2O
+ 2H2O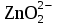 + 2H2O
+ 2H2O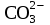 =
= 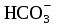
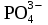 =
=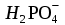
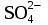 = CrOHSO4
= CrOHSO4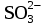 =
= 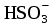
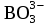 =
=
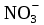 →
→