Пермский национальный исследовательский политехнический университет
 Скачать 249.12 Kb. Скачать 249.12 Kb.
|
|
3. Электрохимическая коррозия металлов Причина электрохимической коррозии состоит в том, что поверхность металла всегда является энергетически неоднородной из-за наличия примесей в металлах, различий по химическому и фазовому составу сплава. Это приводит к образованию на поверхности во влажной атмосфере микрогальванических элементов. На участках металла, имеющих более отрицательные значения потенциала, происходит процесс окисления этого металла: Me0 + ne = Men+ (анодный процесс). Окислители, принимающие электроны у катода, называются катодными деполяризаторами. Наиболее часто встречаются окислители (деполяризаторы): - ионы водорода (коррозия с водородной деполяризацией); уравнение восстановительного процесса: 2Н+ + 2ē = Н2 (в кислой среде), 2 H2O + 2ē = Н2 + 2OH– (в нейтральной и щелочной средах); - молекулы кислорода (коррозия с кислородной деполяризацией); уравнение восстановительного процесса: O2 + 4ē + 4Н+ = 2 H2O (в кислой среде); O2 + 4ē + 2 H2O = 4 OH– (в нейтральной и щелочной средах); На катодных участках поверхности происходит восстановление окислителей. Катодные процессы при коррозии Таблица 11.
Задание: Рассмотрите коррозию гальванопары. Укажите анод и катод соответствующей гальванопары. Рассчитайте ЭДС. Напишите уравнения анодного и катодного процессов, молекулярное уравнение реакции коррозии, укажите направление перемещения электронов в системе. Окислительно-восстановительные потенциалы водорода, кислорода и металлов в разных средах (приложение 7). Таблица 12.
4. Электролиз водных растворов солей 1. Процессы на катоде Процесс на катоде зависит от активности катионов металлов, от характера среды, в которой происходит электролитический процесс. При электролизе водных растворов все металлы можно разделить на три группы: 1. Металлы, стоящие в ряду напряжений от Li по Al, не восстанавливаются на катоде из водных растворов солей. Катионы этих металлов обладают очень низкой окислительной способностью. На катоде идет процесс восстановления воды и образования основания у катодного пространства. 2. Металлы, находящиеся в ряду стандартных электродных потенциалов между Mn и H, восстанавливаются на катоде одновременно с выделением водорода. 3. Металлы, стоящие в ряду стандартных потенциалов за водородом (медь, серебро, золото и др.), восстанавливаются на катоде без сопровождения выделения водорода. Катионы этих металлов обладают более высокой окислительной способностью, чем ионы водорода. Таблица 13.
Процесс на катоде рассчитывается математически: Равновесный потенциал металла рассчитывается по уравнению Нернста: φравн Mеn+/Me = φ0Mеn+/Me + 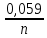 ·lg CMen+ ·lg CMen+Реальный потенциал металла: φi Mеn+/Me ≈ φравн Mеn+/Me 2. Равновесный потенциал восстановления водорода зависит от рН среды и парциального давления водорода (РН2). φравн2Н+/Н2 = – 0,059 · рН – 0,0295· lg РН2 РН2= 5·10-7 атм Реальный потенциал разряда водорода на катоде φi2Н+/Н2 = φравн2Н+/Н2 – 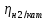 3. Процесс восстановления на катоде зависит от реальных потенциалов металла и водорода: а) если φi2Н+/Н2 > φi Mеn+/Me , то на К(-): 2Н2О + 2е = Н2 + 2ОН- Men+ +n ОН- = Me(OH)n б) если φi2Н+/Н2 < φi Mеn+/Me , то на К(-): Men+ +ne = Me0 в) если φi2Н+/Н2 ≈ φi Mеn+/Me, то на К(-): 2Н2О + 2е = Н2 + 2ОН- Men+ +ne = Me0 2. Процессы на аноде Процесс окисления на аноде зависит от материала анода. Процесс на инертном (нерастворимом) аноде (угольном, графитовом, золотом, платиновом). На аноде в первую очередь окисляются анионы с меньшим потенциалом. Таблица 14.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
