Пермский национальный исследовательский политехнический университет
 Скачать 249.12 Kb. Скачать 249.12 Kb.
|
|
Министерство образования и науки Российской Федерации Федеральное государственное бюджетное образовательное учреждение в Пермский национальный исследовательский политехнический университет Чайковский филиал КОНТРОЛЬНЫЕ ЗАДАНИЯ ПО ДИСЦИПЛИНЕ «ХИМИЯ» для студентов заочной формы обучения Квалификация (степень) выпускника – бакалавр Направление – 270800 Строительство Профиль подготовки – Промышленное и гражданское строительство Направление – 220700.62 Автоматизация технологических производств Профиль подготовки – автоматизация технологических процессов и производств Направление – 280700 Техносферная безопасность Профиль подготовки – Безопасность технологических процессов и производств Направление – 140400.62 Электроэнергетика и электротехника Профиль подготовки – Электроснабжение Направление – 080100.62 «Экономика» Профиль подготовки – Экономика и управление на предприятии в отраслях машиностроения. Чайковский 2014 Составитель: Жернакова Л.Г. Контрольные задания по дисциплине «Химия» для студентов заочной формы обучения/сост. Жернакова Л.Г.: Пермский национальный исследовательский политехнический университет Чайковский филиал. Чайковский, 2014г. Учебное пособие «Контрольные задания по дисциплине Химия» разработано в соответствии с требованиями федерального государственного образовательного стандарта высшего профессионального образования и основной образовательной программы ВПО подготовки бакалавров по направлениям: 270800 «Строительство». Профиль подготовки – Промышленное и гражданское строительство. Направление – 220700.62 Автоматизация технологических процессов и производств Профиль подготовки - автоматизация технологических процессов и производств 280700 «Техносферная безопасность». Профиль подготовки – Безопасность технологических процессов и производств. 140400.62 «Электроэнергетика и электротехника». Профиль подготовки – Электроснабжение. 080100.62 «Экономика». Профиль подготовки – Экономика и управление на предприятии в отраслях машиностроения. В учебном пособии по дисциплине «Химия» изложены задания по вариантам для выполнения контрольной работы, приведены расчетные формулы, справочные данные. Пособие рекомендуется использовать при выполнении контрольной работы по дисциплине «Химия». ОБЩИЕ МЕТОДИЧЕСКИЕ УКАЗАНИЯ Химия является не только общетехнической, но и общеобразовательной наукой. Поэтому инженер любой специальности должен обладать достаточными знаниями в области химии. В процессе изучения курса химии студент должен выполнить контрольную работу. Решение задач и ответы на теоретические вопросы должны быть описаны формализованным языком химии, за исключением тех случаев, когда необходимо сделать выводы, пояснения по ходу решения. Решение задач нужно оформлять в виде алгоритмов. Контрольная работа должна быть аккуратно оформлена. Каждое новое задание писать на новом листе, оставляя место для рецензии преподавателя. Контрольная работа выполняется в тетради. Номера и условия задач следует переписывать в том порядке, в котором они указаны в задании. Графики должны быть выполнены на миллиметровой бумаге. Если контрольная работа не зачтена, нужно сделать работу над ошибками в конце тетради, а не в рецензированном тексте, и предоставить на повторное рецензирование вместе с незачтенной работой. Вариант контрольной работы согласуется с преподавателем. Контрольная работа, выполненная не по своему варианту, преподавателем не рецензируется и не зачитывается. ПРОГРАММА ДИСЦИПЛИНЫ ХИМИЯ Дисциплина Химия относится к базовой части цикла математических и естественнонаучных дисциплин и является обязательной при освоении ООП по направлениям подготовки. Цель учебной дисциплины – развитие и углубление знаний по химическим законам и теориям как составной части подготовки студентов по фундаментальным наукам; формирование у студентов целостного естественнонаучного мировоззрения; формирование осознанной необходимости химических знаний при решении профессиональных и экологических задач в условиях обострения отношений человек – окружающая среда. Настоящий курс дисциплины «Химия» состоит из следующих модулей, разделов, тем: Модуль 1. Теоретические основы химии Раздел 1. Периодический закон в свете строения атома Введение. Тема 1. Строение электронной оболочки атома. Квантовые числа. Возбужденное состояние атомов и ионов. Химическая связь. Тема 2. Периодический закон. Изменение свойств элементов и их соединений в периодах и группах периодической системы Д.И.Менделеева.16 Раздел 2. Элементы химической термодинамики и кинетики Тема 3. Основы химической термодинамики. Тепловые эффекты химических реакций. Внутренняя энергия и энтальпия. Термохимия. Термохимические законы и уравнения. Энтальпия образования химических соединений. Энтропия, энергия Гиббса и их изменение в химических процессах. Направление протекания химических реакций. Метод Улиха. Тема 4. Кинетика и химическое равновесие. Скорость химических реакций. Закон действия масс. Константа скорости реакции. Химическое равновесие. Константа равновесия и ее связь с термодинамическими функциями. Принцип Ле-Шателье. Химическое равновесие в гетерогенных системах. Зависимость скорости химических реакций от температуры. Правило Вант-Гоффа. Энергия активации. Уравнение Аррениуса. Катализаторы. Раздел 3. Растворы Тема 5. Растворы электролитов. Классификация растворов. Дисперсные системы. Диссоциация сильных и слабых электролитов. Степень диссоциации, константа диссоциации. Закон разбавления Оствальда. Факторы, влияющие на процесс диссоциации. Электролитическая диссоциация воды. Водородный показатель среды. Тема 6. Концентрация растворов. Растворимость. Способы выражения концентрации растворов. Определение концентрации. Раздел 4. Окислительно-восстановительные процессы Тема 7. Гальванический элемент. Электродные потенциалы металлов. Электродвижущая сила гальванического элемента и ее измерение. Стандартный водородный электрод и водородная шкала потенциалов. Уравнение Нернста. Тема 8. Электролиз. Химическая и концентрационная поляризация. Перенапряжение водорода. Катодные и анодные процессы при электролизе. Окислительно-восстановительные реакции. Модуль 2. Химические процессы и материалы Раздел 5. Металлические материалы Тема 9. Металлы. Кристаллическое строение металлов. Получение и химические свойства металлов. Взаимодействие металлов с кислотами. Электронный баланс. 17 Тема 10. Коррозия металлов. Химическая и электрохимическая коррозия. Кислородная и водородная деполяризация. Термодинамика коррозионных процессов. Раздел 6. Неметаллические материалы Тема 11. Неорганические материалы. Материалы и покрытия на основе оксидов. Керамика. Керметы. Силикатные материалы. Химические свойства силикатов. Стекло. Ситаллы. Тема 12. Полимеры. Полимеры и олигомеры. Структура макромолекул: линейные, разветвленные, сетчатые. Получение полимеров: полимеризация и поликонденсация. Пластмассы. Варианты контрольных заданий Таблица 1
№ 1 СТРОЕНИЕ АТОМА Задание: 1. Составить электронную формулу атома А с учетом минимума энергии и графическую формулу для валентных электронов. Показать распределение электронов по энергетическим уровням. Определить число протонов, электронов, нейтронов. Определить устойчивое/неустойчивое/состояние атома и возможный провал электронов. Составить электронную формулу с учетом провала электронов (если есть). 2. Определить возможные ковалентные состояния атома Б и ковалентность ионов, образуемых данным атомом. Напишите электронные формулы для ионов. Для валентных электронов атома Б укажите набор всех четырех квантовых чисел. Таблица 2.
№ 2. ХИМИЧЕСКАЯ СВЯЗЬ. СТРОЕНИЕ МОЛЕКУЛ Задание: 1. Определите тип гибридизации центрального атома, валентный угол и изобразите электронную и пространственную конфигурацию молекулы. 2. Определите вид химической связи и полярность/неполярность/ молекулы в целом. Используйте справочные данные по электроотрицательности элементов (приложение 1). Таблица 3.
№ 3. ТЕРМОДИНАМИКА ХИМИЧЕСКИХ ПРОЦЕССОВ Критерием возможности самопроизвольного протекания реакции в данных условиях является изменение энергии Гиббса (ΔG): ΔG = ΔH – TΔS, где T – абсолютная температура, К ; ΔH – энтальпийный фактор, кДж/моль; TΔS – энтропийный фактор, Дж/моль·К. Если ΔG < 0, то прямая реакция может протекать самопроизвольно. Если ΔG > 0, то самопроизвольно может протекать обратная реакция. Для расчета ΔН0, ΔG0, S0 химических реакций применяют закон Гесса или его следствия. Если нужно рассчитать энергию Гиббса для температуры, отличной от стандартной, то используют уравнение Улиха: ΔG0т = ΔН0т – TS0т , где ΔН0 и S0 – величины, зависящие от температуры. Температура химического равновесия:  Энергия Гиббса: ΔG0т = – RT ln Kт где R – универсальная газовая постоянная, 8,31·10-3 кДж/моль·К 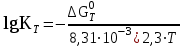 . .При выполнении задания используйте справочные данные стандартных величин (приложение 2). |
