Пермский национальный исследовательский политехнический университет
 Скачать 249.12 Kb. Скачать 249.12 Kb.
|
|
153. Для реакции COCl2↔CO + Cl2. Вычислить константу равновесия и начальную концентрацию COCl2, если [COCl2]=4,65·10-5моль/л; [CO]=[Cl2]= 0,001моль/л. 154. Для реакции 4NO+6H2O↔4NH3+5O2 вычислить начальные концентрации и равновесную концентрацию [NH3], если [NO]=2,44моль/л; [H2O]=1,58моль/л; [O2]=0,65 моль/л. 155. Для реакции 2NO2↔2NO+O2 вычислить константу равновесия и С0(NO2) если [NO2]=0,02моль/л; [NO]=0,08моль/л; [O2]=0,16 моль/л. 156. Для реакции 4NH3 +3O2↔2N2 + 6H2O. Вычислить константу равновесия; равновесную концентрацию [N2] и начальные концентрации реагентов, если [NH3]=2,44 моль/л; [O2]=0,59 моль/л; [H2O]=8,22 моль/л. 157. Для реакции 4NO+6H2O↔4NH3+5O2 Вычислить начальные концентрации реагентов и равновесную концентрацию [NH3], если [NO]=3,86 моль/л; [H2O]=2,47моль/л; [O2]=1,35 моль/л. 158. Для реакции CO2+Н2↔CO+H2O вычислить константу равновесия и начальные концентрации исходных веществ, если [CO2]=0,02моль/л; [H2]=0,005моль/л; [CO]=0,015моль/л; [H2O]=0,015моль/л. 159. Для реакции SO3+CO↔SO2+CO2 рассчитать равновесные концентрации веществ, если Кр =1,89; С0(CO)=0,95моль/л. 160. Для реакции N2 + 3H2↔2NH3. Вычислить Кр и исходные концентрации реагентов, если [NH3]=0,4моль/л; [N2] =0,03моль/л; [Н2] =0,1моль/л. 161. Для реакции 2NF3+3H2↔6HF+N2 вычислить [HF] и первоначальные концентрации реагентов, если [NF3]=0,86моль/л; [Н2] =0,43моль/л; [N2] =1,24моль/л. 162. Для реакции H2+ SO3↔H2O+SO2. Рассчитать равновесные концентрации веществ, если Кр=1,36; С0(H2)=С0(SO3)=0,65моль/л. 163. Для реакции 4NH3 +3O2↔2N2 + 6H2O. Вычислить константу равновесия; равновесную концентрацию [N2] и начальные концентрации реагентов, если [NH3]=1,63моль/л; [O2]=2,15моль/л; [H2O]=7,44моль/л. 164. Для реакции 2NO+Cl2↔2NOCl вычислить константу равновесия, если С0(NO)=0,5моль/л; С0(Cl2)=0,2моль/л; а к моменту равновесия прореагировало 20% NO. 165. Для реакции 2NF3+3H2↔6HF+N2 вычислить [HF] и первоначальные концентрации реагентов, если [NF3]=1,15моль/л; [Н2] =0,72моль/л; [N2] =0,97моль/л. 166. Для реакции CO+Н2О↔ CO2+H2 вычислить равновесные концентрации веществ, если Кр=2,25; С0(CO)=С0(Н2О)=0,75моль/л. 167. Для реакции  вычислить вычислить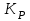 и и 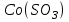 , если , если 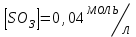 ; ; 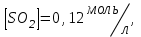 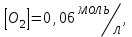 168. Для реакции 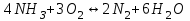 . Определить . Определить 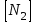 и начальные концентрации реагентов, если и начальные концентрации реагентов, если 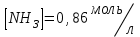 ; ;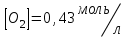 ; ;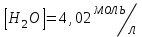 169. Для реакции 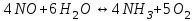 вычислить вычислить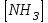 и начальные концентрации реагентов, если и начальные концентрации реагентов, если   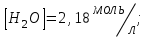 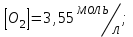 170. Для реакции 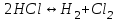 рассчитать равновесные концентрации веществ, если рассчитать равновесные концентрации веществ, если 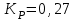 , , 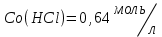 . . 171. Для реакции 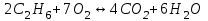 вычислить вычислить 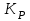 , если , если 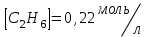 ; ;  ; ; 172. Для реакции 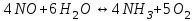 вычислить вычислить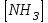 и начальные концентрации реагентов, если и начальные концентрации реагентов, если 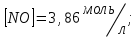  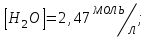  173. Для реакции 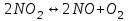 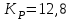 , , 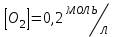 . Определить . Определить  174. Для реакции 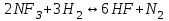 . вычислить . вычислить 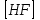 и начальные концентрации реагентов, если и начальные концентрации реагентов, если  ; ; 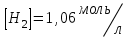 ; ;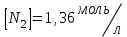 175. Для реакции 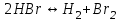 вычислить равновесные концентрации веществ, если вычислить равновесные концентрации веществ, если 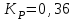 ; ; 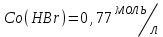 176. Для реакции 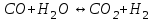 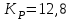 , , 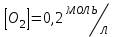 . Определить . Определить 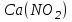 177. Рассчитать равновесные концентрации веществ для реакции 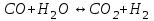 , если , если  ; ;  ; ;  178. Для реакции  вычислить вычислить  и исходные концентрации веществ, если: и исходные концентрации веществ, если: 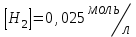 ; ; 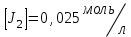 ; ; 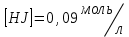 179. Рассчитайте равновесную концентрацию водорода в реакции 2НJ(г) = H2(г)+J2(г), если исходная концентрация НJсоставляет 0,55 моль/л, а константа равновесия равна 0,12. 180. Равновесие гомогенной системы 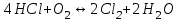 установилось при следующих концентрациях реагирующих веществ: [HCl] = 0,2 моль/л; [ O2] = 0,32 моль/л; [ Cl2] = 0,14 моль/л; [ Н2О] = 0,14 моль/л. Вычислите исходные концентрации кислорода и хлороводорода. установилось при следующих концентрациях реагирующих веществ: [HCl] = 0,2 моль/л; [ O2] = 0,32 моль/л; [ Cl2] = 0,14 моль/л; [ Н2О] = 0,14 моль/л. Вычислите исходные концентрации кислорода и хлороводорода. № 5. РАСТВОРЫ 1. Способы выражения концентрации растворов 1. Массовая доля (ω) показывает, сколько граммов растворенного вещества содержится в каждых 100г раствора. 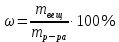 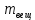 – масса растворенного вещества, г – масса растворенного вещества, г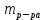 – масса раствора, г – масса раствора, г2. Молярная концентрация или молярность (СМ или М) показывает, сколько моль растворенного вещества содержится в 1л раствора. 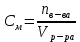 (моль/л); (моль/л);nв-ва – количество растворенного вещества, моль; Vр-ра – объем раствора, л 3. Моляльная концентрация или моляльность (В) показывает, число моль растворенного вещества в 1 кг растворителя. В = 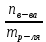 (моль/кг); (моль/кг);4. Молярная концентрация эквивалента или нормальность (Сн) показывает, сколько моль эквивалентов растворенного вещества содержится в 1л раствора, (моль/л). Сн = 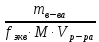 где fэкв– фактор эквивалентности; 5. Титр показывает, сколько граммов вещества содержится в 1 мл раствора. Т= 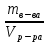 (г/мл) (г/мл)Задачи: 181. Вычислить W, См, Сн раствора сульфата натрия, приготовленного растворением 240г глауберовой соли Na2SO4·10H2O в 760мл воды. Плотность полученного раствора 1,102г/мл. 182. Вычислить титр, молярную концентрацию и молярную концентрацию эквивалента 10%-ного раствора сернистой кислоты, p=1,056 г/мл. 183. Сколько граммов Al2(SO4)3·18H2O и воды нужно взять, чтобы приготовить 1 литр 10%-ного раствора в расчете на безводную соль (плотность раствора 1,1 г/мл)? Определить молярную концентрацию эквивалента, молярную концентрацию и титр этого раствора. 184. Определите молярную концентрацию, молярную концентрацию эквивалента и титр 40%-ного раствора серной кислоты, плотность которого 1,166 г/мл. 185. В 300г раствора содержится 36г КОН (плотность раствора 1,1 г/мл). Вычислите массовую долю, молярную концентрацию, моляльность и титр данного раствора. 186. Сколько граммов кристаллической соды Na2СO3·10H2O надо взять для приготовления 2л 0,2 М раствора Na2СO3 (плотность раствора 1,12 г/мл)? Какова массовая доля, титр и молярная концентрация эквивалента раствора Na2СO3? 187. Какое количество медного купороса CuSO4·5H2O нужно добавить к 150мл воды, чтобы получить 5%-ный раствор в расчете на безводную соль? Вычислить молярную концентрацию и титр полученного раствора, если плотность раствора 1,05 г/мл. 188. 25г медного купороса CuSO4·5H2O растворили в 175г воды. Определите массовую долю, молярную концентрацию и молярную концентрацию эквивалента, если плотность раствора 1,12 г/мл. 189. В 500мл 10% раствора уксусной кислоты, плотность которого 1,03 г/мл, растворили 120г уксусной кислоты. Определите массовую долю, молярную концентрацию эквивалента и титр полученного раствора, если его плотность 1,08г/мл. 190. Вычислите молярную концентрацию, молярную концентрацию эквивалента и титр 38%-ного раствора соляной кислоты, плотность которого 1,194 г/мл. 191. Вычислите массовую долю, молярную концентрацию эквивалента и титр раствора сульфата натрия, приготовленного растворением 120г глауберовой соли Na2SO4·10H2O в 360мл воды (плотность раствора 1,032г/мл). 192. Определите молярную концентрацию, молярную концентрацию эквивалента и титр 16%-ного раствора сульфата меди (П), плотность которого 1,18 г/мл. 193. Сколько граммов железного купороса (FeSO4·7H2O) нужно для приготовления 500мл 2,5М раствора? Какова массовая доля полученного раствора и его титр? Плотность раствора 1,034г/мл. 194. Сколько миллилитров 30%-ного раствора КОН плотностью 1,29 г/мл, нужно взять, чтобы приготовить 3л 0,5М раствора? 195. Вычислить См, Сн и титр 2л 12%-ного раствора CuSO4, плотность которого 1,122 г/мл? Сколько граммов CuSO4·5H2O можно получить из данного раствора? 196. Вычислить массовую долю, молярную концентрацию и молярную концентрацию эквивалента раствора сульфата калия, в 20мл которого содержится 1,74г растворенного вещества. Плотность раствора 1, 12 г/мл. 197. Вычислить массовую долю и титр децинормального раствора нитрата никеля (II), плотность которого 1,14 г/мл. 198. Вычислите массовую долю, моляльность и титр 1,4 М раствора нитрата серебра, плотность которого 1,18 г/мл. 199. Какое количество медного купороса CuSO4·5H2O нужно добавить к 200мл воды, чтобы получить 5%-ный раствор в расчете на безводную соль? Вычислить См и Сн полученного раствора. Плотность раствора 1г/мл. 200. Сколько миллилитров 36%-ного раствора соляной кислоты, плотность которого 1,19 г/мл, необходимо взять для приготовления 4л 0,5 М раствора? 201. Сколько миллилитров 96%-ной серной кислоты (пл. 1,84 г/мл) нужно взять для приготовления 300мл 0,5н раствора? 202. Определите молярную концентрацию эквивалента и титр 20%-ного раствора ортофосфорной кислоты, плотность которого 1,09 г/мл. 203. Сколько граммов железного купороса (FeSO4·7H2O) нужно для приготовления 500мл 2,5н раствора? Какова молярная концентрация полученного раствора? 204. Вычислите молярную концентрацию и молярную концентрацию эквивалента 20%-ного раствора хлорида цинка, плотность которого 1,18 г/мл. 205. Сколько миллилитров 28%-ного раствора сернистой кислоты (пл. 1,142 г/мл) нужно взять для приготовления 300мл 0,15М раствора? 206. Какую массу воды следует прибавить к раствору КОН массой 150 г и массовой долей 10%, чтобы получить раствор с массовой долей КОН 2% и плотностью 1,02 г/мл? Рассчитайте См и Сн полученного после разбавления раствора. 207. Смешали 100 мл 20% раствора серной кислоты плотностью 1,054г/мл и 200мл 40% раствора этого же вещества плотностью 1,184г/мл. Рассчитайте W(%), См и Сн полученного раствора. 208. Сколько воды надо прибавить к 0,2л 60% раствора гидроксида кальция плотностью 1,411г/мл, чтобы получить 15% раствор плотностью 1,16г/мл. Рассчитайте Т, См и Сн полученного раствора. 209. Какую массу раствора хлорида кальция с массовой долей 20% надо прибавить к воде массой 500г для получения раствора с массовой долей соли 5% и плотностью 1,02г/мл. Рассчитайте Т, См и Сн полученного раствора. 210. Необходимо разбавить 400 г 95% серной кислоты водой, чтобы получить 20% раствор. Сколько для этого потребуется воды. Сколько мл разбавленной кислоты получится, если плотность полученного раствора 1,84г/мл. Рассчитайте См и Сн полученного раствора. Примечание* W – массовая доля растворенного вещества (%); См – молярная концентрация раствора (моль/л); Сн – молярная концентрация эквивалента раствора (моль/л); Т – титр раствора (г/мл). В – моляльность раствора (моль/кг) 2. Свойства разбавленных растворов неэлектролитов 1. Закон Рауля: давление насыщенного пара растворителя над раствором (Р, Па) всегда меньше, чем над чистым растворителем (Р0 , Па). Р = Р0 · Х0 Х = 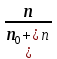 Х0 = Х0 = 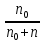 Р – парциальное давление насыщенного пара растворителя над раствором; Р0 – давление насыщенного пара над чистым растворителем; Х0 – мольная доля растворителя в растворе; Х – мольная доля растворенного вещества; n0 – количество растворителя; n – количество растворенного вещества. Следствие 1. Температура кипения раствора выше температуры кипения чистого растворителя. Для разбавленных растворов повышение температуры кипения раствора пропорционально концентрации раствора: ΔТкип = 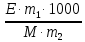 ΔТкип = Т2 – Т1 ΔТкип = Т2 – Т1m1 – масса растворенного вещества, г; m2 – масса растворителя, г; М – молярная масса растворенного вещества; Е – эбуллиоскопическая постоянная; Т2 – температура кипения раствора; Т1 – температура кипения растворителя; |
