Автореферат Гапон М.Н.. Показатели антиоксидантной защиты организма при экспериментальном дисбактериозе кишечника, обусловленном применением антибиотика широкого спектра действия 03. 00. 04 биохимия 03. 00. 07 микробиология
 Скачать 154 Kb. Скачать 154 Kb.
|
|
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ Изучение характера полостной микрофлоры кишечника экспериментальных животных, получавших гентамицин, позволило установить, что его применение приводит к существенным изменениям в составе кишечного микробиоценоза. При этом изменяется количество и частота обнаружения представителей как облигатной, так и транзиторной микрофлоры. Несмотря на то, что бифидо- и лактобактерии обнаруживаются в составе микрофлоры кишечника у всех экспериментальных животных (частота распространения – 100%), их количество умеренно снижается - бифидобактерий до lg 7,5+0,3 против lg 8,5+0,5 в контроле, лактобактерий - lg 6,8+0,1 против lg 7,2+0,6 в контроле. Более существенные изменения отмечены в популяции эшерихий. Одновременно с уменьшением общего количества эшерихий отмечается уменьшение частоты обнаружения эшерихий с нормальной ферментативной активностью (до 50,0+6,1 %), увеличение содержания эшерихий со сниженной ферментативной активностью (lg 7,2+0,2 против lg 3,0+0,5 у интактных животных). Среди транзиторной микрофлоры так же происходят выраженные изменения: увеличивается частота обнаружения (с 80,0+2,6 % до 100 %) и количество лактозонегативных энтеробактерий (lg 4,9+0,1 против lg 3,3+0,1), бактерий рода Proteus (частота находок с 40,0+7,7 % до 90,0+1,3 %; количество lg 4,1+0,5 против 0,8+0,2 в контроле), грибов рода Candida (частота обнаружения до 50,0+6,1 %; количество - lg 3,3+0,2 против lg 1,4+0,1 в контроле). Значительно изменяется состав кокковой флоры: возрастает численность коагулазоотрицательных стафилококков (до lg 4,7+0,3 против lg 3,5+0,5), увеличивается частота обнаружения и количество золотистых стафилококков (80,0+2,6 % против 0; lg 4,3+0,1 против 0). Исследование изменений состава кишечной микрофлоры животных в динамике экспериментального дисбактериоза показало, что нарушения в микробиоценозе регистрируются уже на третьи сутки после окончания введения антибиотического препарата, нарастают к десятым-семнадцатым суткам наблюдения и по ряду показателей не достигают значений контрольной группы к тридцатым суткам исследования. Так, уже на третьи сутки наблюдения отмечается умеренное снижение количества бифидо-и лактобактерий, эшерихий с нормальной ферментативной активностью, увеличение содержания эшерихий со сниженной ферментативной активностью, лактозонегативных энтеробактерий, коагулазоотрицательных и золотистых стафилококков, бактерий рода Proteus. К десятому дню после отмены антибиотического препарата эти изменения приобретают более выраженный характер: количество бифидо- и лактобактерий становится на порядок ниже, по сравнению с группой интактных животных, значительно уменьшается содержание эшерихий с нормальной ферментативной активностью, максимально высоких значений достигает количество лактозонегативных энтеробактерий, увеличивается содержание в составе микрофлоры кишечника популяции дрожжеподобных грибов рода Candida. Эти изменения сохраняются и на семнадцатые сутки наблюдения, обнаруживая некоторую тенденцию к повышению содержания нормальных эубионтов. Несколько иная зависимость выявляется среди представителей транзиторной условно-патогенной микрофлоры: если количество лактозонегативных энтеробактерий в составе кишечного биоценоза уменьшается (с lg 5,8+0,4 - на десятый день наблюдения до lg 4,0+0,7 - на семнадцатый день), то количество золотистых стафилококков продолжает возрастать (до lg 5,3+0,4 против нулевых значений в контроле). В дальнейшие сроки наблюдения (двадцать четвертый и тридцатый дни после отмены антибиотика) тенденция увеличения содержания в составе микрофлоры кишечника количества нормальных эубионтов стойко сохраняется. Однако если содержание лактобактерий к концу срока наблюдения достигает показателей контрольных животных, то количество бифидобактерий в кишечной микрофлоре животных, получавших антибиотик, остается еще несколько сниженным (lg 7,7+0,3 против lg 8,5+0,5 в контроле). В составе кишечной микрофлоры экспериментальных животных регистрируется высокая численность золотистых стафилококков (lg 4,1+0,2), протеев (lg 3,1+0,1), грибов рода Candida (lg 4,0+0,2). Так как состояние мукозной микрофлоры кишечника в большей степени отражает особенности местных условий среды кишечного биотопа (Несвижский Ю.В., 2003), было проведено исследование состава мукозной микрофлоры в динамике экспериментального дисбактериоза. Сопоставление количественного состава мукозной и полостной микрофлоры не выявило различий в спектре выделяемых микроорганизмов. В составе как полостной, так и мукозной микрофлоры интактных животных присутствовали бифидо- и лактобактерии, эшерихии с нормальной и сниженной ферментативной активностью, энтерококки, коагулазоотрицательные стафилококки. Однако бифидобактерии в составе мукозной флоры определялись в большем, чем в полостной флоре, количестве (lg 9,2+0,6 против lg 8,5+0,5). В несколько меньшем количестве, чем в полостной микрофлоре, в составе мукозной содержались лактобактерии (lg 6,0+0,3 против lg 7,2+0,6), эшерихии с нормальной ферментативной активностью (lg 4,2+0,3 против lg 6,4+0,3), эшерихии со сниженной ферментативной активностью (lg 2,0+0,1 против lg 3,0+0,5) и лактозонегативные энтеробактерии (lg 2,3+0,1 против lg 3,3+0,1). Гемолитические эшерихии, протеи, золотистые стафилококки и грибы рода Candida в составе мукозной микрофлоры интактных животных отсутствовали. При развитии экспериментального дисбактериоза изменения состава мукозной микрофлоры в целом соответствовали изменениям, отмечаемым в полостной микрофлоре кишечника. Однако снижение содержания бифидобактерий было отмечено в более выраженной степени (lg 5,6+0,3 против lg 9,2+0,6 у интактных животных). В составе мукозной микрофлоры так же, как в составе полостной, уменьшилась численность эшерихий с нормальной ферментативной активностью, статистически достоверно выросло количество и частота обнаружения эшерихий со сниженной ферментативной активностью, лактозонегативных энтеробактерий, протеев, грибов рода Candida, золотистых стафилококков. До настоящего времени конкретные механизмы дисбаланса кишечной микрофлоры под влиянием различных по своей природе факторов риска остаются до конца не выясненными. Типичной реакцией целостного организма на различные воздействия является стрессовый адаптационный синдром, при котором формируются изменения кишечного микробиоценоза. Дополнительным фактором, способствующим изменению количества облигатной микрофлоры, является продукция токсических метаболитов кислорода как следствие активации гексозомонофосфатного шунта (Дубинин А.В., Бабин В.Н., Раевский П.М., 1991; Ардатская М.Д., Минушкин О.Н., Прихно Н.И., Дубинин А.В., 2000; Захарченко М.П., Гриневич В.Б., Добрынин В.М., 2003; Захарченко М.П., Добрынин В.М., Захарченко М.М. с соавт., 2004; Ahmad M.S., Krishnan S., Ramakrishna B.S. et al., 2000). В связи с этим целесообразным является изучение ключевой стресслимитирующей, гомеостатической системы макроорганизма - антиоксидантной системы в динамике дисбактериоза, обусловленного применением антибиотика широкого спектра действия. Поэтому следующим этапом исследования явилось изучение состояния антиоксидантной защиты эритроцитов и колоноцитов в динамике экспериментального дисбактериоза. 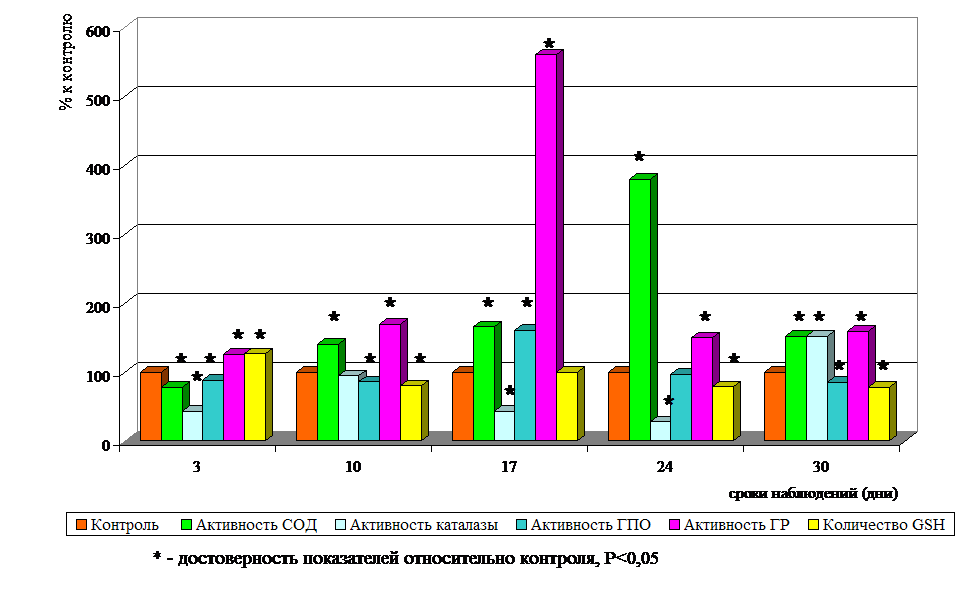 Рис. 1. Активность СОД, каталазы, ГПО, ГР и количество GSH в эритроцитах животных с экспериментальным дисбактериозом. Анализ результатов исследования показал, что в процессе развития экспериментального дисбактериоза происходят существенные изменения активности ферментов антиоксидантной защиты макроорганизма (Рис.1). Уже к третьему дню наблюдения отмечается снижение активности СОД в эритроцитах крови на 22,1 %, по сравнению с животными контрольной группы. Начиная с десятого дня исследования активность СОД, постепенно увеличивается, достигая своих максимальных значений к двадцать четвертому дню. Несколько по иному изменяется активность каталазы. Достоверное снижение ее активности прослеживается на третьи и семнадцатые сутки наблюдения, достигая своих минимальных значений к двадцать четвертому дню исследования. Значительное снижение активности каталазы при высокой активности СОД свидетельствует о резком дисбалансе в функционировании сопряженных ферментов, который может указывать на накопление перекиси водорода в эритроцитах, что, в свою очередь, может способствовать активации процессов перекисного окисления липидов. В динамике дисбактериоза происходят изменения и в состоянии глутатионового блока антиоксидантной системы эритроцитов. Если на третьи сутки наблюдается достоверное снижение активности ГПО (на 11,7 %) и выраженное повышение активности ГР (на 25,9 %), то к десятым суткам метаболическая картина изменяется: резко увеличивается активность ГР (на 69,6 %) и снижается содержание восстановленного глутатиона (на 19,5 %) относительно контрольных величин, что может указывать на интенсивное использование его восстановленных эквивалентов. Максимальное повышение активности ГПО и ГР к семнадцатым суткам при количестве восстановленного глутатиона, соответствующем контрольным значениям, свидетельствует о напряженности глутатионзависимого блока и активации защитных механизмов, направленных на устранение токсических продуктов. Эти данные также могут указывать на ведущую роль глутатионового звена в антиоксидантной защите эритроцитов при развитии экспериментального дисбактериоза. Многие исследователи полагают, что симбионтная микрофлора кишечника оказывает трофическое обеспечение слизистой оболочки кишечника и, в частности, ее эпителиального слоя (Шендеров Б.А., 1998; Осипов Г.А. с соавт., 2001). Однако последствия разрушения этой экологической системы для организма в целом изучены недостаточно. Функциональная целостность макроорганизма (как симбиотической системы) определяется наличием интегративных регуляторных и трофических связей между организмом хозяина и его микрофлорой. Именно колоноциты во многом, по-видимому, определяют «полноценность» этих связей и являются отражением развития дисбиоза кишечника, поэтому представилось необходимым исследовать состояние антиоксидантной защиты колоноцитов. Результаты исследования показали, что нарушения АОЗ эпителиоидных клеток толстого кишечника при развитии дисбактериоза выражены сильнее, чем в эритроцитах, а изменения активности антиоксидантных ферментов колоноцитов носят несколько иной характер (Рис.2). Во все сроки исследования в колоноцитах отмечается достоверное снижение активности СОД относительно контрольных величин на фоне практически нормальных значений активности каталазы. Лишь на 17-24 сутки происходит выраженное снижение активности обоих ферментов, что может свидетельствовать об интенсификации свободнорадикальных процессов. 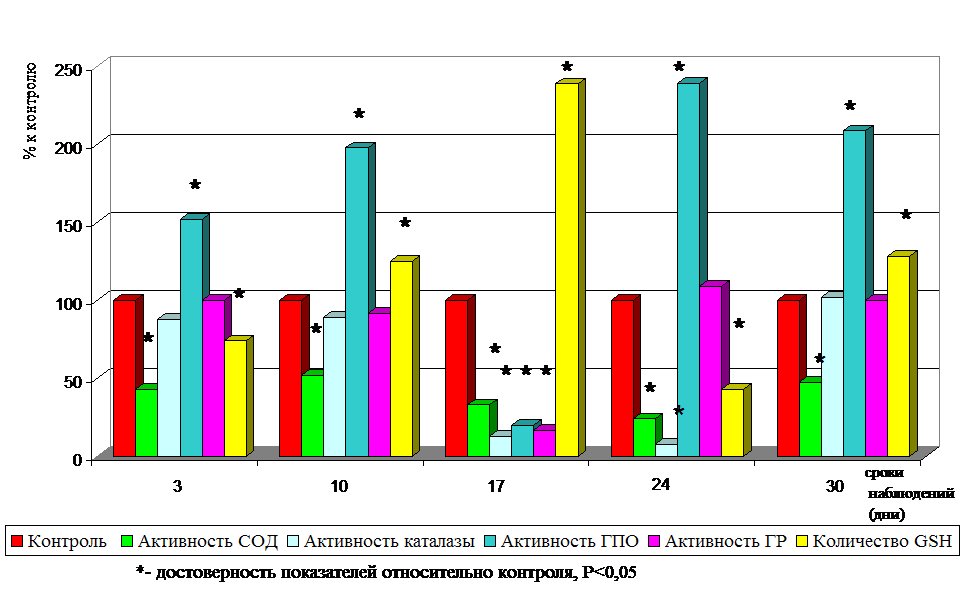 Рис. 2. Активность СОД, каталазы, ГПО, ГР и количество GSH в колоноцитах животных с экспериментальным дисбактериозом. Со стороны глутатионзависимого блока антиоксидантной защиты колоноцитов в динамике дисбактериоза также наблюдаются изменения. В начальные сроки развития дисбактериоза отмечается увеличение активности ГПО (на 51,9 %), по сравнению с контролем, при этом активность ГР соответствует, а содержание восстановленного глутатиона ниже (на 26,0 %), чем у интактных животных, что также может указывать на увеличение поступления перекисей липидов и интенсификацию ПОЛ вследствие снижения барьерной функции кишечного эпителия на фоне уже развивающихся изменений в микрофлоре. Поэтому изменения, определяемые в состоянии антиоксидантной защиты колоноцитов в первые дни развития дисбактериоза, возможно, являются следствием действия антибиотика. Характерной особенностью состояния глутатионового блока АОЗ колоноцитов к десятым суткам наблюдения является сохранение его напряженности, проявляющееся в увеличении (на 97,9 %) активности ГПО и содержания восстановленного глутатиона (на 25,1 %) относительно контрольного уровня. При этом активность ГР соответствует контрольным значениям, что сопряжено с максимальными изменениями в составе кишечной микрофлоры. Напряженность глутатионзависимого блока сменяется истощением его адаптивно-компенсаторных возможностей, отмечаемым на семнадцатый день исследования. Максимально снижается активность глутатионзависимых ферментов. Однако ведущим патогенетическим фактором в колоноцитах в этот срок наблюдения является пул восстановленного глутатиона, содержание которого более чем в 2 раза превышает соответствующие показатели у интактных животных. Таким образом, нарушение координированной работы ферментов антиоксидантной защиты колоноцитов может способствовать интенсификации свободнорадикального окисления и являться ответной реакцией организма на развитие дисбактериоза. Следует отметить, что, хотя в этот период (с 17 по 24 сутки) наблюдается тенденция восстановления численности отдельных видов эубионтов (эшерихий с нормальной ферментативной активностью), в биоценозе кишечника сохраняются явления дисбактериоза, сопровождающиеся ростом числа золотистых стафилококков и грибов рода Candida, что сопряжено с нарушением работы ферментов первой линии антиоксидантной защиты колоноцитов. Обращает на себя внимание синхронное снижение (по отношению к контролю) активности СОД и каталазы. Особенно следует подчеркнуть сниженное (в 2,3 раза) относительно контроля содержание восстановленного глутатиона, что может быть связано с его интенсивным использованием глутатионпероксидазой, активность которой превышает в 2,39 раза контрольные показатели, при активности ГР практически соответствующей норме. Таким образом, к тридцатым суткам эксперимента, в колоноцитах наблюдается усиленное функционирование глутатионзависимого блока АОЗ при депрессии линии СОД – каталаза. На этом фоне в микрофлоре кишечника общая численность условно-патогенных микроорганизмов по-прежнему остается значительной. Высокое содержание условно-патогенных микроорганизмов, определяемое в кишечном биотопе на протяжении всего срока исследования, позволило сделать предположение о высоком содержании в местной среде их существования (в колоноцитах и копрофильтратах) ТБК-активного продукта – малонового диальдегида (МДА), что может являться косвенным свидетельством повреждения клеточных мембран. По мнению некоторых исследователей (Гончарова Г.И., Дорофейчук В.Г., Смолянская А.З. и др., 1989; Самойлова Л.М., Князькова Л.Г., Яснова Л.Н. и др., 2001), увеличение содержания условно-патогенных микроорганизмов в ассоциациях может приводить к накоплению токсических продуктов их метаболизма. Повышенный уровень этих продуктов, в свою очередь, способен интенсифицировать продукцию активных форм кислорода, являющихся также токсичными для окружающих клеток, и активизируя свободнорадикальное окисление, нарушать целостность биологических мембран, что отражается на антиоксидантном статусе макроорганизма и нарушает гомеостаз. Существующее мнение, а также установленные нами в динамике экспериментального дисбактериоза изменения в активности антиоксидантных ферментов, косвенно свидетельствующие о возможной активации процессов ПОЛ, послужили основанием для определения содержания ТБК-активных продуктов (МДА) в плазме крови, колоноцитах и копрофильтратах экспериментальных животных. Анализ полученных результатов показал, что во все сроки наблюдения в течение экспериментального дисбактериоза отмечается повышенное содержание МДА во всех изучаемых объектах. Более высокое, относительно контроля, содержание МДА регистрируется в копрофильтратах, превосходя его значения на третьи сутки в 2 раза; на десятые сутки – в 4 раза; на семнадцатые сутки – более чем в 7 раз; на двадцать четвертые сутки – в 4,6 раза; на тридцатые сутки – в 4,3 раза. Однако, если увеличение количества МДА в копрофильтратах и плазме отмечается уже в первые дни наблюдения (на 100 % и 66,6 %, соответственно), то в колоноцитах достоверное повышение уровня МДА выявляется лишь к десятому дню исследования и составляет 63,2 %, а с семнадцатого дня наблюдения рост количества МДА в колоноцитах превосходит его увеличение в плазме (271 % в колоноцитах против 122,2 % в плазме). Такое соотношение величин наблюдается и в последующие сроки исследования. С двадцать четвертого дня наблюдения происходит уменьшение количества МДА во всех исследуемых объектах, однако даже к концу наблюдения (30 сутки) содержание МДА в копрофильтратах, колоноцитах и плазме достоверно превосходит данные контрольной группы животных (на 335 %, 242 %, 78 %, соответственно). Обращает на себя внимание тот факт, что наиболее высокий уровень МДА в колоноцитах и копрофильтратах экспериментальных животных приходится на 10-17 сутки – срок наиболее высокого содержания условно-патогенных микроорганизмов в микрофлоре толстого кишечника. Зафиксированные высокие значения МДА в копрофильтратах и колоноцитах экспериментальных животных могут свидетельствовать о возможном риске повреждения клеточных мембран, а так же подтверждают значительные изменения в АОЗ в зоне формирования дисбактериоза. Выявленные нами в динамике экспериментального дисбактериоза изменения в состоянии прооксидантной и антиоксидантной системы макроорганизма позволяют думать о том, что использование для коррекции дисбактериоза только пробиотических препаратов недостаточно. Рациональным дополнением могут явиться продукты функционального питания, содержащие витамины и органические кислоты, необходимые для нормального состава и функционирования микрофлоры. Наш выбор был остановлен на кисломолочном продукте функционального питания «Наринэ», содержащем живой штамм ацидофильных лактобактерий – LactobacteriumacidophilusEP 317/402. Данный штамм обладает выраженной антагонистической активностью по отношению к условно-патогенным микроорганизмам, а высокая устойчивость к антибиотикам и химиотерапевтическим средствам позволяет его использовать одновременно с этими препаратами (Костюк О.П., Чернышова Л.И., Волоха А.П., 1998; Гукасян Г.Б. и др., 2002). По данным нашего исследования (Гапон М.Н., Терновская Л.Н., Микашинович З.И., Белоусова Е.С., 2005), кисломолочный продукт «Наринэ» содержит ключевые антиоксидантные ферменты - СОД и каталазу (псевдокаталазу), что позволяет предполагать, что его использование одновременно с антибиотиком сможет оказывать воздействие, как на состояние кишечной микрофлоры, так и на состояние антиоксидантной защиты макроорганизма. В связи с этим следующим этапом исследования стало изучение влияния одновременного использования с гентамицином кисломолочного продукта «Наринэ» на состояние микрофлоры кишечника и на некоторые показатели антиоксидантной защиты эритроцитов и колоноцитов в динамике экспериментального дисбактериоза. Проведенное исследование показало, что совместное использование кисломолочного продукта «Наринэ» с антибиотиком способствует сохранению нормального состава микрофлоры кишечника. У животных, получавших наряду с антибиотиком кисломолочный продукт «Наринэ», количество бифидо- и лактобактерий не отличалось от их числа у интактных животных (lg 8,5+0,5 и lg 7,2+0,6 соответственно), сохранялась численность эшерихий с нормальной ферментативной активностью (lg 6,4+0,3), а количество эшерихий со сниженной ферментативной активностью было значительно меньше (lg 1,88+0,08), чем у животных с экспериментальным дисбактериозом (lg 7,2+0,2) и животных контрольной группы (lg 3,0+0,5). В меньшей степени, чем у животных с экспериментальным дисбактериозом, увеличивалось содержание лактозонегативных энтеробактерий (lg 4,14+0,38 против lg 4,9+0,1), коагулазоотрицательных стафилококков (lg 1,96+0,2 против lg 4,7+0,3), грибов рода Candida (lg 1,18+0,24 против lg 3,3+0,2). В составе кишечной микрофлоры животных, получавших кисломолочный продукт «Наринэ», в течение всего срока наблюдения совсем отсутствовали золотистые стафилококки и бактерии рода Proteus. Оценка состояния антиоксидантной защиты эритроцитов животных, получавших одновременно с антибиотиком кисломолочный продукт «Наринэ» и животных с экспериментальным дисбактериозом, показала, что при использовании данного продукта, во все сроки исследования повышается активность изучаемых ферментов и содержание восстановленного глутатиона. Уже с первых дней наблюдения определяется повышенная активность каталазы, относительно соответствующего показателя животных с экспериментальным дисбактериозом, которая сохраняется до конца наблюдения. Однако использование кисломолочного продукта не приводит антиоксидантную систему эритроцитов к физиологической норме. Активация каталазы, отмечаемая во все сроки наблюдения у животных, получавших «Наринэ», приводит к выраженному дисбалансу в функционировании сопряженных ферментов (СОД и каталазы), который наиболее выражен на 17-24 сутки и сохраняется до последнего дня наблюдения. На протяжении всего срока исследования у животных, получавших «Наринэ», прослеживается активация глутатионзависимых ферментов (ГР, ГПО) и высокое содержание восстановленного глутатиона, относительно этих же показателей у животных с дисбактериозом. Несколько по-иному отразилось использование кисломолочного продукта «Наринэ» на состояние АОЗ колоноцитов. На протяжении всего срока исследования (исключая 3 сутки) активность СОД определяется выше, а активность каталазы (исключая 17, 24 сутки) - ниже активности изучаемых показателей у животных с экспериментальным дисбактериозом. Несмотря на низкую, относительно контрольного уровня, активность СОД и каталазы, в колоноцитах животных, получавших «Наринэ», функционирование этих ферментов (на 10, 24, 30 сутки) более сбалансировано, чем у экспериментальных животных. В работе глутатионзависимого блока антиоксидантной системы колоноцитов значительной коррекции не отмечается. Однако состояние глутатионзависимых показателей на 10 и 30 сутки наблюдения в группе животных, получавших «Наринэ» более уравновешено и близко к физиологическому состоянию. Проведенные исследования показали, что использование кисломолочного продукта «Наринэ» способствует нормализации содержания ТБК-активных продуктов (МДА) как во внутренней среде кишечника (копрофильтратах), так и в плазме крови экспериментальных животных (Табл.1) |
