ПРАКТИКУМ ПО ХИМИИ НЕФТИ И ГАЗА. Практикум по химии нефти и газа для студентов заочной дистанционной
 Скачать 1.82 Mb. Скачать 1.82 Mb.
|
|
3.4.2. Соединения, содержащие серу О количестве сернистых соединений в нефтях судят по результатам определения общего содержания серы, выраженного в процентах. Это определение не дает точного представления о содержании сернистых соединений, если не известен их средний молекулярный вес. Ориентировочно можно принять, что количество сернистых соединений в нефти в 10—12 раз превышает количество серы, найденной по анализу. Конечно, для низкомолекулярных фракций этот коэффициент ниже, а для высокомолекулярных остатков может доходить до 15. Нефти наиболее перспективных месторождений Волжско-Уральского нефтяного района и Сибири содержат значительное количество серы. Основная масса сернистых соединений нефти имеет большой молекулярный вес и высокую температуру кипения. Поэтому от 70 до 90% всех сернистых соединений концентрируется в мазуте и гудроне. Во многих нефтях, например, в месторождениях Самарской области, обнаружена элементарная сера. В нефти она находится в растворенном состоянии и при перегонке частично переходит в дистиллятные продукты. Элементарная сера – очень агрессивный агент по отношению к цветным металлам, и особенно к меди и ее сплавам. В некоторых нефтях находится в растворенном состоянии и сероводород. Однако в дистиллятах наличие его чаще всего является следствием термического разложения других сернистых соединений. Сероводород очень токсичен, вызывает коррозию. Главная масса серы входит в состав различных органических соединений – производных углеводородов и смолистых веществ. В различных нефтях обнаружены сернистые соединения следующих типов: меркаптаны или тиоспирты (тиолы); алифатические сульфиды или тиоэфиры (тиоалканы); моноциклические сульфиды или полиметиленсульфиды; тиофен и его производные; полициклические сернистые соединения. Меркаптаны (тиолы). Имеют строение RSH. Метилмеркаптан (метантиол) — газ с т. кип. 5,9°С. Этилмеркаптан и более высокомолекулярные гомологи — жидкости, нерастворимые в воде. Температура кипения меркаптанов С2—С6 35—140°С. Меркаптаны обладают очень неприятным запахом. У низших представителей этот запах настолько интенсивен, что обнаруживается в ничтожных концентрациях (0,610-4 — 210-6 % для C2H5SH). Это свойство их используется в практике газоснабжения городов для предупреждения о неисправности газовой линии. Они добавляются к бытовому газу в качестве одоранта. Содержание меркаптанов в нефтях невелико. Так, в башкирских и татарских нефтях оно колеблется от 0,1 до 15,1% от общего содержания сернистых соединений. Исключением является сибирская марковская нефть. В бензине из этой нефти определено 0,5% меркаптановой серы. Меркаптаны нефти хорошо изучены. Из советских и зарубежных нефтей выделено более 50 индивидуальных соединений этого класса, включая первичные, вторичные, третичные и моноциклические меркаптаны с числом углеродных атомов от 1 до 8. Например: 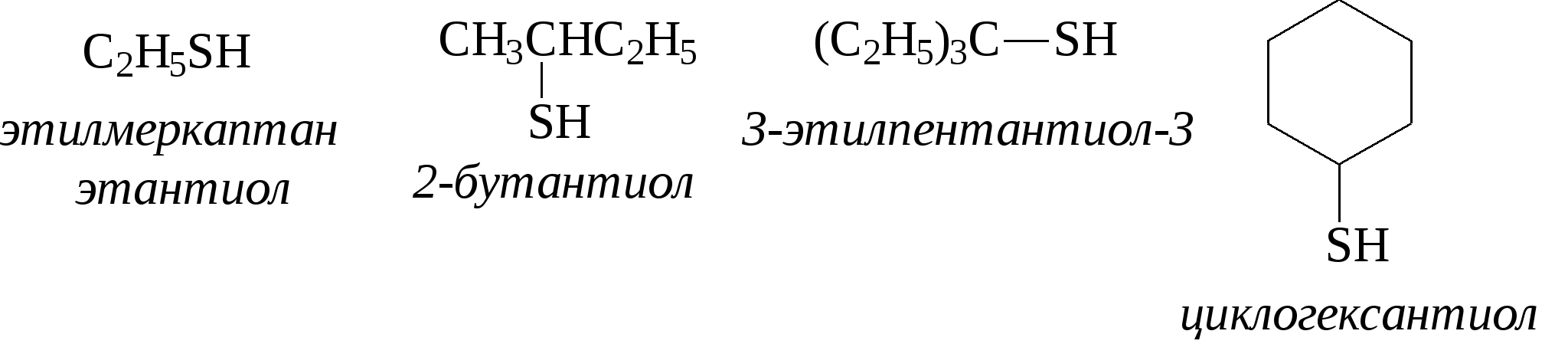 При нагревании до 300°С меркаптаны образуют сульфиды с выделением сероводорода, а при более высокой температуре разлагаются на сероводород и соответствующий непредельный углеводород: 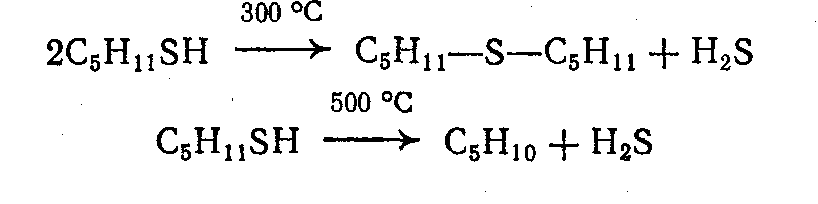 По химическим свойствам меркаптаны напоминают спирты. Со щелочами и окислами тяжелых металлов они образуют меркаптиды. Чем выше молекулярный вес меркаптанов, тем легче их меркаптиды гидролизуются водой, что затрудняет их удаление при щелочной очистке: 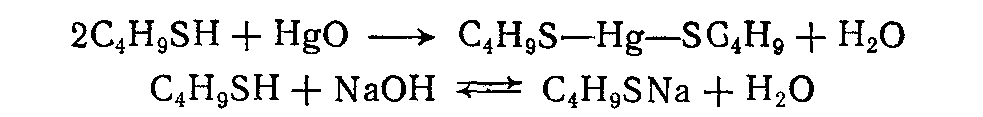 Слабые окислители и даже воздух окисляют меркаптаны до дисульфидов, а сильные – до сульфокислот: 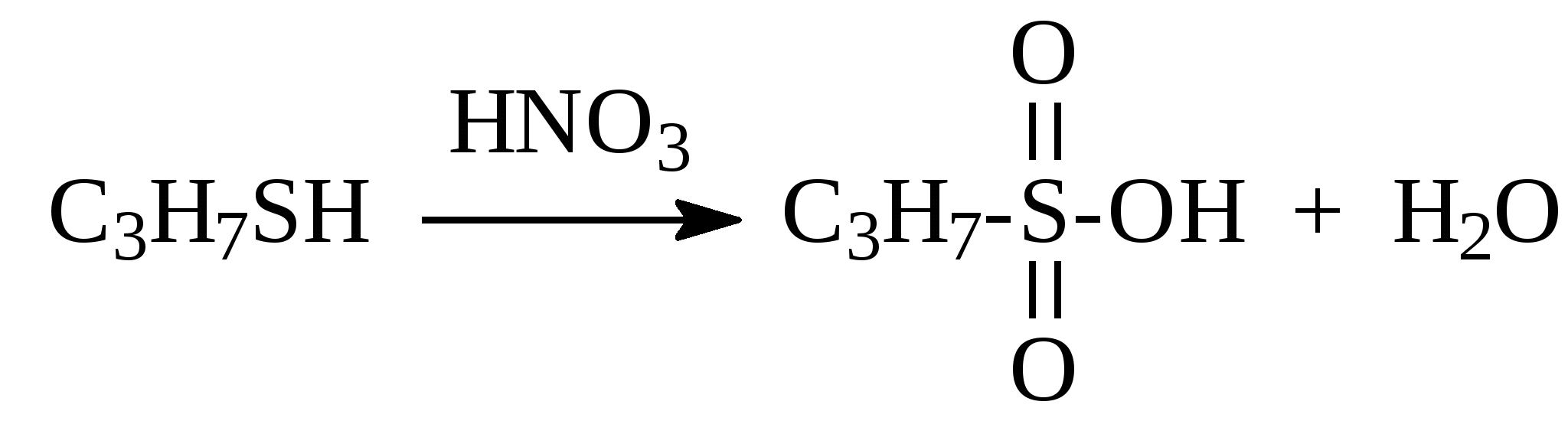 В присутствии ненасыщенных соединений меркаптаны способны присоединяться к двойной связи: 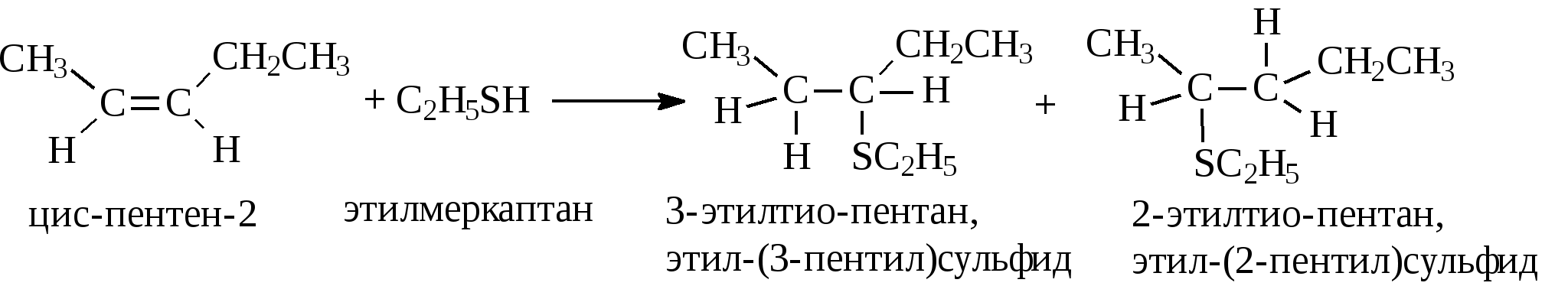 Меркаптаны являются очень вредной примесью к товарным продуктам, так как вызывают коррозию, особенно цветных металлов, способствуют смолообразованию в крекинг-бензинах и придают нефтепродуктам отвратительный запах. Элементарная сера, сероводород и меркаптаны как весьма агрессивные вещества являются наиболее нежелательной составной частью нефти. Их необходимо полностью удалять в процессах очистки и строго контролировать их наличие в товарных продуктах. Алифатические сульфиды имеют строение R—S—R'. Это жидкие вещества с неприятным запахом. Сульфиды С2 — C7 имеют низкие температуры кипения (37—150° С) и при перегонке нефти попадают в бензиновый дистиллят. Сульфиды составляют основную часть сернистых соединений, попадающих при разгонке в светлые дистилляты. Их содержание в бензинах, керосинах, дизельном топливе колеблется от 50 до 80% от суммы сернистых соединений в этих фракциях. Как и меркаптаны, индивидуальные представители класса сульфидов с числом углеродных атомов до семи найдены во многих нефтях. По химическим свойствам сульфиды — нейтральные вещества, не реагирующие со щелочами, хорошо растворяющиеся в серной кислоте. Характерной особенностью их является способность давать устойчивые комплексные соединения со многими веществами, такими, как хлорид ртути (), фтороводород, фторид бора, сернистый ангидрид и др. Сильные окислители окисляют сульфиды до сульфонов (через сульфоксиды): При 400°С и выше сульфиды разлагаются на сероводород и непредельные углеводороды: В некоторых нефтях в небольших количествах найдены также дисульфиды RSSR. При нагревании уже до 200С они выделяют серу, сероводород и меркаптаны: 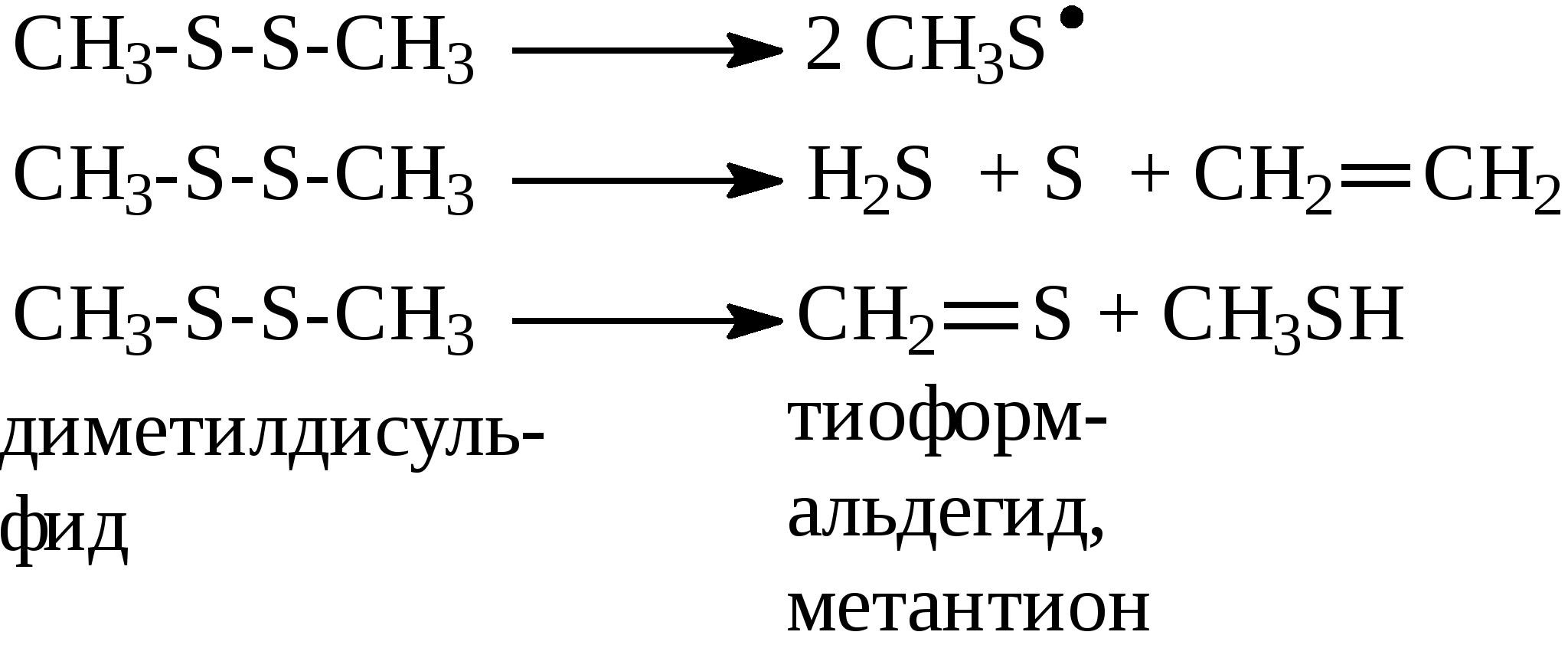 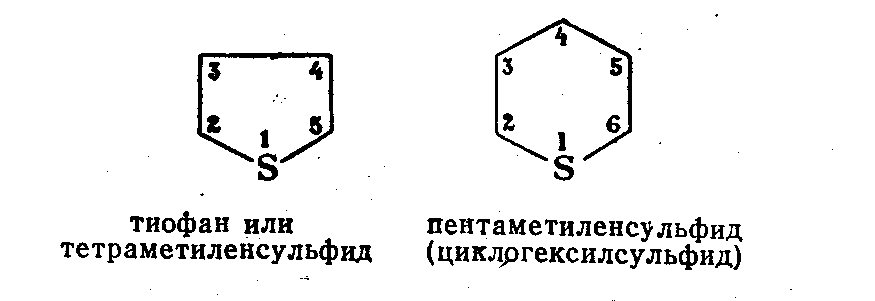 Моноциклические сульфиды, найденные в нефтях, представляют собой насыщенные пяти- или щестичленные гетероциклы с атомом серы – тиофан и циклогексилсульфид. Тиофан – жидкость с т.кип. 121°С, с неприятным запахом. Пентаметиленсульфид кипит при 142° С. Циклические сульфиды с металлами не реагируют, термически они более устойчивы, чем сульфиды с открытой цепью. Из различных нефтей выделено около 20 индивидуальных представителей моноциклических сульфидов, в основном метильных и полиметильных производных тиофана. По химическим свойствам они близки к ациклическим сульфидам, но отличаются большей стабильностью. Т  иофен был открыт в 1882 г. в каменноугольной смоле. В дальнейшем тиофен и его гомологи были обнаружены в продуктах высокотемпературной переработки нефти, а в последнее время и во фракциях первичной перегонки. Тиофен и его гомологи представляют собой жидкости с ароматическим запахом, близкие по физическим и химическим свойствам к бензольным углеводородам. В серной кислоте тиофен хорошо растворяется, на чем основана очистка от него каменноугольного бензола. иофен был открыт в 1882 г. в каменноугольной смоле. В дальнейшем тиофен и его гомологи были обнаружены в продуктах высокотемпературной переработки нефти, а в последнее время и во фракциях первичной перегонки. Тиофен и его гомологи представляют собой жидкости с ароматическим запахом, близкие по физическим и химическим свойствам к бензольным углеводородам. В серной кислоте тиофен хорошо растворяется, на чем основана очистка от него каменноугольного бензола. П 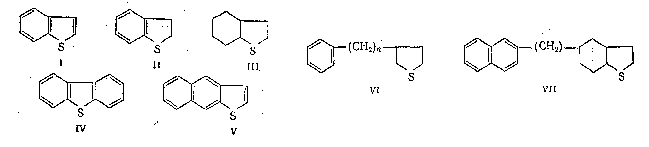 олициклические сернистые соединения попадают при разгонке в керосиновые и масляные фракции. Выделение из нефти индивидуальных высокомолекулярных сернистых соединений представляет собой исключительно трудную задачу. Многие исследователи считают, что наиболее вероятными типами высокомолекулярных сернистых соединений являются такие, в которых основные структурные элементы представлены следующими соединениями: бензтиофеном-(I), бензтиофаном (II), тионафтеном (III), дибензтиофеном (IV), нафтотиофеном (V), неконденсированными системами (VI, VII) и им подобные: По химическим свойствам тиофен более реакционноспособен, чем бензол, и во многом сходен с пирролом. Реакции электрофильного замещения протекают, в основном, в положения 2,5: 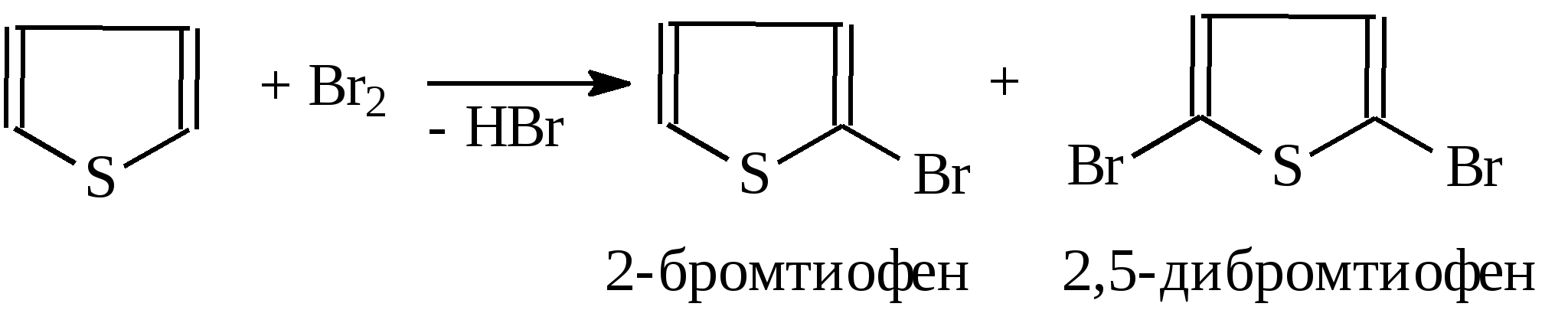 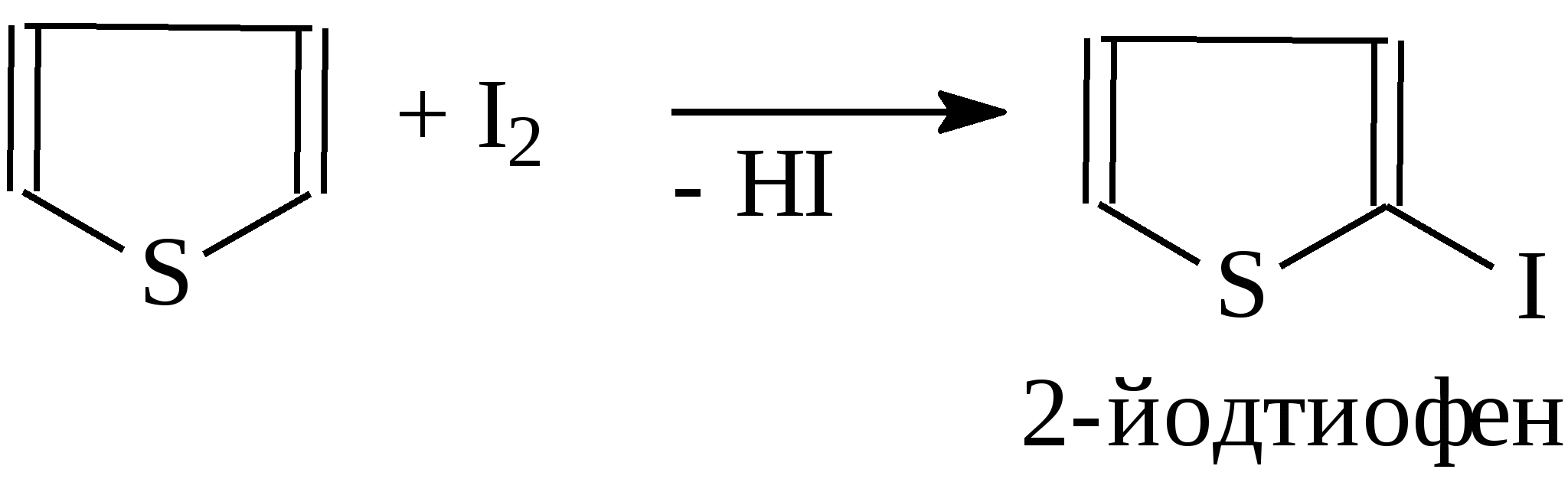 Серная, хлорсульфоновая кислоты легко превращают тиофен в сульфокислоту: 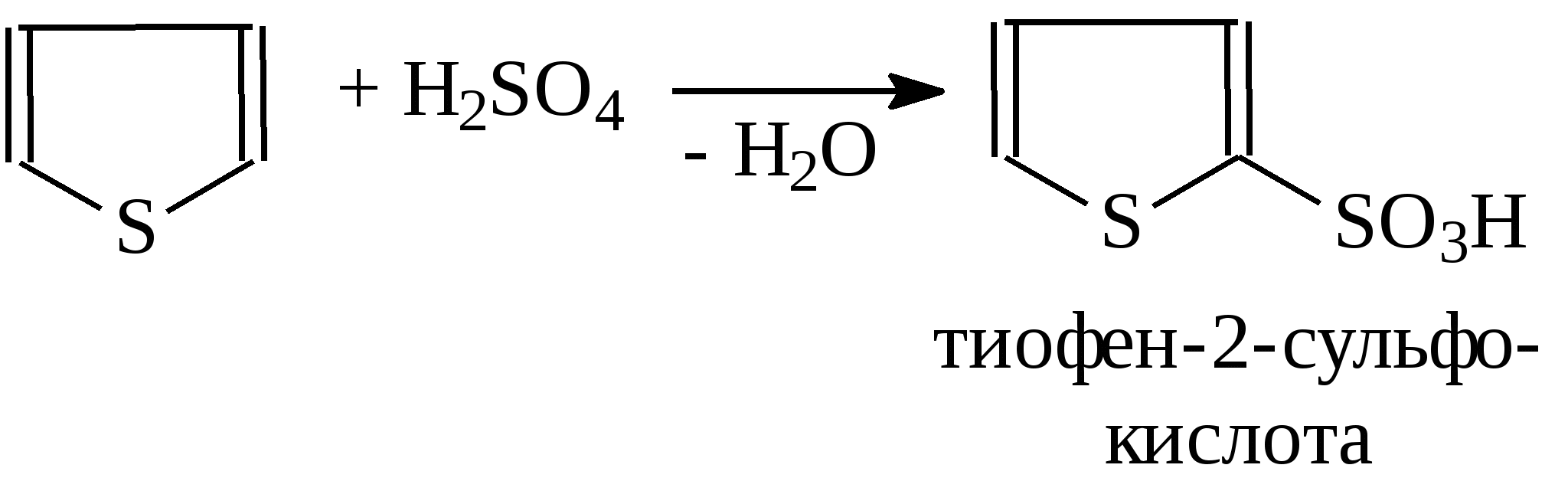 Нитрование тиофена осуществляется легко уже разбавленной азотной кислотой: 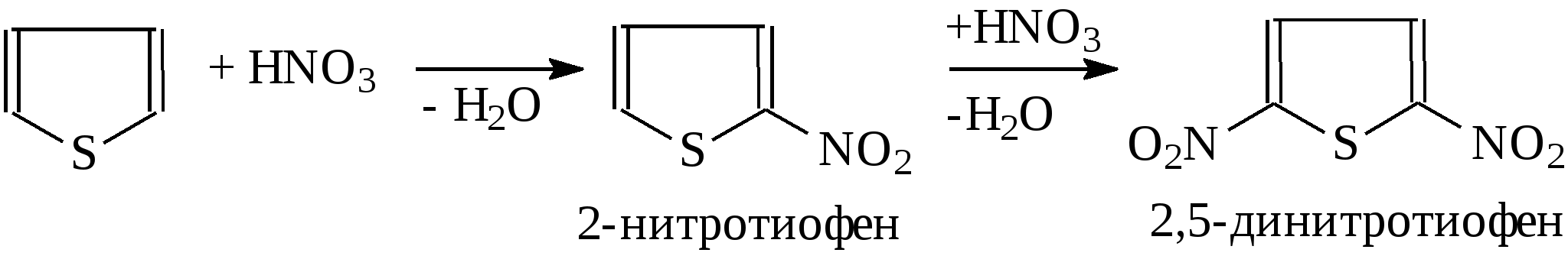 По аналогичной схеме электрофильного замещения происходят: алкилирование олефинами в кислой среде; ацилирование (введение группы СН3СО-) галоидацилом в присутствии хлорида алюминияили уксусным ангидридом в кислой среде и другие. Тиофен присоединяет водород при 2-4 атмосферах и комнатной температуре в присутствии катализаторов (палладий, никель): 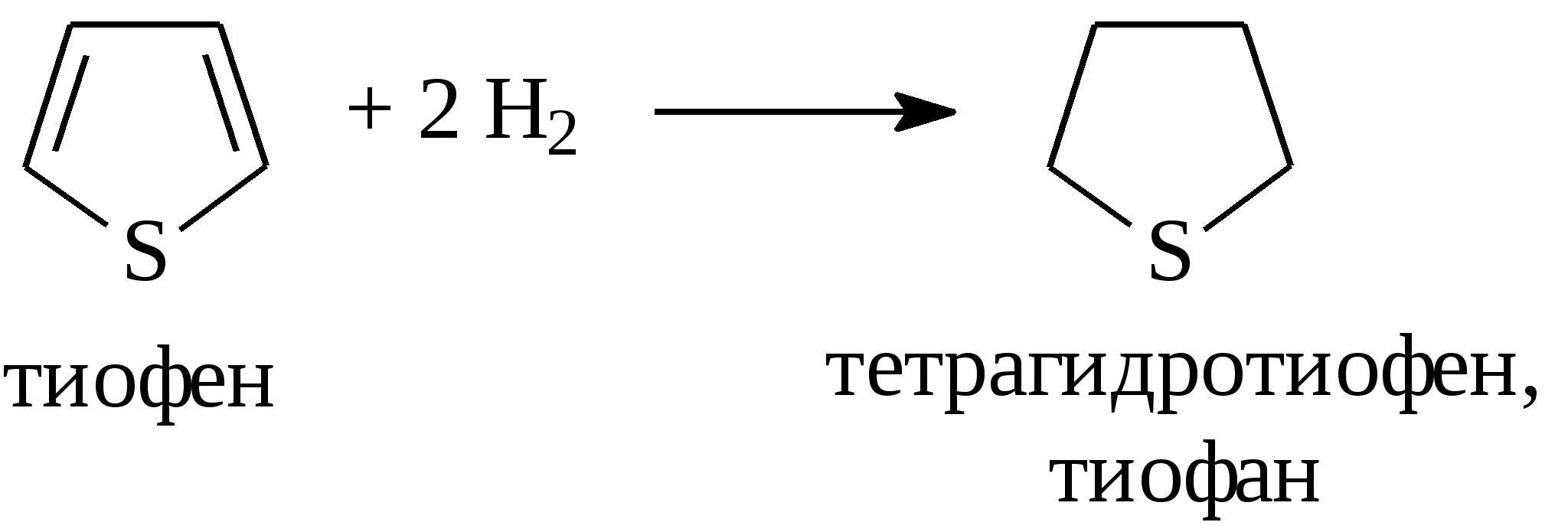 3.4.3. Практикум Лабораторная работа № 7. Химические свойства органических соединений азота и серы Опыт 1. Растворимость в воде. Поместите в пробирку 1 каплю пиридина, обратите внимание на его характерный запах. Добавьте 1 каплю воды – сразу получается прозрачный раствор. Добавьте еще 4 капли воды. Убедитесь, что пиридин очень хорошо растворим в воде и смешивается с ней во всех отношениях. Сохраните раствор для следующего опыта. Проделайте аналогичные опыты с хинолином и карбазолом. Почему карбазол малорастворим в воде? Опыт 2. Основной характер пиридина и хинолина Нанесите на полоску универсальной индикаторной бумаги каплю раствора пиридина. Можно отметить лишь слабое потемнение бумаги, соответствующее значению рН около 7,6. Пиридин проявляет слабые основные свойства. Проделайте аналогичное определение с раствором хинолина и запишите значение рН раствора. Какое соединение азота является более сильным основанием? Запишите уравнения реакций взаимодействия с водой пиридина, хинолина, изохинолина, акридина. Опыт 3. Осаждение гидроксидов металлов водными растворами пиридина, хинолина Поместите в пробирку 2 капли водного раствора пиридина и добавьте каплю 0,1 н раствора хлорида железа (). Немедленно выпадают бурые хлопья гидроксида железа (), при этом образуется хлорид пиридиния. Проделайте аналогичный опыт с раствором хлорида магния. Напишите уравнение реакций. Объясните, почему реакция протекает с солью железа, но не с солью магния. Проделайте аналогичные опыты с раствором хинолина. Запишите ваши наблюдения. Сделайте вывод о силе оснований пиридина и хинолина. Опыт 4. Растворение гидроксида меди () в водном растворе пиридина и хинолина К водному раствору пиридина осторожно добавьте по стенкам пробирки 1 каплю 0,02 н раствора сульфата меди. Образующийся вначале голубой осадок гидроксида меди немедленно растворяется. Появляется синее окрашивание вследствие образования растворимого в воде комплексного медного соединения с пиридином подобно комплексному соединению иона меди с аммиаком. Запишите уравнение реакции, считая координационное число меди равным 4. Проведите аналогичный опыт с раствором хинолина. Какой комплексный ион меди более стабилен? Опыт 5. Реакция тиолов с нитратом свинца К нескольким каплям раствора тиола в спирте добавить несколько капель насыщенного спиртового раствора ацетата свинца Pb(СН3СОО)2. Образуется желтый осадок меркаптида свинца. Напишите уравнение реакции. Опыт 6. Окисление меркаптанов, сульфидов и дисульфидов В три пробирки помещают меркаптан, сульфид и дисульфид (твердые). Добавляют в каждую 2 капли 2н серной кислоты и 4-5 капель раствора перманганата калия, содержимое энергично встряхивают. Если обесцвечивание раствора идет медленно, в пробирку добавляют 1 мл дистиллированной воды и нагревают до обесцвечивания. Напишите уравнения реакций, учитывая, что тиол и дисульфид окисляются до сульфокислот, а моносульфид – до сульфоксида и сульфона. Контрольные вопросы
Задачи
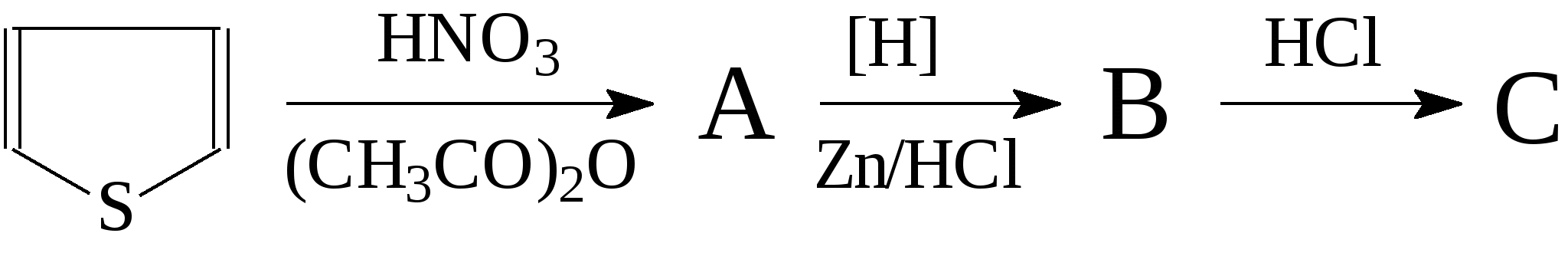 Напишите уравнения реакций и назовите соединения. 108. Осуществите превращения: 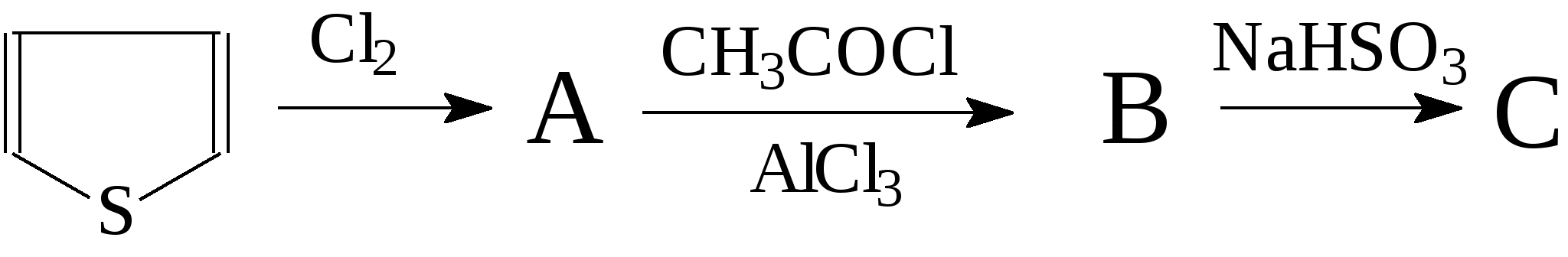 Напишите уравнения реакций и назовите соединения. 109. Из тиофена получите: а) α-этилтиофен; б) α-изопропилтиофен. Назовите все соединения и укажите условия протекания реакций. 110. Получите из тиофена хлорид 2-тиенилртути и напишите для него реакции с хлороводородом и бромом. 111. Осуществите превращения, напишите уравнения реакций и назовите соединения: 112. Осуществите превращения, напишите уравнения реакций и назовите соединения: 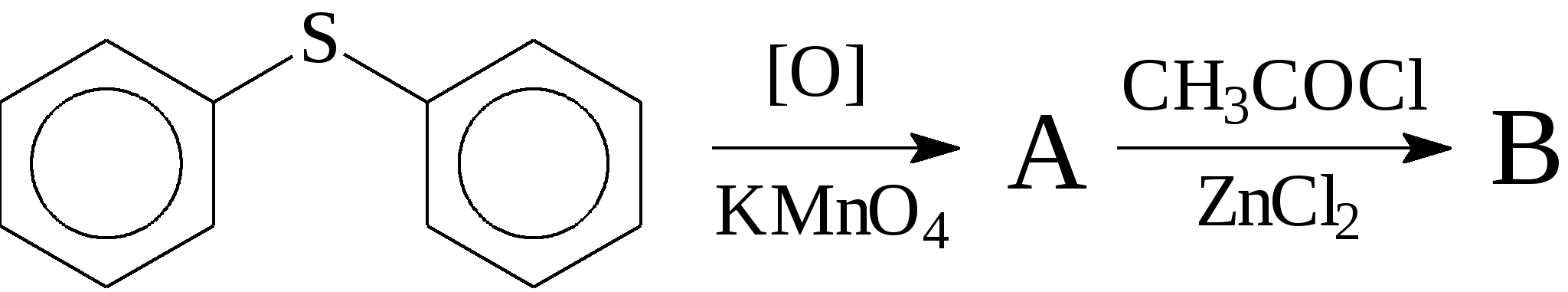 113. Осуществите превращения, напишите уравнения реакций и назовите соединения: 114. Осуществите превращения: Напишите уравнения реакций и назовите соединения. 1 Температура используется по шкале Кельвина, а давление Р10-5 Па. 2 На рис. 5 показания соответствуют значению 1,4592. 3 При прочих равных условиях по номенклатуре IUPAC наименьший номер дают атомам двойной, а не тройной связи. |
