ПРАКТИКУМ ПО ХИМИИ НЕФТИ И ГАЗА. Практикум по химии нефти и газа для студентов заочной дистанционной
 Скачать 1.82 Mb. Скачать 1.82 Mb.
|
Контрольные вопросы
Задачи 51. Напишите структурные формулы: а) метилциклопентана; б) 1,2-диметил-циклогексана; в) 3-этилциклогексена; г) 2-метилциклогексана; д) 3-бром-циклогексанона; е) циклопентиламина; ж) 2-метилциклобутанкарбоновой кислоты. 52. Напишите структурные формулы изомерных циклоалканов С7H14 с шестичленным, пятичленным и четырехчленным кольцом. Назовите их. 53. Напишите структурные формулы всех стереоизомерных цикло-бутандикарбоновых кислот. 54. Получите из соответствующих ациклических дигалогенопроизводных: а) метилциклопропан; б) 1,2-диметилциклобутан. 55. Сравните устойчивость циклопропана, циклобутана, циклопентана и циклогексана. Какие циклы наиболее устойчивы? Какими реакциями это можно подтвердить? 56. Напишите и назовите все изомеры в ряду циклобутана с брутто-формулой C6H12. Обратите внимание на цис-транс- и стереоизомерию. 57. Пиролизом кальциевых солей дикарбоновых кислот получают: 1) ме-тилциклопентан; 2) 1,2-диметилциклогексан. Напишите уравнения соответствующих реакций. 3.2.2. Ароматические углеводороды (арены) Общая формула аренов СnН2n-6. Это углеводороды, в молекулах которых присутствует бензольное кольцо:  Простейшие представители этого класса углеводородов: 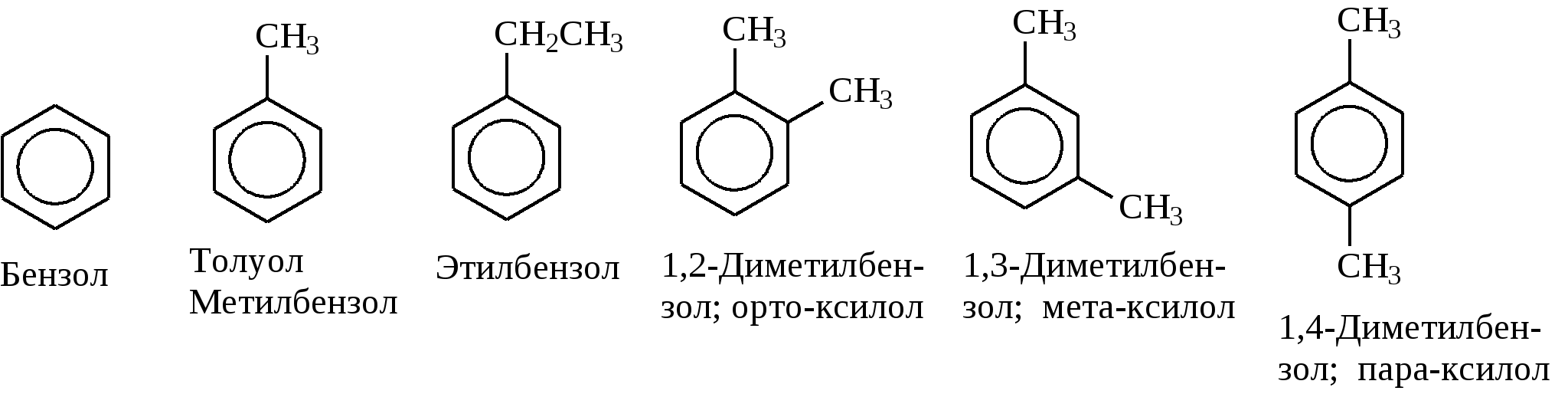 Названия гомологов бензола строятся следующим образом: – при наличии одного заместителя в ароматическом кольце называют сначала заместитель, затем добавляют бензол: 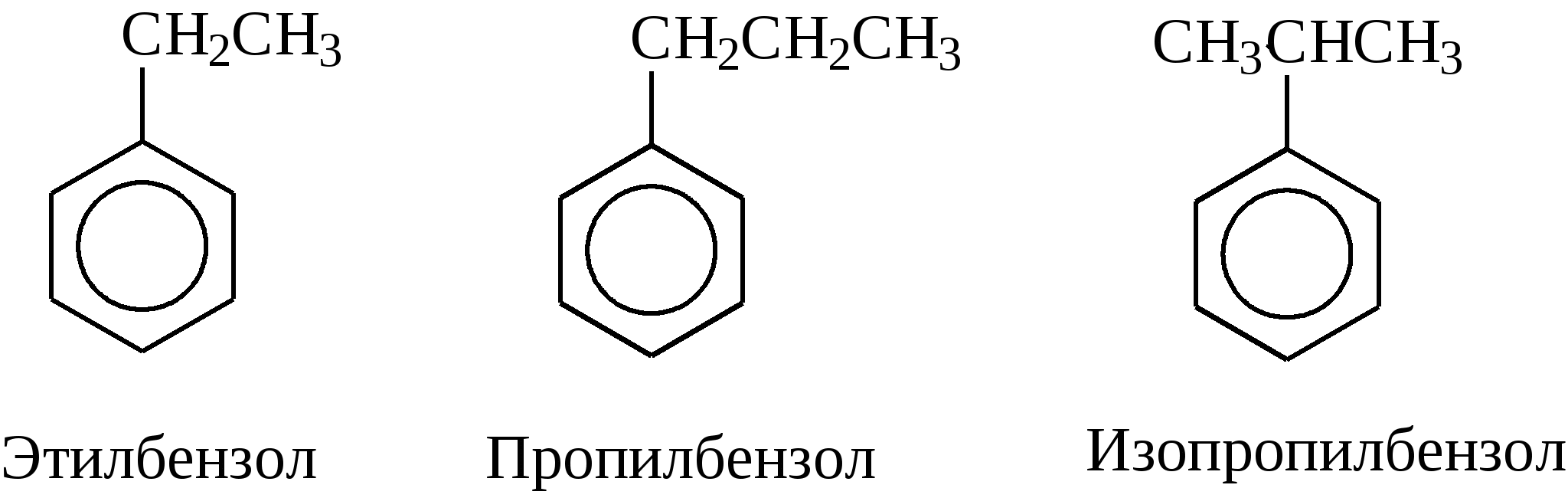 – при наличии двух заместителей положение заместителей нумеруется. При этом может быть три варианта взаимного расположения заместителей:  Кроме того, для обозначения положений 1,2- может применяться приставка орто-, для 1,3-- приставка мета-, для 1,4- - приставка пара- ; – при наличии трех и более заместителей также нумеруется положение заместителей. Из возможных порядков заместителей выбирается тот, при котором сумма номеров заместителей будет наименьшей. Например: 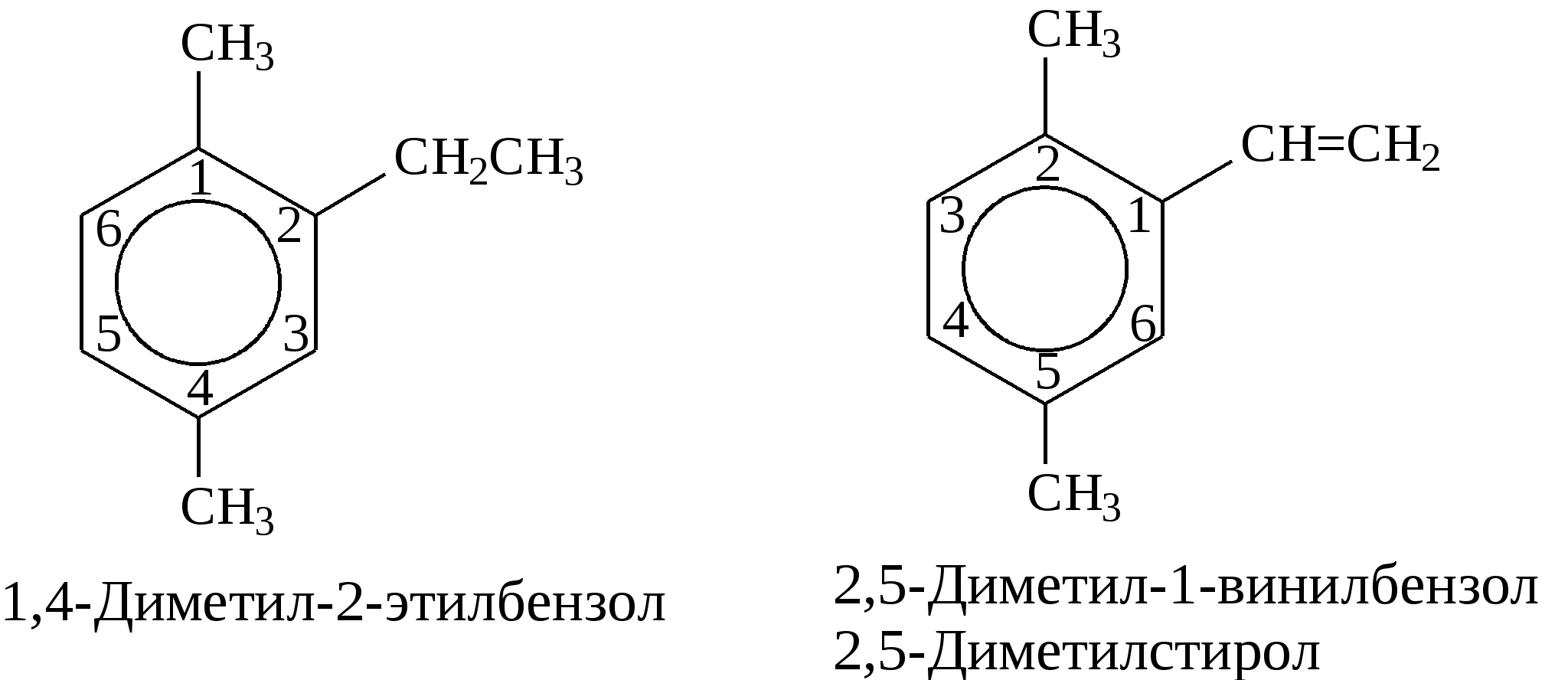 Природные источники ароматических углеводородов: а) Каменноугольная смола, которая получается при сухой перегонке каменного угля. б) Нефть. Содержание ароматических углеводородов в нефтях составляет от 5 до 35%. Из синтетических методов получения ароматических углеводородов нельзя не отметить следующие: 1. Получение из алканов, имеющих в цепи не менее шести атомов углерода, реакцией дегидроциклизации. Эту реакцию проводят при температуре 450-500°С на окисных катализаторах (Сr2O3 на Аl2О3).  2. При температуре 300°С на катализаторах Pt, Pd или Ni циклогексан дегидрируется до бензола: 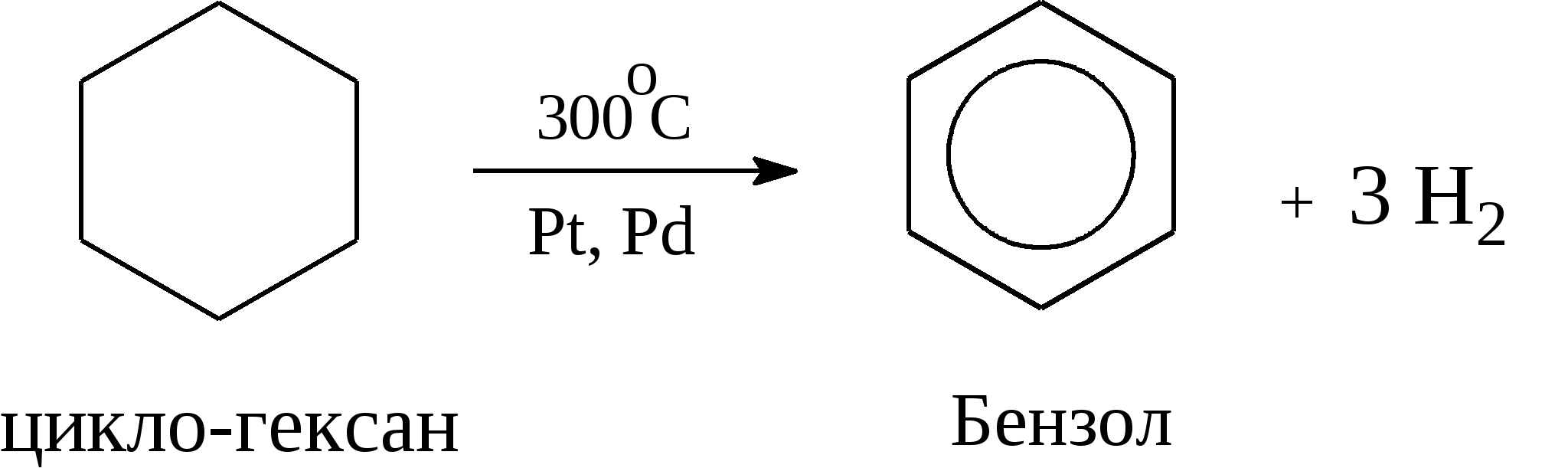 Последние две реакции являются основными, за счет которых получаются ароматические углеводороды в промышленном процессе каталитического риформинга (платформинга). 3. При пропускании ацетилена над активированным углем при 600°С получается бензол. 4. Гомологи бензола можно получить алкилированием бензольного кольца по реакции Фриделя- Крафтса: 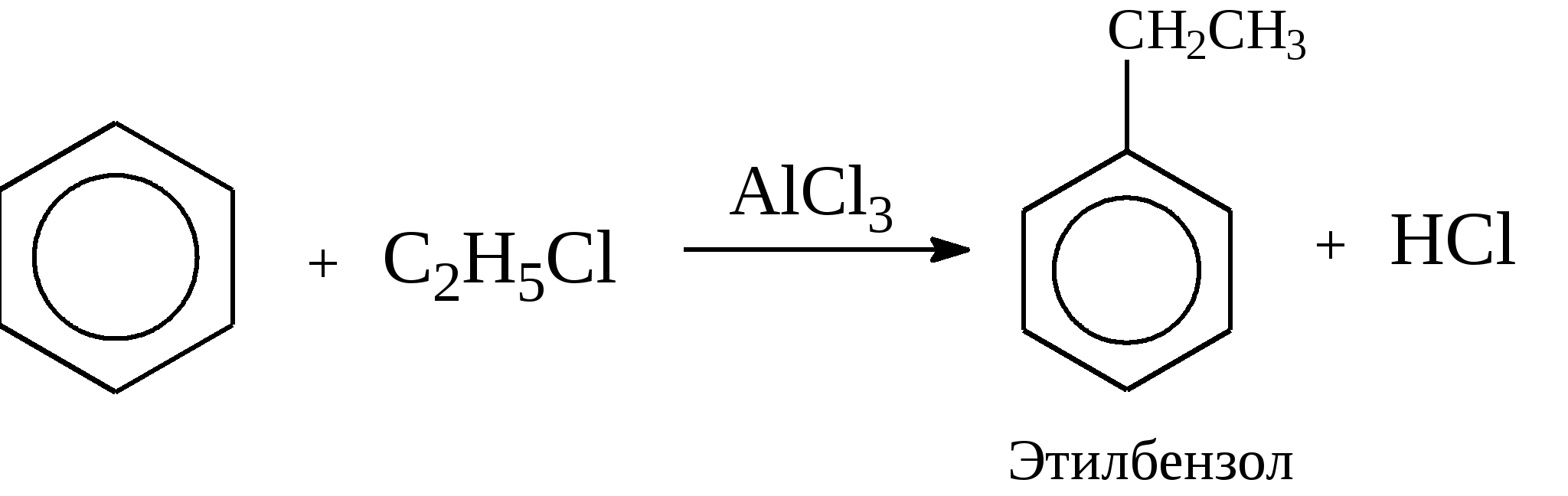 В бензольном кольце имеется замкнутая система из 6 -электронов, равномерно распределенных по всей плоскости кольца. Этим объясняются специфические свойства ароматических углеводородов. По строению бензол и его гомологи являются непредельными соединениями. Однако в обычных условиях бензол не присоединяет бром (не обесцвечивает бромную воду), не окисляется перманганатом калия (КМnO4). В отдельных случаях бензол способен к реакциям присоединения, однако они идут в более жестких условиях для бензола, чем для непредельных углеводородов. Так, молекула бензола присоединяет 3 молекулы водорода с образованием циклогексана, однако эта реакция идет при температуре 180-200°С на катализаторах Ni, Pt, Pd.  Но в целом для ароматических углеводородов более характерны реакции замещения. 1. В присутствии катализаторов хлор и бром замещают атомы водорода в молекуле бензола 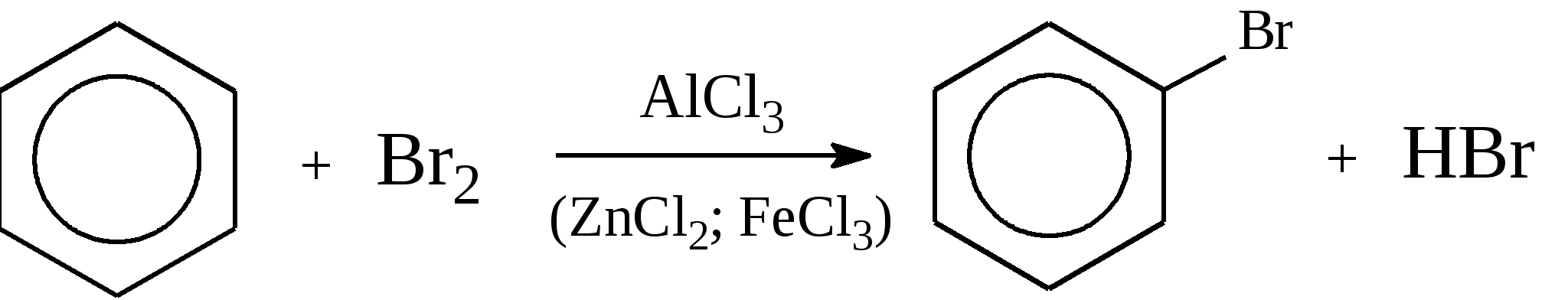 2. С НСl и НВr бензол не реагирует, а с концентрированной H2SO4 происходит замещение атома водорода на сульфогруппу (-SО3Н) и образуется бензолсульфокислота: 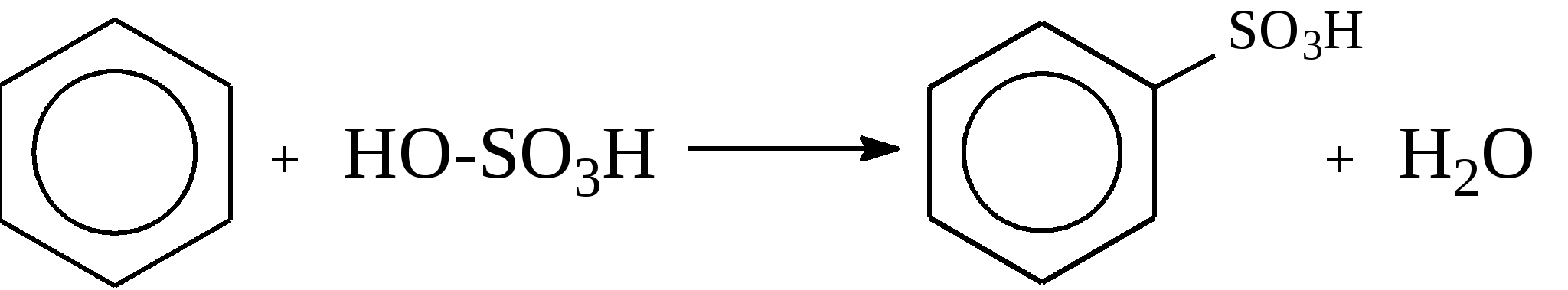 Эта реакция идет при комнатной температуре. 3. При действии на бензол смеси конц. Н2SО4 и конц. НNO3 (нитрующей смеси) происходит замещение в бензоле атома водорода на нитрогруппу -NO2: 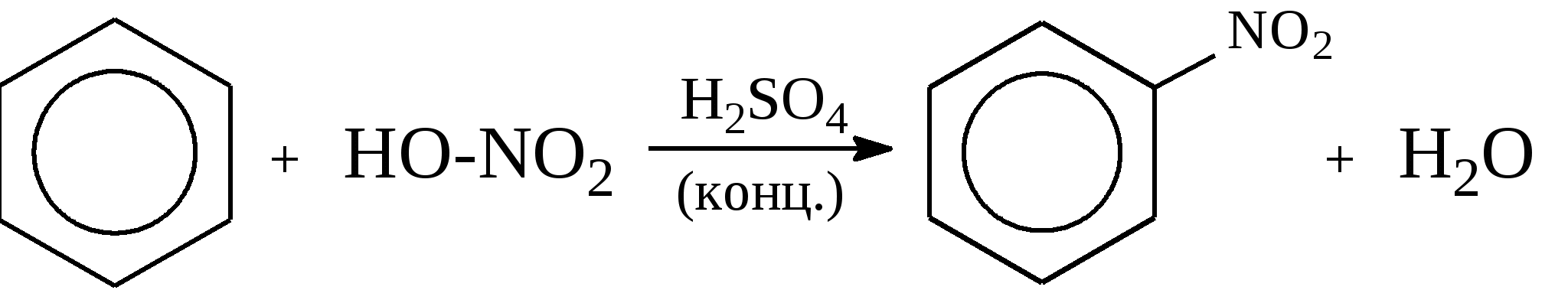 Необходимо отметить, что если в бензольном кольце уже есть заместители (группы –СН3, -СН2-СН3, -NO2, -SO3, -Вr и т.д.), они по-разному будут влиять на реакционную способность ароматического кольца в реакциях замещения. По своему действию на реакционную способность бензола все заместители делятся на две группы. Заместители I рода. Это -СН3, -СН2-СН3, -Сl, -Вr, -, -ОН, -NH2. Эти заместители облегчают введение следующего электрофильного заместителя в ароматическое кольцо и направляют его в орто- или пара-положение. Например, толуол нитруется легче, чем бензол. Нитрогруппа при этом встает в орто- или пара-положение по отношению к группе –СН3 и в результате образуется смесь орто- (I) и паранитротолуолов (II). 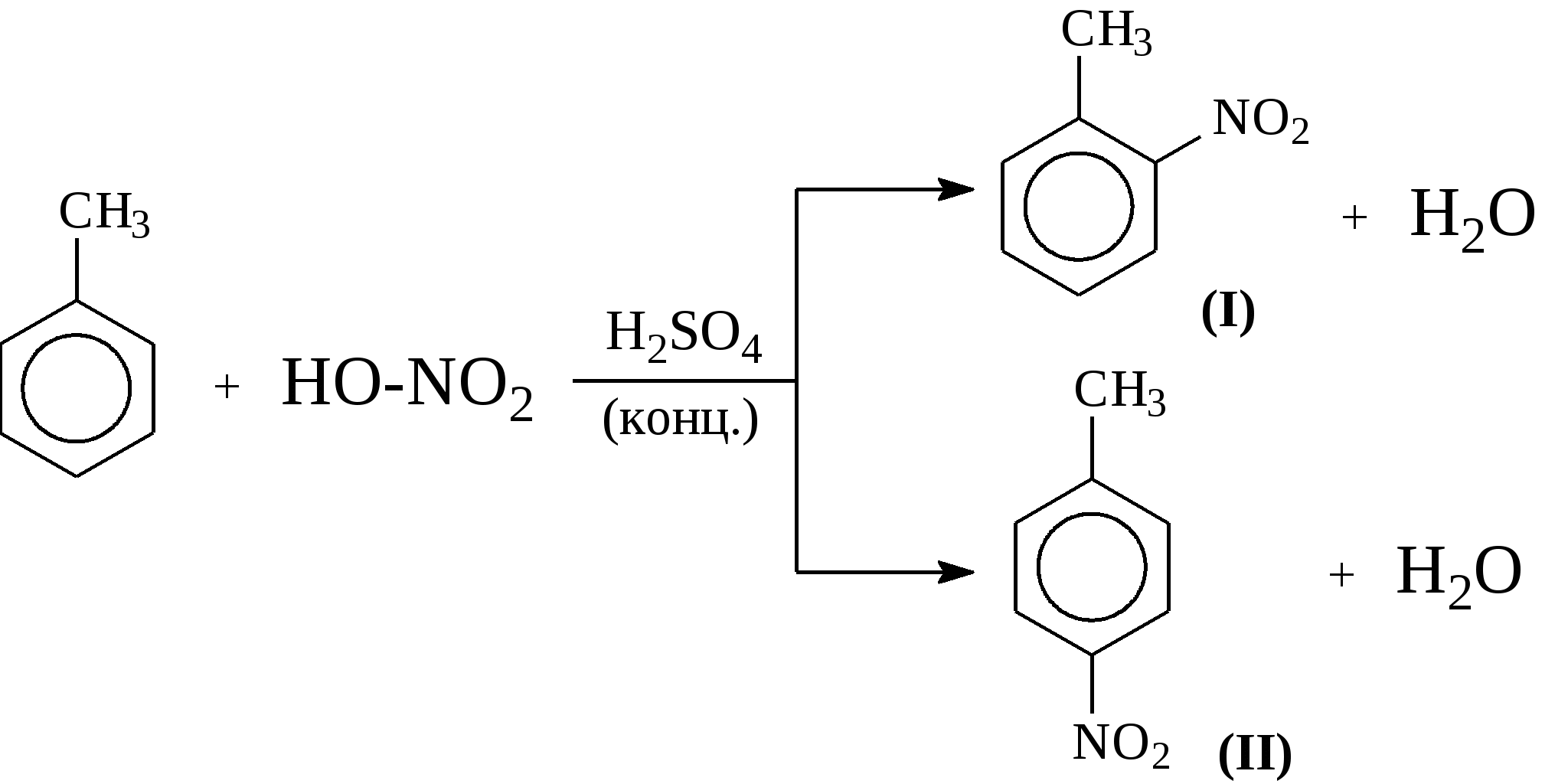 Заместители II рода. Это группы –NО2, -SO3H, -CHO, -СООН. Они затрудняют введение следующего электрофильного заместителя в ароматическое кольцо и направляют его в мета-положение по отношению к имеющемуся в кольце заместителю. Например, нитробензол нитруется труднее, чем бензол (необходимы более жесткие условия), и новая нитрогруппа (-NО2) встает в мета-положение по отношению к имеющейся в кольце нитрогруппе. 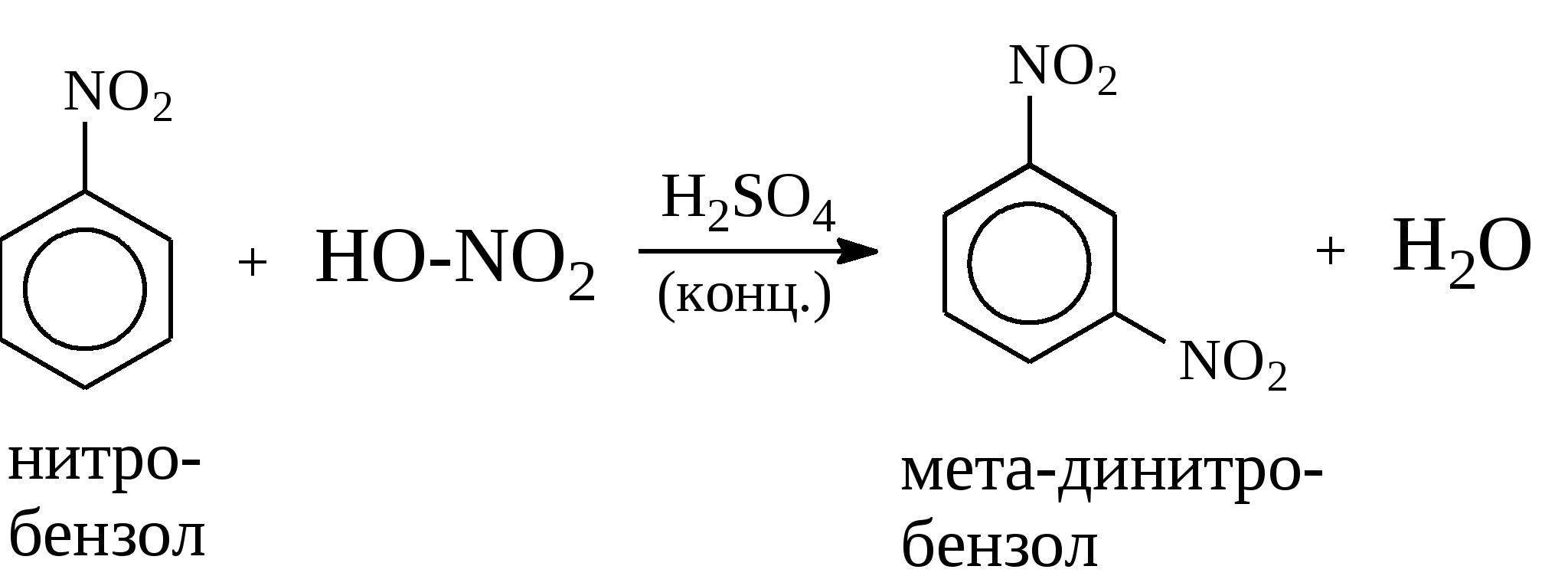 4. Бензольное кольцо устойчиво к воздействию температуры. Бензол при температурах крекинга (450-500°С) не расщепляется, а в основном конденсируется с образованием кокса. 5. Бензольное кольцо также устойчиво к действию окислителей. При действии сильных окислителей гомологи бензола окисляются по боковым цепям с образованием карбоновой кислоты (чаще всего бензойной).  Сам бензол подвергается окислению только в специфических условиях - при окислении кислородом воздуха при высокой температуре в присутствии оксида ванадия (V).  3.2.3. Практикум Лабораторная работа № 5. Химические свойства аренов Представители аренов:  Опыт 1. Бромирование бензола и толуола В одну пробирку помещают 1 мл бензола, в другую - 1 мл толуола. В каждую из пробирок добавляют по 1 мл раствора брома в хлороформе и встряхивают. Пробирки нагревают на водяной бане. Бромирования бензола в этих условиях не происходит, а толуол бромируется - происходит исчезновение окраски брома. Бромирование бензола происходит только в присутствии катализатора (железные опилки). Если в первую пробирку добавить железных опилок, встряхнуть и нагреть на водяной бане, то произойдет исчезновение окраски, следовательно, бензол бромируется. 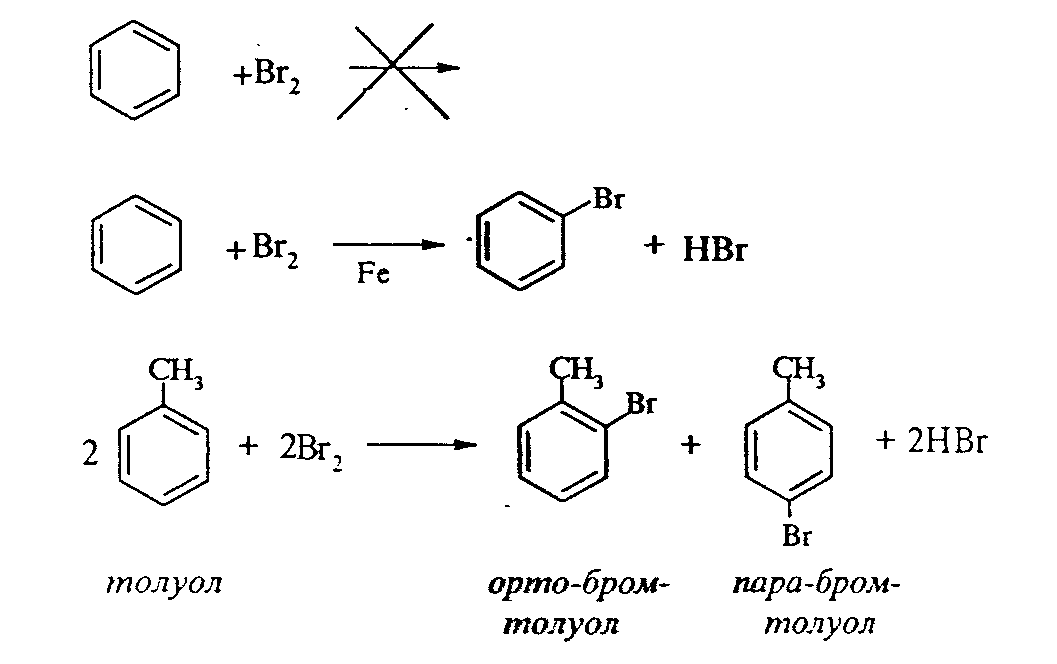 В молекуле толуола к ароматическому кольцу присоединена группа –СН3. Это заместитель I рода, он облегчает введение следующего заместителя в ароматическое кольцо и направляет его в орто- и пара-положения. Опыт 2. Сульфирование ароматических углеводородов В две пробирки помещают по 1 мл бензола и толуола и добавляют по 4 мл концентрированной серной кислоты. Затем нагревают пробирки на водяной бане до 80°С при частом и сильном встряхивании. Углеводороды образуют с кислотой эмульсию и затем постепенно растворяются в ней. Отмечают различие во времени, необходимое для полного растворения исследуемых углеводородов при одинаковых условиях (нагревание и встряхивание). Когда растворение закончится, охлаждают обе пробирки, выливая содержимое каждой пробирки в стаканчики с 10-15 мл холодной воды, и отмечают, выделяется ли исходный углеводород или продукт реакции. В противоположность насыщенным углеводородам ароматические углеводороды легко сульфируются серной кислотой, образуя сульфокислоты по схеме: 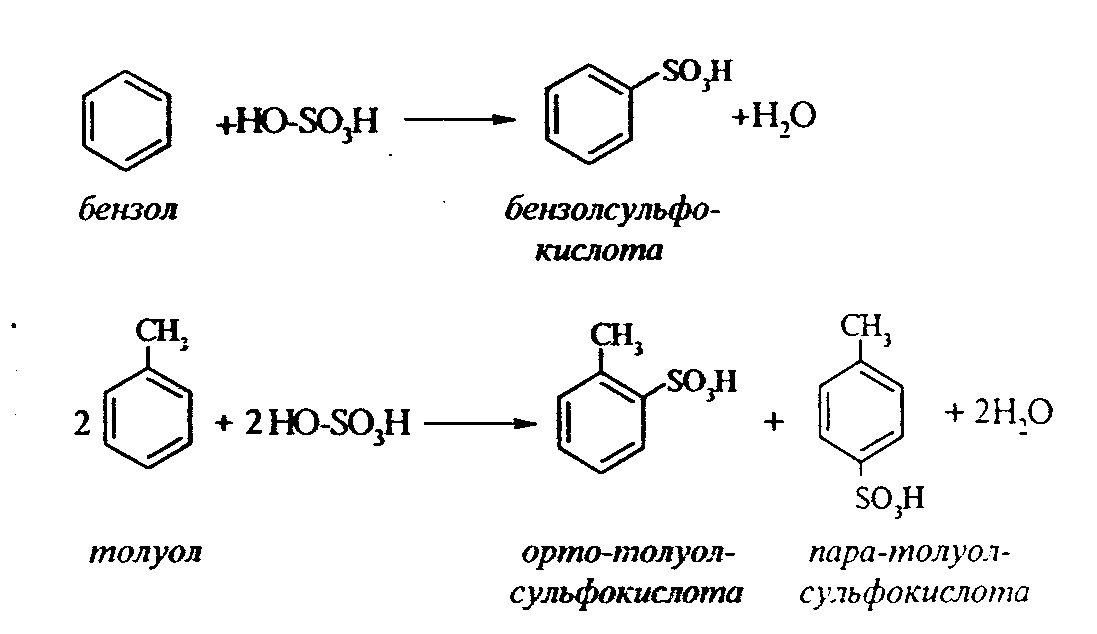 Толуол с серной кислотой образует орто-толуолсульфокислоту и пара-толуолсульфокислоту. Опыт 3. Нитрование ароматических углеводородов а) Нитрование бензола Сначала в пробирке готовят нитрующую смесь из 1,5 мл концентрированной азотной и 2 мл концентрированной серной кислот. Разогревающуюся смесь охлаждают водой. Затем в полученную нитрующую смесь постепенно добавляют 1 мл бензола при сильном, но осторожном встряхивании и охлаждении в воде. Постоянное встряхивание заставляет отделяющийся верхний слой вновь эмульгировать в нижнем. Через 5 мин реакционную смесь выливают в стаканчик с 20-30 мл воды и дают отстояться. Нитробензол выделяется в виде тяжелого желтоватого масла с запахом горького миндаля. 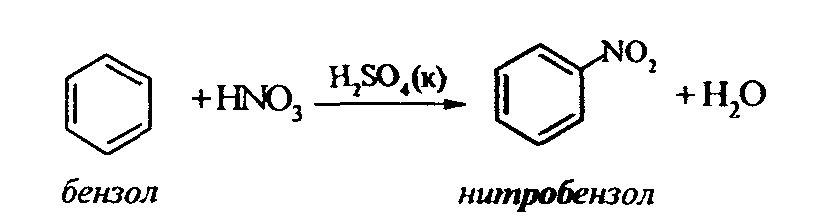 Готовят нитрующую смесь, как в предыдущем опыте. В нее при охлаждении и встряхивании по каплям добавляют 1 мл толуола. Затем содержимое пробирки выливают в стаканчик с холодной водой. Выделяется маслообразная жидкость, которая является смесью орто- и пара-нитротолуолов. 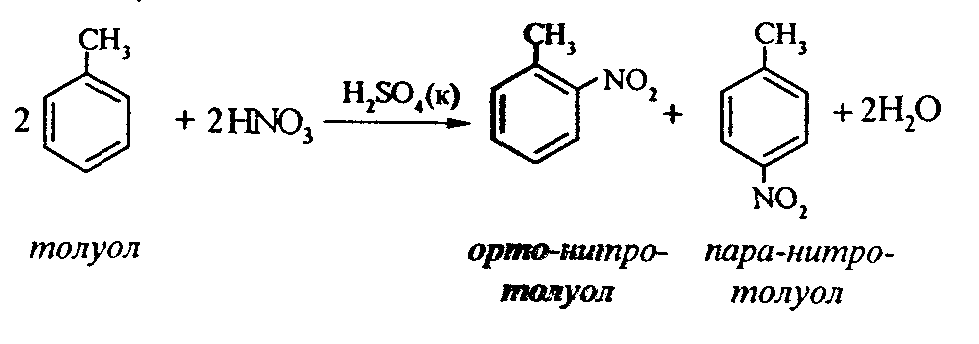 б) Нитрование нафталина В пробирку наливают 2 мл концентрированной азотной кислоты. К азотной кислоте добавляют 0,5 г нафталина. Содержимое пробирки встряхивают и нагревают на горячей водяной бане 5 мин. Затем содержимое пробирки выливают в стаканчик с холодной водой. Образовавшийся нитронафталин выделяется в виде оранжевого масла, которое быстро затвердевает при встряхивании. 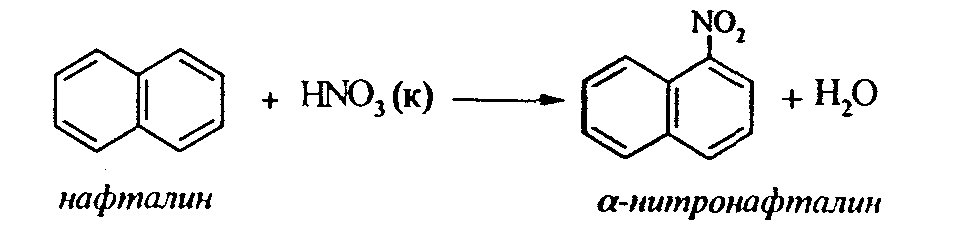 Нафталин нитруется значительно легче, чем бензол и толуол. Поэтому нитрование нафталина проводят не нитрующей смесью, а только концентрированной азотной кислотой. Опыт 4. Окисление ароматических углеводородов Опыт проводят одновременно с бензолом и толуолом. В две пробирки помещают по 1 мл раствора перманганата калия и разбавленной серной кислоты, затем добавляют по 0,5 мл в одну пробирку бензола, в другую -толуола. Сильно встряхивают каждую пробирку в течение нескольких минут. Отмечают изменение окраски в пробирках. Бензол весьма устойчив к окислению и практически не реагирует с перманганатом калия ни в кислой, ни в щелочной среде. (Если реакция идет, вероятно, бензол содержит примесь толуола). Гомологи бензола окисляются значительно легче. 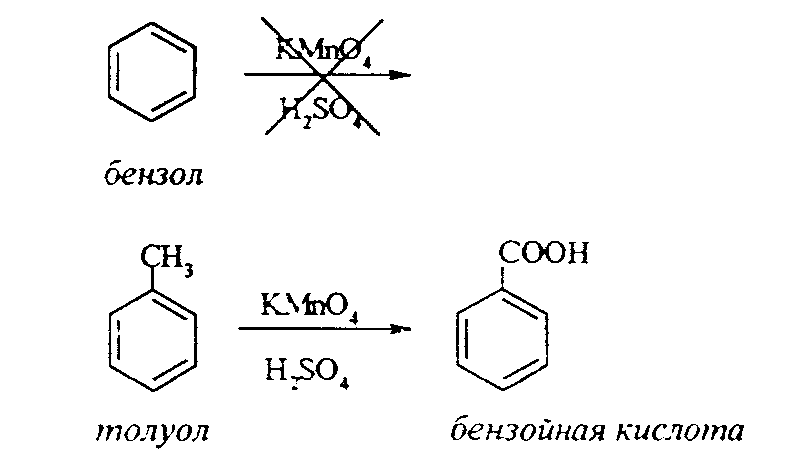 Опыт 5. Качественная реакция на ароматические углеводороды (формолитовая реакция) Ароматические углеводороды образуют с формалином в присутствии серной кислоты ярко окрашенные продукты конденсации. Это свойство используют как качественную реакцию на присутствие ароматических углеводородов в нефтепродуктах. В фарфоровую чашечку капают 4-6 капель конц. серной кислоты, затем прибавляют 3-4 капли формалина и 2-3 капли исследуемого вещества. При отсутствии ароматических углеводородов смесь остается бесцветной. Появление яркого красно-бурого окрашивания свидетельствует о наличии ароматических углеводородов в испытуемом продукте. Вместо формалина можно использовать параформ. |
