ПРАКТИКУМ ПО ХИМИИ НЕФТИ И ГАЗА. Практикум по химии нефти и газа для студентов заочной дистанционной
 Скачать 1.82 Mb. Скачать 1.82 Mb.
|
|
Пример. Навеска вещества 0,1000 г. На титрование контрольной пробы израсходовано 49,8 мл 0,1 н. раствора тиосульфата натрия, на титрование навески — 39,8 мл. Коэффициент поправки к 0,1 н. раствору Na2S2O3 равен 1. Вычислить йодное число. ИЧ = Бромное число. Используются реактивы: 1) бром, 0,1 н. раствор; 2) тиосульфат натрия, 0,1 н. раствор; 3) йодистый калий, 10%-ный раствор (свежеприготовленный); 4) крахмал. Выполнение определения. Навеску исследуемого вещества около 0,1—0,2 г, взятую с точностью до 0,0002 г, помещают в коническую колбу с притертой пробкой, приливают пипеткой 25 мл 0,1 н. раствора брома, плотно закрывают пробкой и оставляют в темном месте на 30 мин. Затем добавляют 10 мл 10%-ного раствора йодистого калия, перемешивают и титруют выделившийся йод 0,1 н. раствором тиосульфата натрия. Перед окончанием титрования добавляют раствор крахмала и титруют до исчезновения синей окраски раствора. Параллельно ставят контрольный опыт. Бромное число (БЧ) вычисляют по формуле БЧ = где v1 — количество 0,1 н. раствора тиосульфата натрия, израсходованное на титрование контрольного опыта, мл; v2 — количество 0,1 н. раствора тиосульфата натрия, израсходованное на титрование основного опыта, мл; ТNa2S2O3/Br2 — титр тиосульфата натрия по брому, г; g— навеска исследуемого вещества, г. 3. КОМПОНЕНТЫ НЕФТЕЙ, ГАЗОВ, НЕФТЕПРОДУКТОВ. СОСТАВ, СТРОЕНИЕ, СВОЙСТВА 3.1. АЦИКЛИЧЕСКИЕ УГЛЕВОДОРОДЫ 3.1.1. АЛКАНЫ Алканы – это соединения общей формулы СnН2n+2, в молекулах которых атомы углерода связаны между собой простой (одинарной) связью, а все остальные валентности насыщены атомами водорода. Первым членом ряда алканов является метан СН4, поэтому представители этого класса углеводородов еще иногда называют метановыми углеводородами. Простейшие представители ряда алканов: СН4 метан СН3-СН3 этан СН3-СН2-СН3 пропан  изобутан, 2-метилпропан изобутан, 2-метилпропанСН3-СН2-СН2-СН3 бутан СН3-СН2-СН2-СН2-СН3 н-пентан 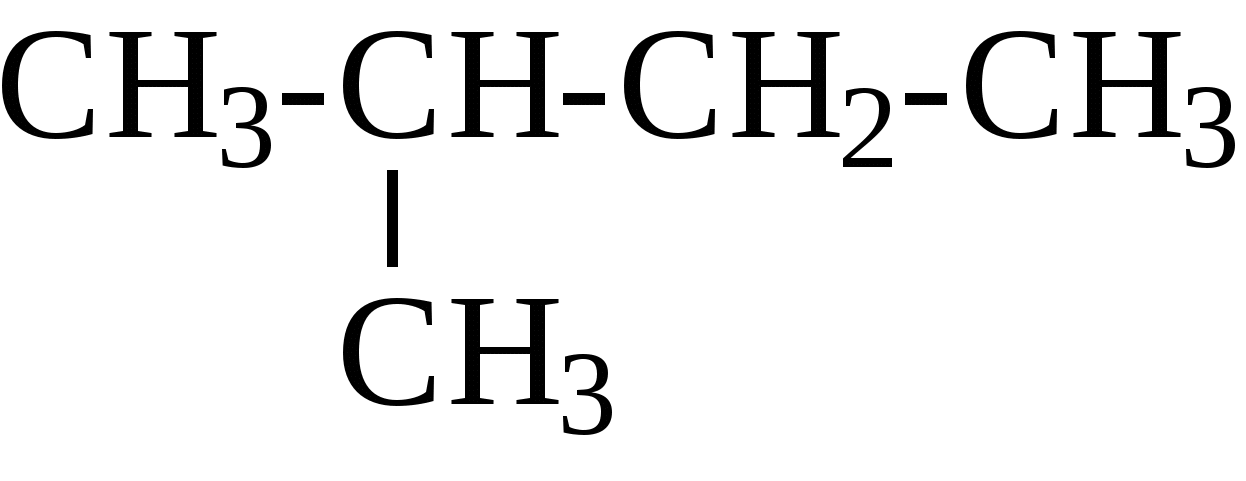 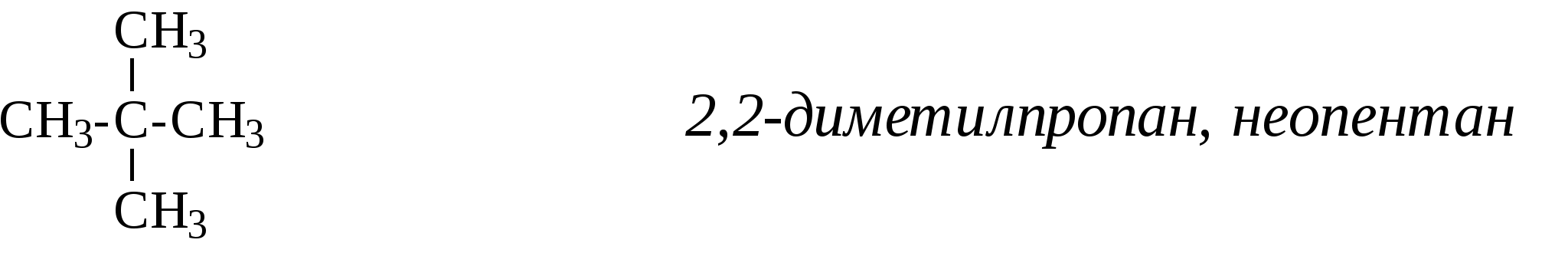 Первые четыре члена ряда имеют только один-единственный порядок связей атомов. Начиная с углеводорода, имеющего 4 атома углерода, при одинаковом составе и молекулярной массе может быть разный порядок связи атомов - разное строение - т.е. мы наблюдаем явление изомерии. Так, формуле С4H10 в ряду алканов отвечают два углеводорода разного строения, т.е. два изомера:  н-бутан 2-метилпропан C увеличением количества атомов углерода в молекуле количество изомеров увеличивается, так например, для углеводородов с общей формулой C8Н18 насчитывается 18 изомеров, а для С10Н22 – уже 75 изомеров. У каждого изомера должно быть строго определенное название, отражающее строение именно этого конкретного соединения. В настоящее время для образования названий химических соединений химики всего мира пользуются едиными правилами - правилами номенклатуры IUPAC (ее еще называют систематической номенклатурой). Рассмотрим один из разветвленных углеводородов:  В этом углеводороде имеются углеродные атомы четырех разных типов: атомы углерода, обозначенные буквой а (всего их - 5), соединены еще с одним атомом углерода, они называются первичными; атом углерода, обозначенный буквой b (1), соединен еще с двумя атомами углерода, называется вторичным; атом углерода, обозначенный буквой c (1), соединен еще с тремя атомами углерода, называется третичным; и атом углерода, обозначенный буквой d (1), соединен с четырьмя атомами углерода и называется четвертичным. Рассмотрим правила образования названий углеводородов ряда алканов согласно систематической номенклатуре. Прежде всего следует отметить, что все они имеют окончание -ан. Первые четыре члена этого ряда имеют тривиальные названия: метан, этан, пропан, бутан. Названия следующих членов ряда строятся от названий соответствующих греческих числительных с добавлением окончания -ан. Для углеводородов с прямой цепью перед названием добавляется слово нормальный или сокращенно н-: СН3-СН2-СН2-СН2-СН3 н-пентан СН3-СН2-СН2-СН2-СН2-СН3 н-гексан СН3-СН2-СН2-СН2-СН2-СН2-СН3 н-гептан СН3-СН2-СН2-СН2-СН2-СН2- СН2-СН3 н-октан СН3-СН2-СН2-СН2-СН2-СН2-СН2-СН2-СН3 н-нонан СН3-СН2-СН2-СН2-СН2-СН2-СН2-СН2-СН2-СН3 н-декан Если от молекулы предельного углеводорода отнять один атом водорода, то образующийся при этом остаток называется радикалом или алкилом. Названия радикалов образуются от названия соответствующего алкана с заменой окончания –ан на -ил. Например: СН3- метил СН3-СН2-СН2-СН2- бутил 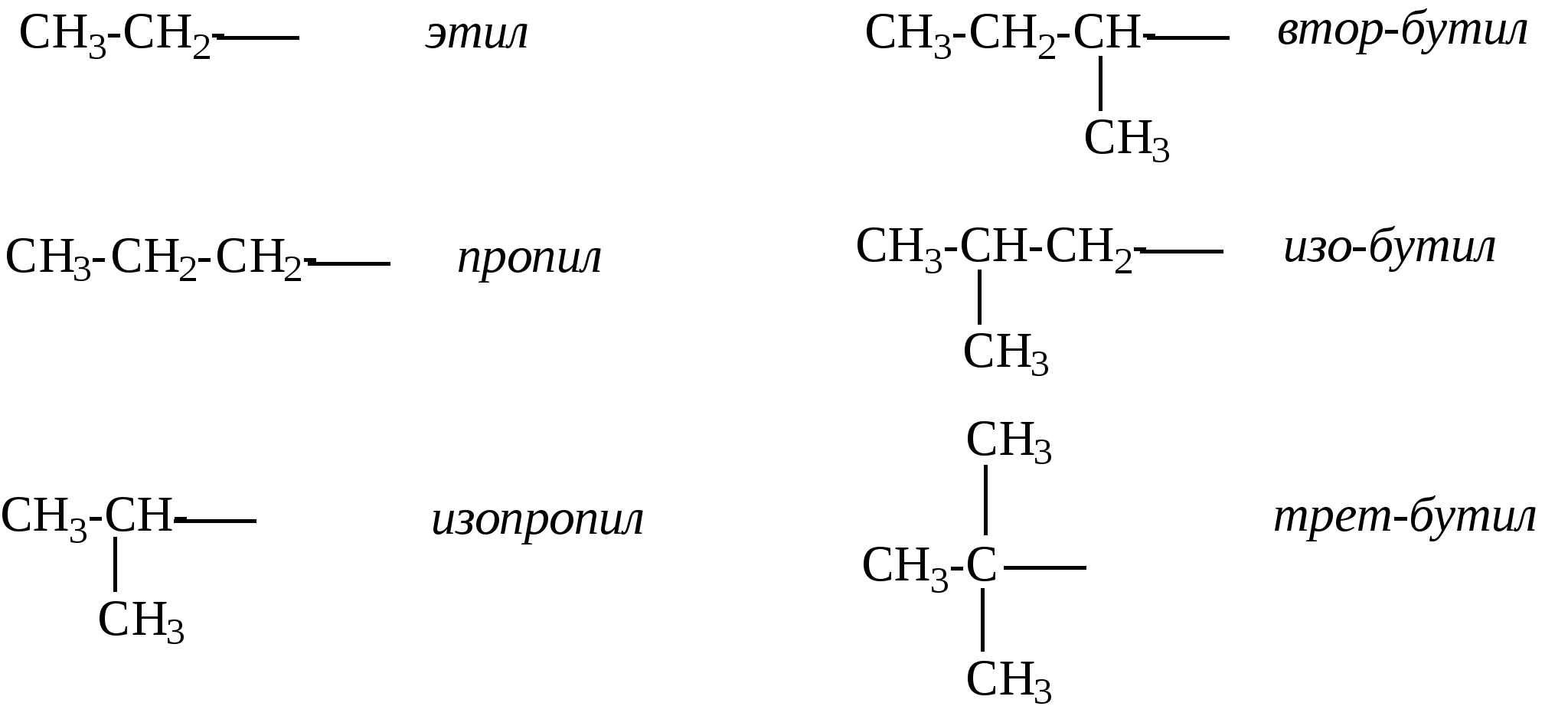 Для того, чтобы назвать разветвленный алкан по систематической номенклатуре, необходимо:
Например: 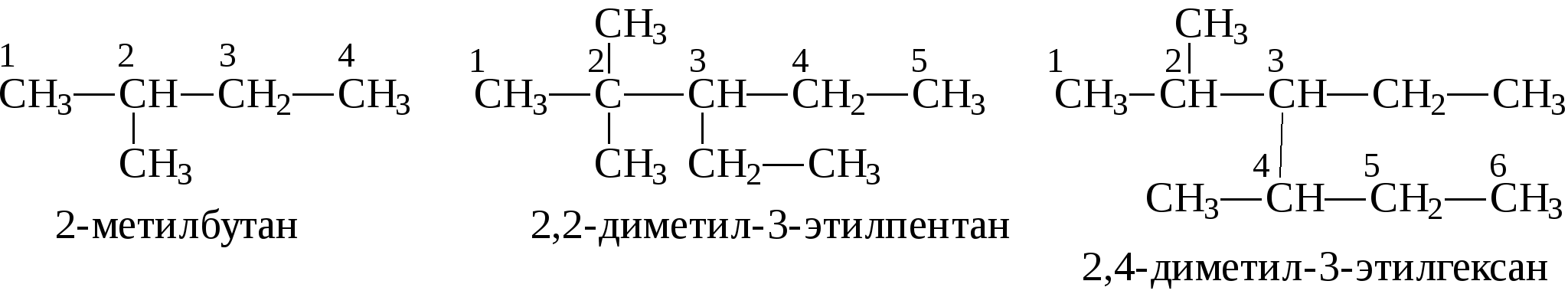 Природные источники предельных углеводородов - это нефть и природные газы, при этом под последними понимают газы чисто газовых месторождений, попутные газы и газы газоконденденсатных месторождений. Во всех этих газах основными компонентами являются алканы состава C1-C4 (метан, этан, пропан, бутаны), причем преобладает метан. В газах в заметных количествах могут содержаться метановые углеводороды C5 и выше, при этом если содержание таких алканов более 100 г/м3, эти газы называют "жирными" газами. Жидкие метановые углеводороды (содержащие в молекуле от 5 до 16 атомов углерода) и твердые (17 и более атомов углерода в молекуле) встречаются в нефтях. Содержание алканов в различных нефтях колеблется от 20 до 70% и оказывает значительное влияние на физико-химические характеристики нефтей и нефтепродуктов. Так, в зависимости от количественного состава и строения алканов в нефтях и нефтепродуктах могут в значительной степени изменяться такие их характеристики, как вязкость и температура застывания. Из других методов получения алканов можно привести следующие: 1. Гидрирование алкенов: 2. Сплавление натриевых солей карбоновых кислот со щелочами. При этом получается алкан, содержащий на один атом углерода меньше, чем исходная кислота.  3. Действие металлического натрия на галогенпроизводные - реакция Вюрца:  Алканы отличаются малой реакционной способностью. Основной тип взаимодействия алканов с различными реагентами - это реакции замещения атомов водорода на другие атомы или функциональные группы. Так, например, идет реакция с галогенами:  Реакция эта идет при нагревании или ультрафиолетовом освещении. Алканы не присоединяют водород, в обычных условиях не реагируют с кислотами НСl, НВr, H2SO4. М.И.Коноваловым были разработаны условия, при которых алканы реагируют с азотной кислотой с замещением одного из атомов водорода на нитрогруппу (-NO2). 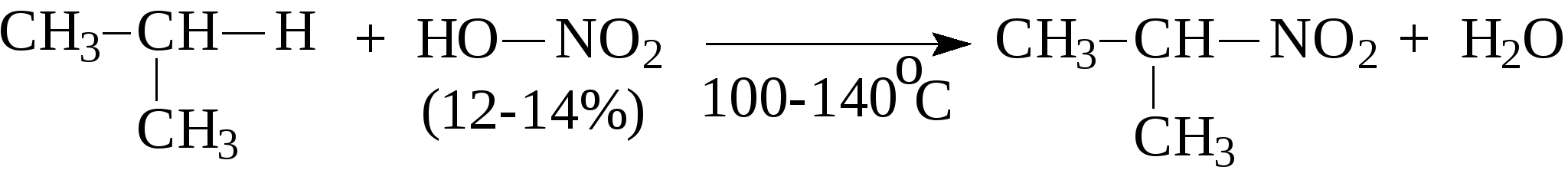 В промышленности нитрование алканов проводят парами азотной кислоты при температуре 250-500°С. Реакция сопровождается расщеплением углеводородов с получением смеси нитросоединений различной молекулярной массы: 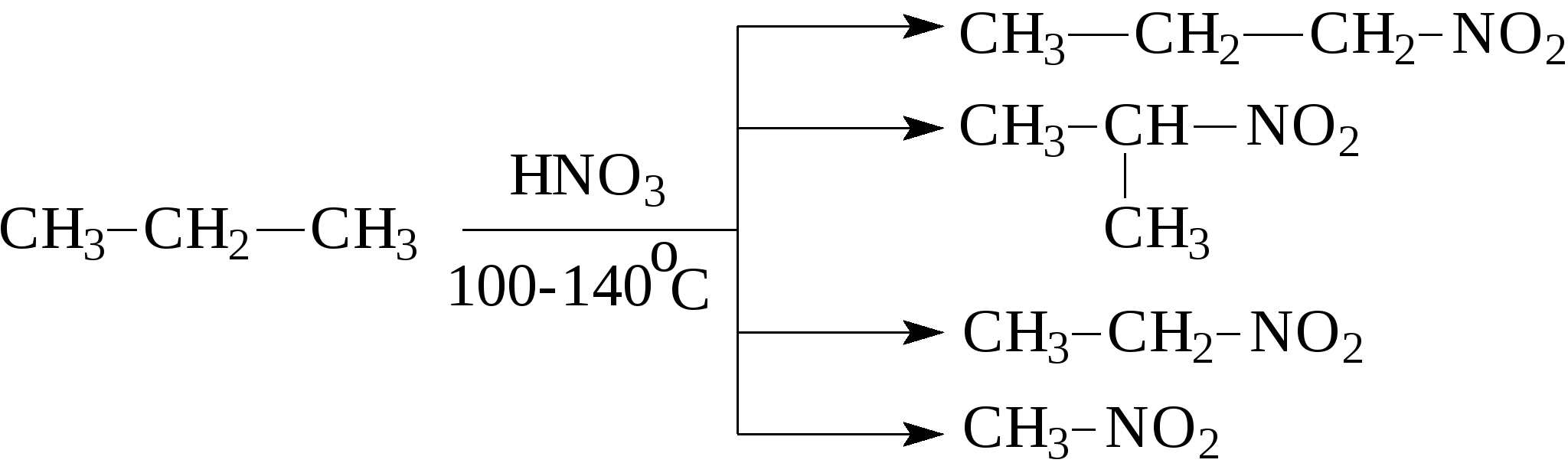 При обычных условиях на алканы не действуют ни кислород воздуха, ни такие сильные окислители, как, например, концентрированный раствор KMnO4 (перманганат калия). Только при нагревании окислители действуют на алканы, при этом происходит расщепление углеродной цепи и образуются карбоновые кислоты: 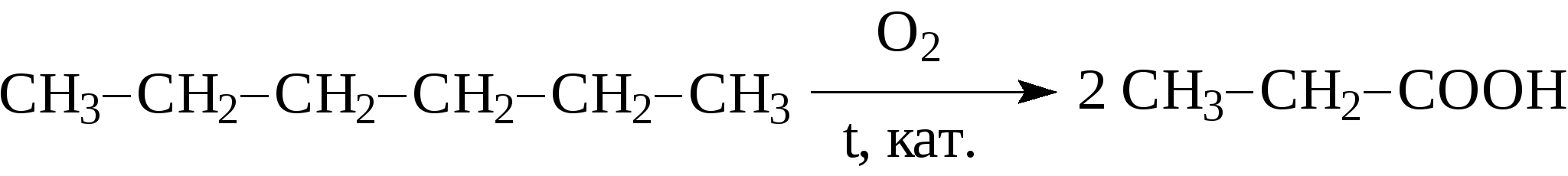 Так в промышленности осуществляется окисление твердых парафиновых углеводородов, выделенных из керосино-газойлевых фракций нефтей. Окисление проводят кислородом воздуха при температуре 100-150°С на катализаторах. При этом получают высшие жирные кислоты (с числом атомов углерода C10-С20), которые далее используются для получения мыла и других поверхностно-активных веществ. При температурах выше 400-450С алканы (за исключением метана, этана, пропана) неустойчивы и подвергаются расщеплению в основном по связям С-С с образованием молекулы алкана и алкена меньшей молекулярной массы. 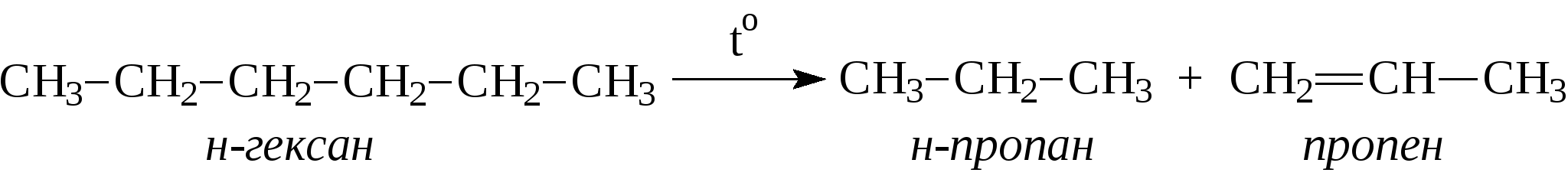 На этом основаны процессы крекинга, с помощью которых в промышленности из высокомолекулярных нефтяных продуктов, кипящих при температурах выше 300°С (например, мазут) получают низкомолекулярные продукты, такие как газ, бензин. К важнейшим свойствам алканов, используемым в нефтегазовом деле, относятся реакции образования комплексов с мочевиной или тиомочевиной, а также клатратных соединений. В 1940 г. немецкий исследователь Бенген установил, что алифатические соединения с линейной структурой молекул, в частности, алканы, содержащие более шести атомов углерода, образуют с мочевиной (карбамидом) кристаллические комплексы. Разветвленные алканы и циклические углеводороды (циклоалканы, арены), как правило, не способны к комплексообразованию с карбамидом. Впоследствии было показано, что карбамид может давать комплексы и с разветвленными алканами при условии, что их молекулы содержат неразветвленную часть цепи с девятью и более атомами углерода, например, с 2-метилундеканом, а также с циклическими углеводородами, имеющими боковую линейную цепь с 18 и более атомами углерода. Комплексы имеют гексагональную структуру, при которой молекулы карбамида располагаются по спирали на гранях правильных шестигранных призм. Удерживается спираль за счет межмолекулярных водородных связей типа: 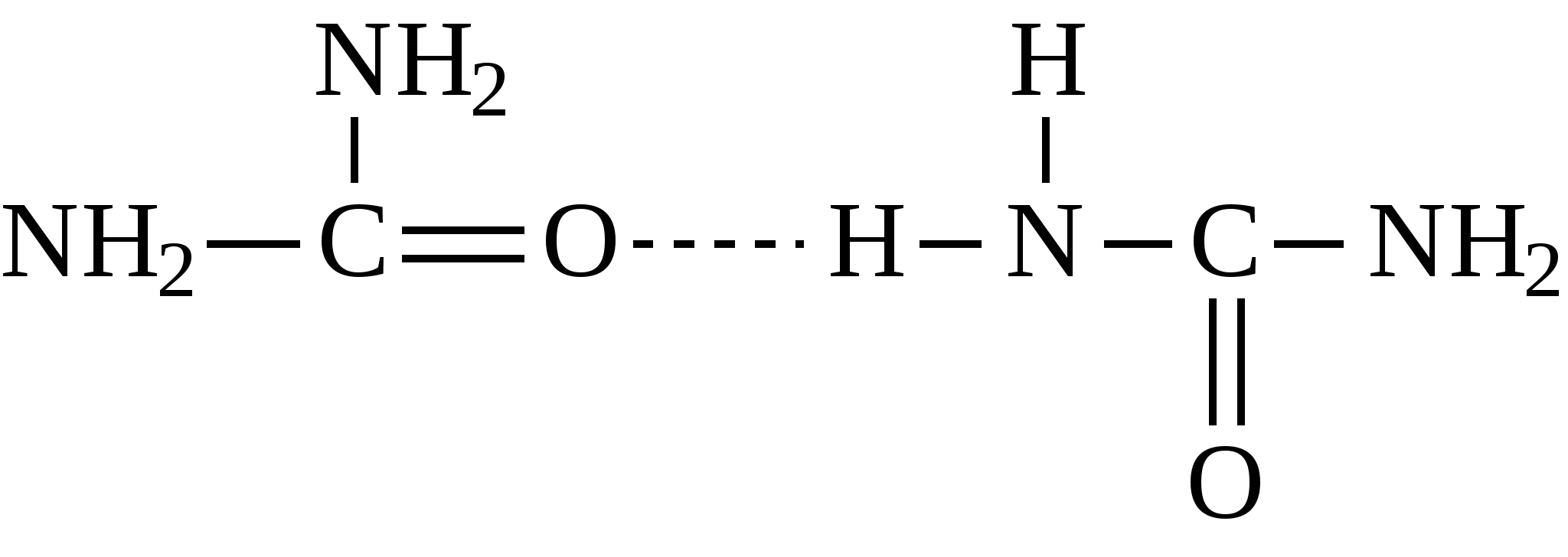 Витки спирали — элементарные ячейки, состоящие из 6 молекул карбамида,— параллельны между собой и находятся на расстоянии 0,37 нм друг от друга. Внутри спирали образуется канал гексагональной формы, имеющий эффективный диаметр 0,49 нм. Поперечное сечение молекул нормальных алканов колеблется от 0,38 до 0,42 нм, поэтому они хорошо вписываются в канал и удерживаются в нем за счет сил Ван-дер-Ваальса. Молекулы разветвленных алканов, циклоалканов и аренов имеют критические диаметры больше 0,49 нм—эффективного диаметра канала — и поэтому не образуют аддукты с карбамидом. Стабильность комплексов возрастает с удлинением цепи нормального алкана. Это объясняется тем, что между молекулами углеводородов, находящимися в канале, сохраняется расстояние ≈0,24 нм. Чем короче молекулы нормальных алканов, тем больше доля пустот — незаполненных участков в канале — и тем менее энергетически выгодно образование карбамидных комплексов, протекающее с выделением тепла. Например, теплота комплексообразования при переходе от гексадекана к октану уменьшается от 88 до 33,1 кДж/моль. Образование аддуктов с гексаном и еще более низкокипящими нормальными алканами энергетически невыгодно, и при комнатной температуре и атмосферном давлении выделить соответствующие комплексы не удается. Но, несмотря на возрастание стабильности комплексов с удлинением молекул нормальных алканов, наиболее эффективна карбамидная депарафинизация средних нефтяных фракций с концом кипения не выше 350С. В более высококипящих фракциях начинают преобладать углеводороды гибридного строения, селективность процесса разделения снижается. К соединениям включения туннельного типа относятся не только карбамидные комплексы, но и комплексы с тиомочевиной. Для комплексов с тиомочевиной характерно образование канала с большим диаметром (0,6—0,7 нм), поэтому в качестве молекул «гостя» могут выступать циклические углеводороды и алканы изостроения. К ним относятся изооктан, изопреноиды, циклогексан, алкилбензолы с разветвленными алкильными радикалами, некоторые конденсированные арены с алкильными заместителями. Нормальные алканы с длиной цепи менее 16 атомов углерода не образуют комплексов с тиомочевиной, так как молекулы этих углеводородов не способны удерживаться в канале большого диаметра за счет сравнительно слабых сил Ван-дер-Ваальса. Однако эти углеводороды с большей длиной цепи способны сворачиваться в спираль с диаметром, приблизительно соответствующим диаметру канала, и давать комплексы с тиомочевиной. Тиомочевина — менее селективный разделяющий агент, чем мочевина. Комплексообразование с тиомочевиной позволяет лишь концентрировать определенные углеводороды или группы углеводородов. Водные клатраты, или газовые гидраты, известны давно. В 1811 г. Х.Дэви открыл газовый гидрат хлора. Несколько позже были проведены первые исследования клатратных соединений углеводородных газов с водой. Газовые гидраты — это нестехиометрические соединения включения, имеющие общую формулу MnH2Q, где М — молекула гидратообразователя, а n>5,67. По внешнему виду это твердые кристаллические вещества, напоминающие снег или рыхлый лед. Однако кристаллическая решетка газовых гидратов отличается от кристаллической решетки льда стабильностью при температуре выше 0°С и наличием внутренних полостей определенных размеров, доступных для молекул ряда соединений, в частности для метана, этана, пропана, изобутана, этилена, пропилена, ацетилена. Образованием гидратов, забивающих трубопроводы и аппаратуру, может сопровождаться ряд процессов нефтедобывающей, газовой и нефтехимической промышленности. Для предотвращения возникновения гидратов и разрушения уже образовавшихся пробок можно использовать следующее методы: повышение температуры (подогрев газа горячей водой или паром); снижение давления; снижение содержания воды в газе путем осушки, вымораживания или применения специальных добавок (гликолей, спиртов), снижающих парциальное давление паров воды. Предложено использовать газовые гидраты для опреснения морской воды. Например, жидкий пропан при перемешивании с морской водой образует гидраты, а растворенные в воде соли в гидратную решетку не проникают. Другое возможное применение газовых гидратов заключается в хранении в виде гидратов природных, а также инертных газов. Контрольные вопросы
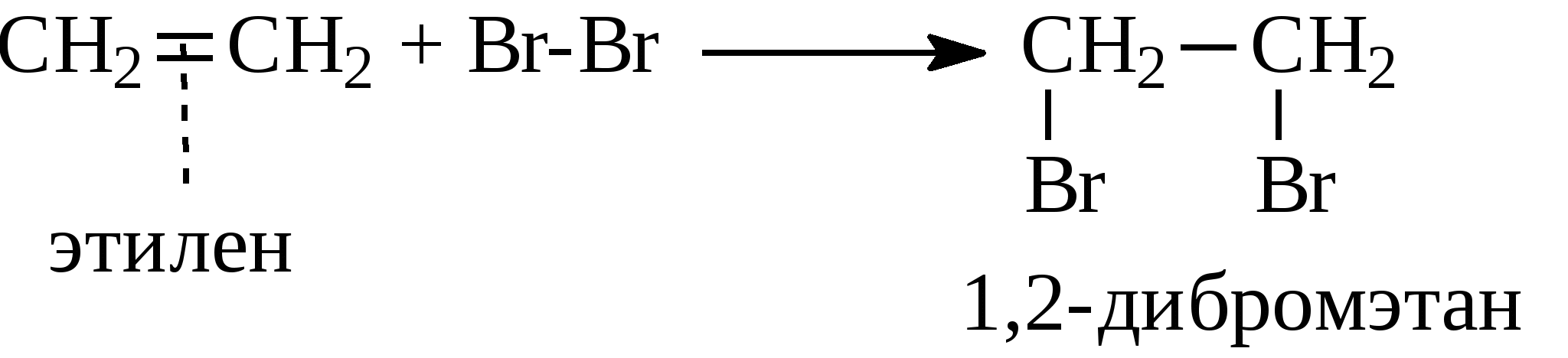
Задачи 15. Напишите структурные формулы изомерных углеводородов состава C6H14 Назовите их. Укажите изомеры, содержащие третичные атомы углерода. 16. Укажите ошибки в названиях следующих углеводородов, дайте правильные названия: а) 2-этил-6-изопропилгексан; б) 2,2-диметил-1-изопропилпентан; в) 4-изобутил-7,7-диметилоктан. 17. Напишите формулы радикалов: метила, этила, н-бутила, амила, изо-пропила, изо-бутила, втор-бутила, трет-бутила. 18. Напишите уравнения реакций последовательного окисления метана бромом и назовите все бромпроизводные. 19. При помощи каких реакций можно осуществить следующие превращения: а) б) 20. Сколько кислорода необходимо для сжигания метана: а) массой 4 г; б) количеством вещества 0,1 моль; в) объемом 10 л? 21. Объясняете сущность крекинга нефтепродуктов. В каких условиях осуществляется данный процесс? Какие углеводороды могут образоваться при крекинге октана? 22. Приведите механизм термического крекинга октадекана с указанием путей превращения образующихся свободных радикалов (диспропорционирова-ние, распад по σ-связи, соединение). 3.1.2. АЛКЕНЫ Алкены (непредельные углеводороды, олефины) – это углеводороды с открытой цепью, имеющие в молекуле двойную связь между углеродными атомами (С=С). Общая формула для этого гомологического ряда углеводородов – СnН2n. Простейшие члены ряда: СН2=СН2 этилен, этен СН2=СН-СН3 пропилен, пропен СН2=СН-СН2-СН3 бутен-1 СН3-СН=СН-СН3 бутен-2 Названия алкенов по систематической номенклатуре строятся от названий соответствующих алканов с заменой окончания -ан на -ен. Названия разветвленных алкенов образуются по тем же правилам, что и названия разветвленных алканов с той лишь разницей, что: а) за главную принимается цель, содержащая двойную связь; б) нумерация главной цепи начинается с конца, к которому ближе двойная связь; в) в названии главной цепи необходимо указать номер атома углерода, после которого находится двойная связь. Например: 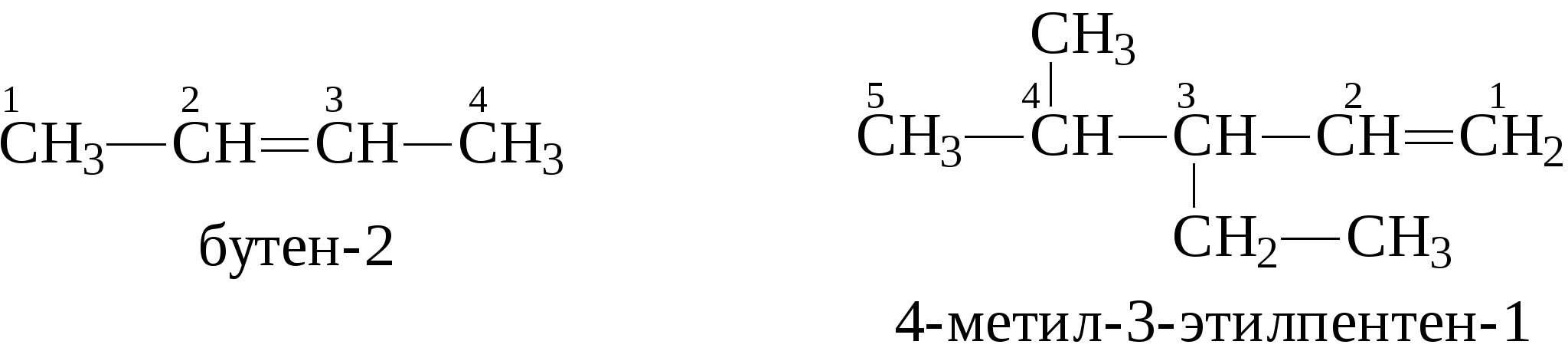 Алкены в нефтях и природных газах не содержатся. Однако в значительных количествах образуются в процессах высокотемпературной переработки нефтяного сырья, т.е. в различных процессах крекинга. В газах крекинга содержатся алкены с числом атомов углерода от 1 до 4. Содержание их в сумме в газах колеблется от 10 до 50% , а в газах процесса пиролиза (700-900°С) доходит до 80%. Жидкие продукты крекинга содержат более высокомолекулярные алкены, имеющие в молекуле 5 и более атомов углерода. Содержание алкенов в жидких продуктах крекинга составляет обычно от 5 до 45%, но может быть и выше. Источником газообразных алкенов (этилен, пропилен) для химической промышленности являются в основном газы процесса пиролиза (высокотемпературного крекинга, проводимого при температуре 700-900°С). Алкены можно также получать и другими методами, среди которых следует отметить следующие: 1. Газообразные алкены получают дегидрированием соответствующих алканов над оксидом хрома (Сr2О3) при 300°С.  2. При действии на спирты водоотнимающих средств (H2SO4, Аl2О3 и др.) при 300-400°С от спирта отщепляется молекула воды и образуется двойная связь.  3. При действии спиртовых растворов щелочей на галогенпроизводные углеводородов отщепляется галогеноводород и образуется двойная связь.  Реакционная способность алкенов превосходит реакционную способность алканов. Наиболее характерными реакциями алкенов являются реакции присоединения, при которых двойная связь раскрывается "наполовину" и идет присоединение по этой связи с образованием насыщенного соединения.
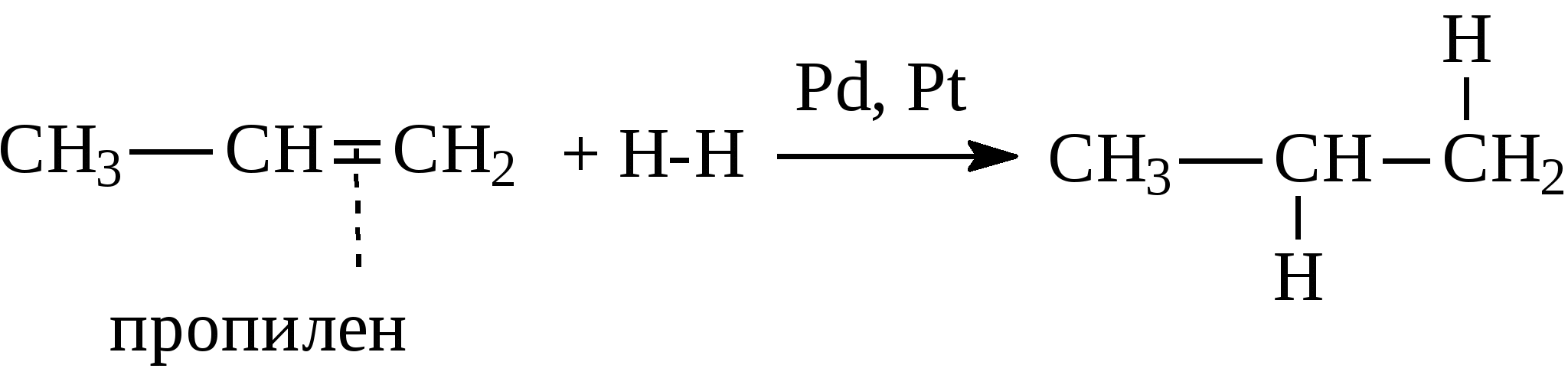
 3. Алкены реагируют с кислотами при обычных условиях. При этом идет присоединение кислоты по двойной связи (атом водорода к одному атому углерода, вся остальная часть молекулы кислоты - к соседнему атому углерода):  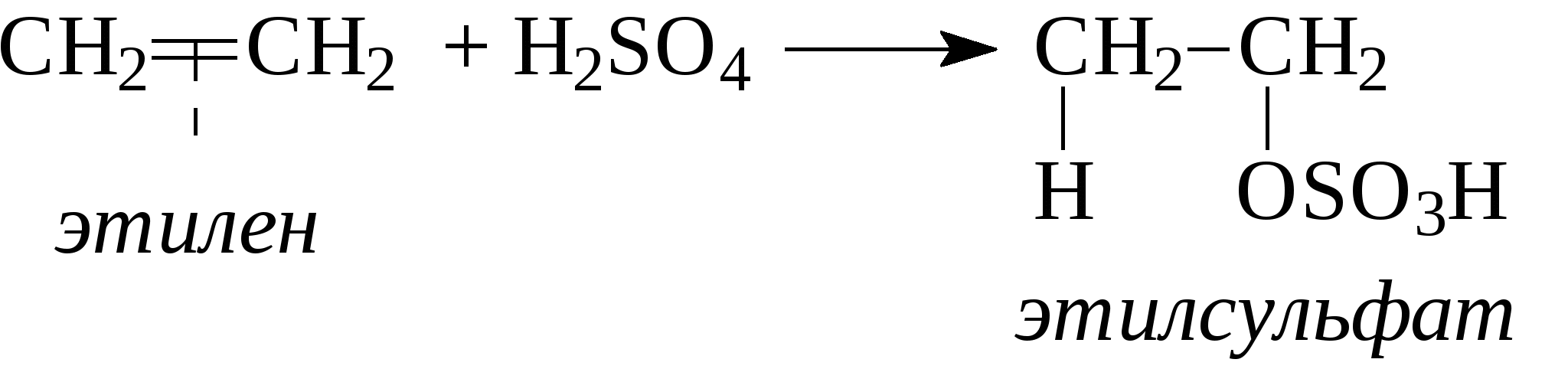 Присоединение кислот к несимметричным алкенам (например, к пропилену СН2=СН-СН3) идет по правилу Марковникова, согласно которому атом водорода от кислоты присоединяется к наиболее гидрогенизированному атому углерода при двойной связи, а вся остальная часть молекулы кислоты присоединяется к наименее гидрогенизированному атому углерода двойной связи: 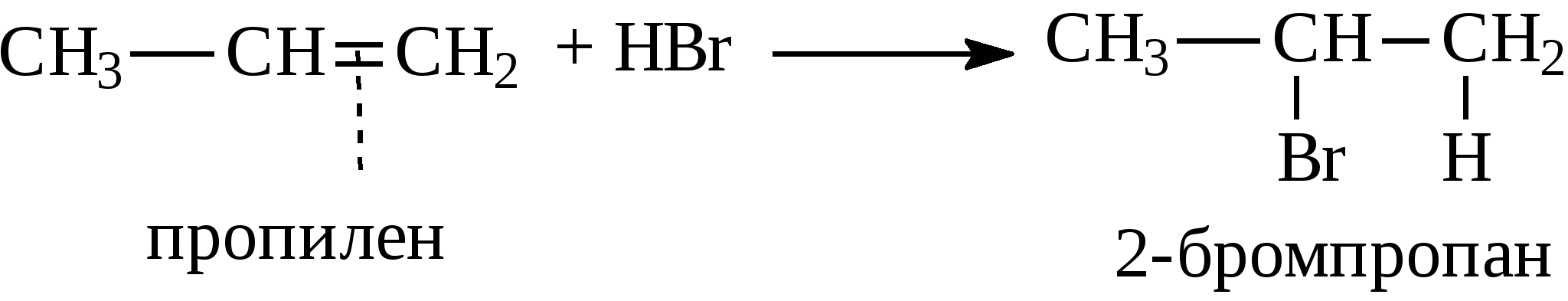 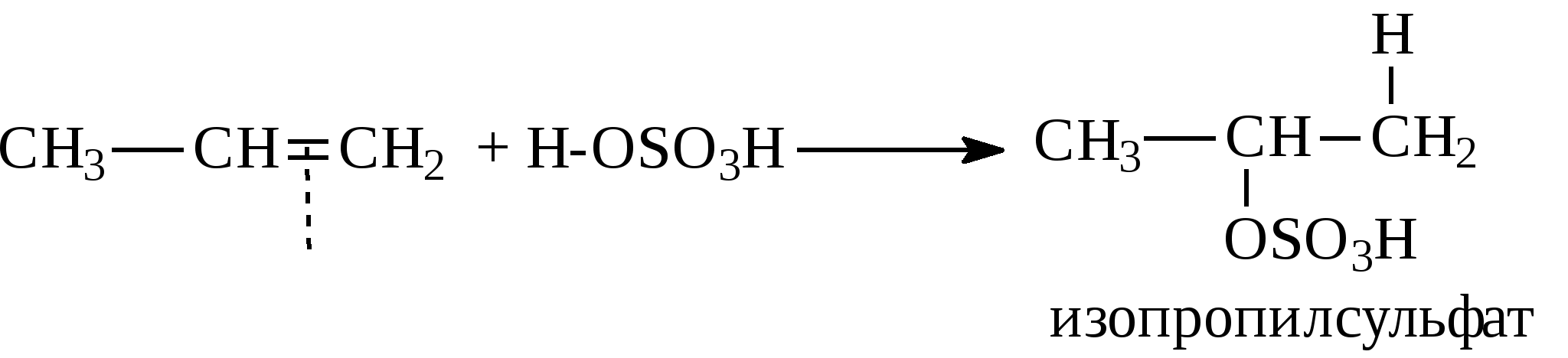 4. Гидратация алкенов протекает также с учетом правила Марковникова:  5. Окисление алкенов идет даже со слабыми окислителями, например, разбавленным раствором КМnO4 (реакция Е.Е.Вагнера): 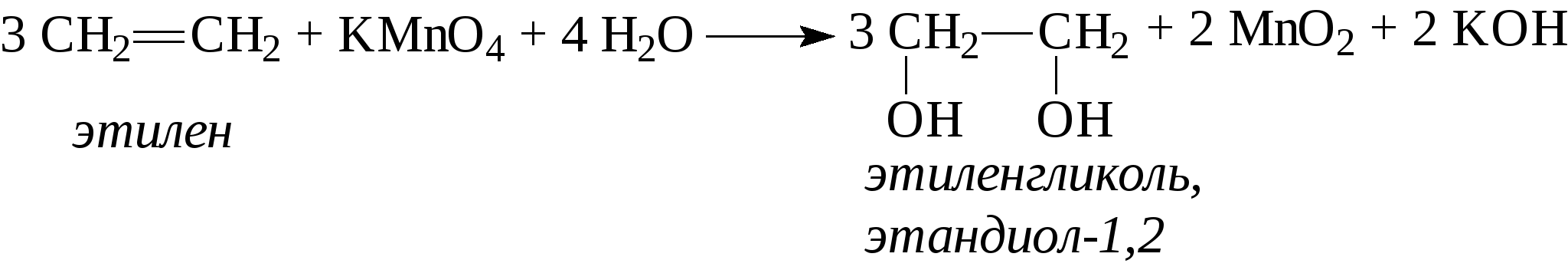 Качественная реакция на алкены - обесцвечивание водного раствора перманганата калия. При окислении сильными окислителями (например, концентрированный раствор КМnO4), окисление идет с полным расщеплением по двойной связи: 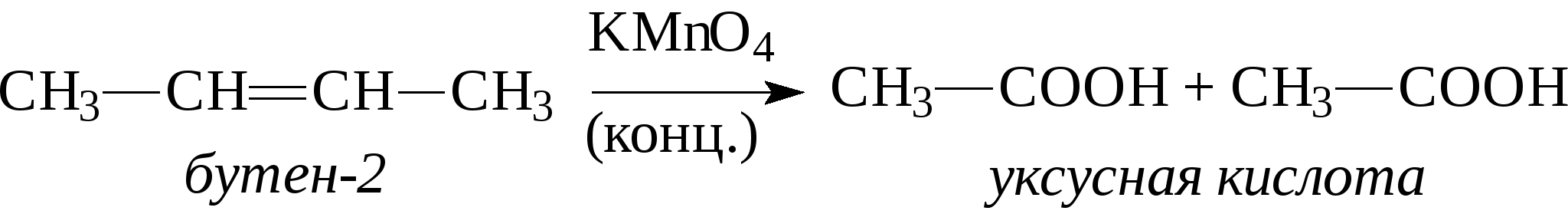 Одним из наиболее важных превращений алкенов является реакция их полимеризации. Полимеризация - это присоединение молекул алкенов (мономеров) друг к другу с образованием полимеров. Инициатором полимеризации может быть источник радикалов, облучение, давление. В общем виде полимеризация этилена выглядит следующим образом:  Получаются полимеры с молекулярной массой несколько десятков тысяч. Полиэтилен и другие полимеры находят широкое применение для изоляции кабелей; из него изготавливают трубы, шланги, пленки и многие бытовые предметы. Из-за высокой реакционной способности алкены широко используются в химической промышленности для получения большого количества ценных продуктов. Только из этилена можно получить более 500 наименований различных продуктов. С другой стороны, в нефтепродуктах алкены являются нежелательным компонентом, т.к. легко окисляются с образованием смол, что понижает стабильность нефтепродуктов к окислению при их хранении. Содержание ненасыщенных соединений в нефти и продуктах её переработки оценивают бромным или йодным числом. Бромным или йодным числом называется количество граммов брома (йода), присоединившееся к 100 г исследуемого вещества. Определение бромного (йодного) числа в общем виде заключается в проведении реакции галогенирования с последующим титрованием тиосульфатом натрия не вошедшего в реакцию галогена. Параллельно в холостом опыте оттитровывается взятое в реакцию количество галогена. Таким образом, по разности между холостым и целевым опытами узнается количество вошедшего в реакцию галогена. (Об определении бромного и йодного чисел см. раздел 2.7). Контрольные вопросы
Задачи 23. Напишите структурные формулы изомерных ациклических углеводородов состава С6Н12. Назовите их. 24. Какие олефины могут быть получены при дегидрировании: а) изобутана; б) диметилэтилметана; в) 2-метилпентана; г) пропана? Напишите их структурные формулы. 25. Какие углеводороды и в каком количестве получаются при дегидратации 10 кг: а) этилового спирта; б) пропилового спирта? 26. Сколько и каких углеводородов получится при взаимодействии спиртового раствора гидроксида натрия с массовой долей NaOH 40% объемом 500 мл (пл. 0,7 г/мл) на галогенопроизводные: а) 1-хлорпропан; б) 2-хлорбутан? 27. Сколько граммов брома могут присоединить: а) бутен-2 массой 2,8 г; б) α,β-метилэтилэтилен массой 3,5 г; в) несимм-метилпропилэтилен массой 4,2 г? Каковы их бромные числа? 28. Напишите формулы геометрических изомеров: а) бутена-2; б) пентена-2; в) 2,5-диметилгексена-3; г) 3-метилпентена-2. 29. Напишите уравнения внутримолекулярной дегидратации следующих спиртов: Назовите образующиеся углеводороды. 30. Получите 4-метилпентен-2 из 4-метилпентена-1 и окислите концентрированным раствором КМnO4. Напишите уравнения реакций. 31. Сколько граммов галогенопроизводного образуется в результате взаимодействия пропилена объемом 1,12 л с хлороводородом? Выразите реакцию в структурных формулах, учитывая правило Марковникова. 3.1.3. ДИЕНЫ Диены (диеновые углеводороды) – углеводороды, которые имеют в молекуле две двойные связи. Общая формула гомологического ряда диеновых углеводородов СnН2n-2. В зависимости от взаимного расположения двойных связей диеновые углеводороды можно разделить на три основных типа: – углеводороды с кумулированными (примыкающими к одному атому углерода) двойными связями (их часто называют алленовыми): СН2=С=СН2 аллен, пропадиен СН3-СН=С=СН2 бутадиен-1,2 – углеводороды с сопряженными двойными связями: СН2=СН-СН=СН2 бутадиен-1,3 , дивинил  2-метил-бутадиен-1,3, изопрен 2-метил-бутадиен-1,3, изопрен – углеводороды с изолированными двойными связями: СН2=СН-СН2-СН2-СН=СН2 гексадиен-1,5 Названия диеновых углеводородов строятся от названия соответствующих алканов с заменой окончания -ан на -диен, с указанием номеров атомов углерода в цепи, после которых расположены двойные связи. Наибольшего внимания заслуживают диеновые углеводороды с сопряженными двойными связями. Из способов получения диеновых углеводородов отметим только два.
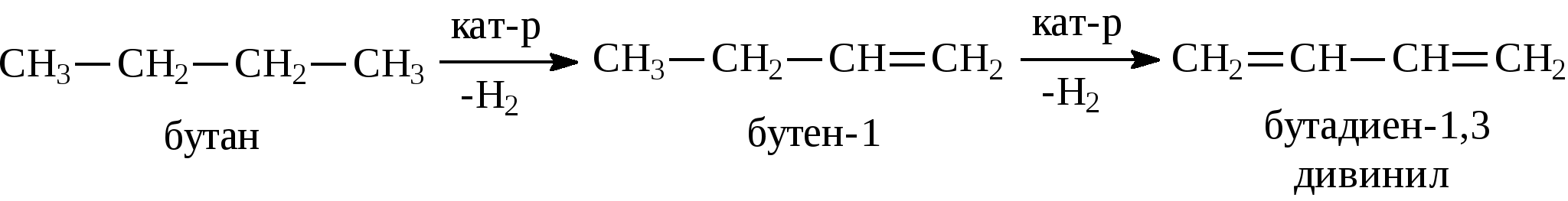 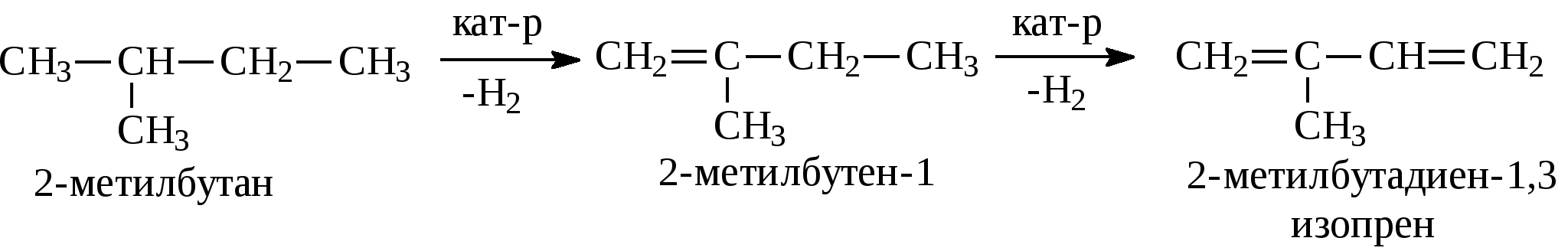 2. Очень большую роль в промышленном производстве дивинила сыграл метод С.В.Лебедева. Пары этилового спирта пропускают над дегидратирующим и дегидрирующим катализатором при 400-500°С, в результате чего получается дивинил: 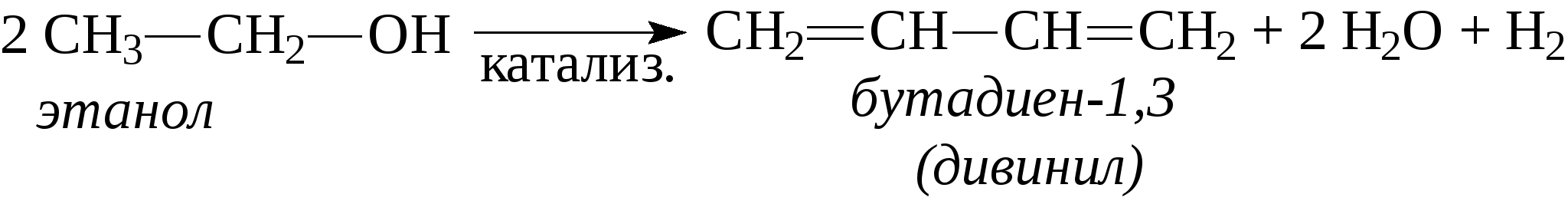 По своим химическим свойствам диены похожи на алкены. Диеновые углеводороды с сопряженными связями вступают в обычные реакции присоединения, характерные для этиленовых углеводородов, т.е. они могут присоединять водород, галогены, галогеноводороды и др., при этом диены могут присоединять одну или две молекулы реагента. В случае диенов с сопряженными двойными связями присоединение может идти в положение 1,2 или в положение 1,4. 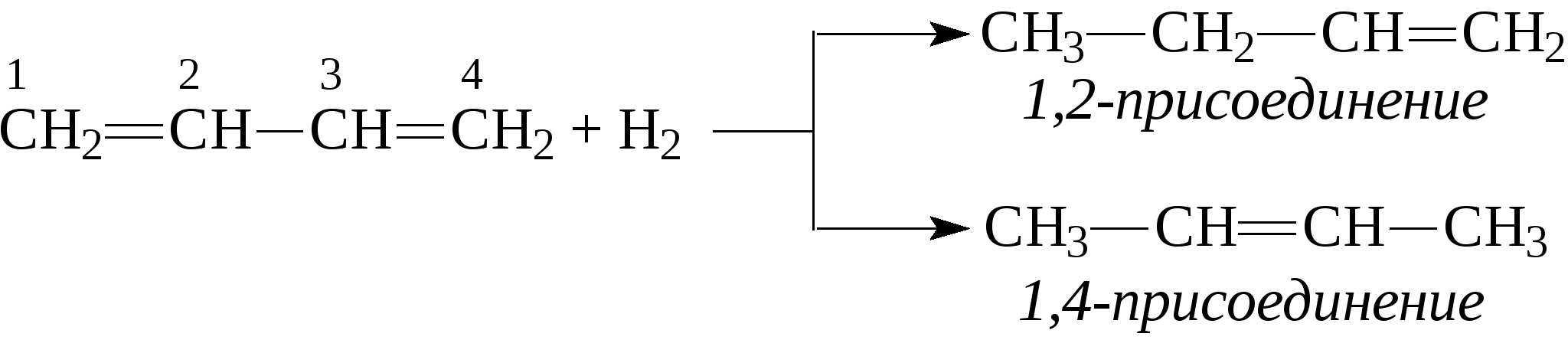 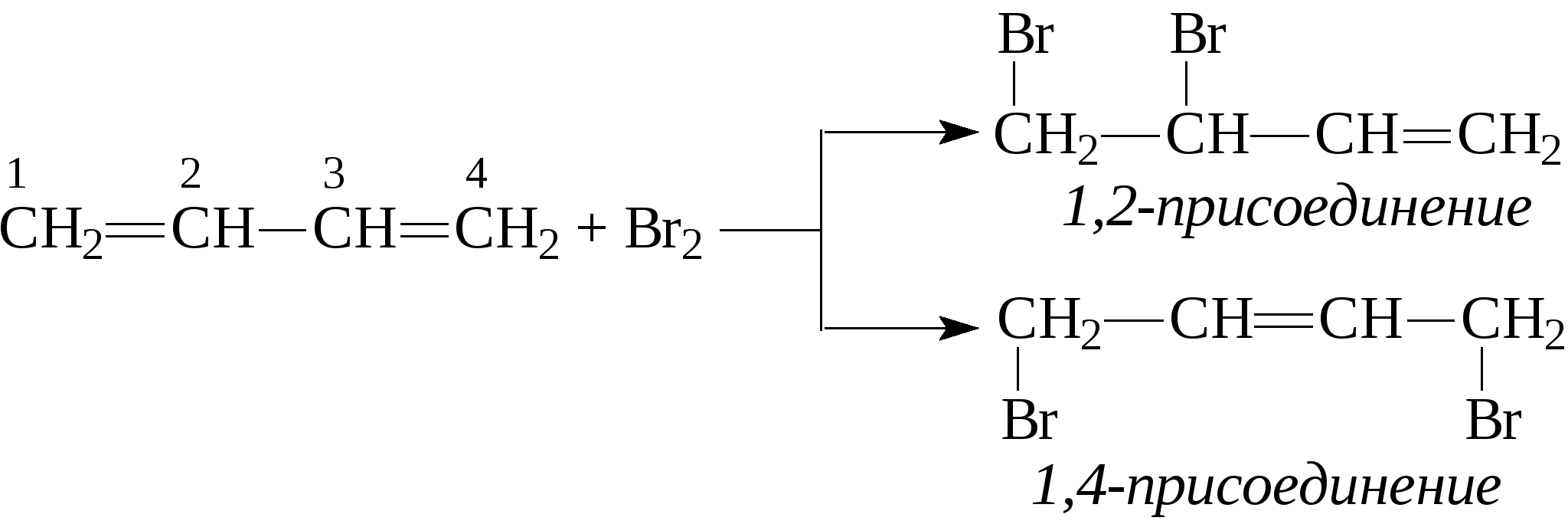 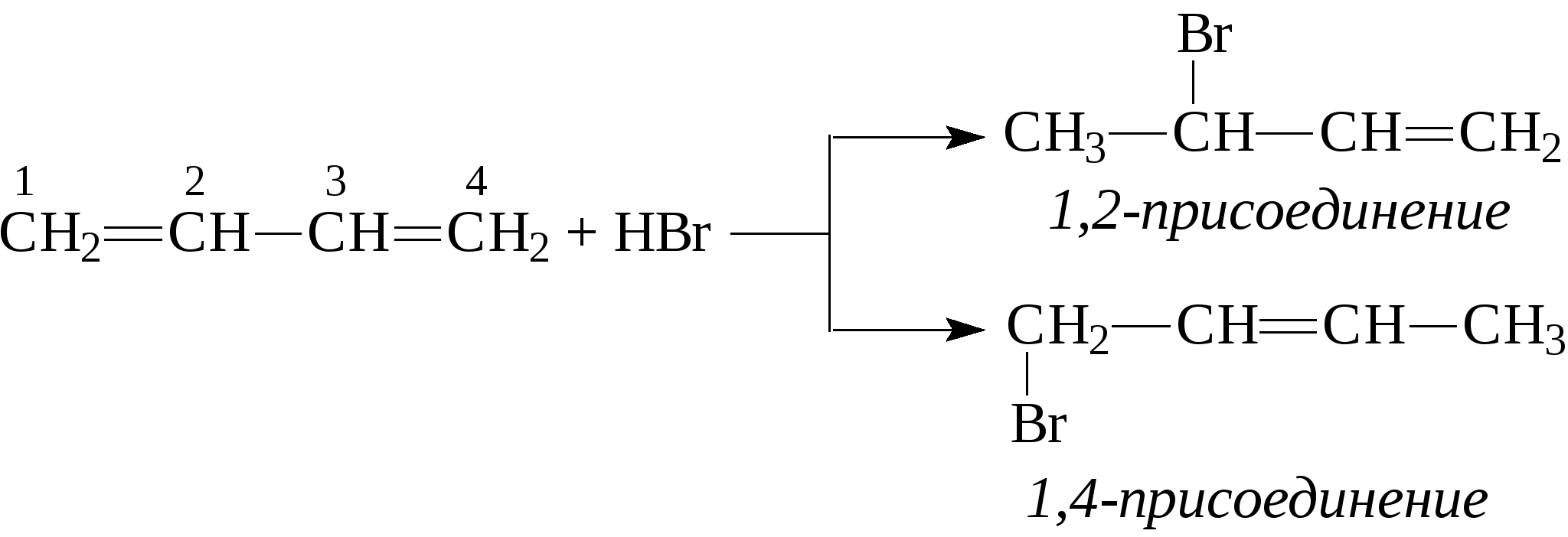 Важным свойством сопряженных диеновых углеводородов является их способность к полимеризации с образованием высокомолекулярных полимеров (каучуков): -СН2-СН=СН-СН2-СН2-СН=СН-СН2-СН2-СН=СН-. Большое значение имеет сополимеризация диеновых углеводородов с другими мономерами, например, стиролом, акрилонитрилом и т.д. В настоящее время на практике применяют синтетические каучуки, получаемые полимеризацией дивинила, изопрена или сополимеризацией этих диеновых углеводородов со стиролом, акрилонитрилом или другими непредельными соединениями. Контрольные вопросы
Задачи 32. Напишите структурные формулы: а) 2-метилбутадиена-1,3; б) 2-метил-гексадиена-1,5; в) 2,4-диметилпентадиена-2,4; г) 2 - метилпентадиена-1,3. 33. Назовите углеводороды: 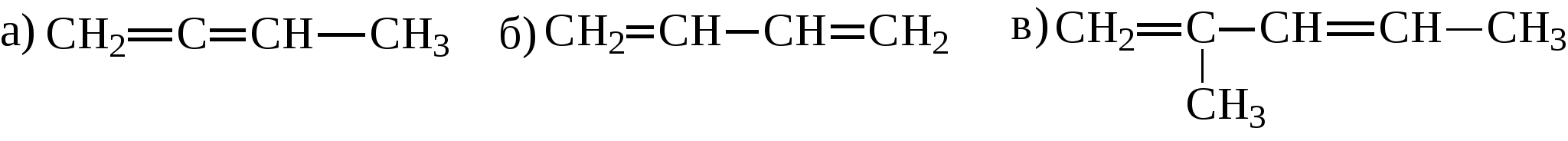 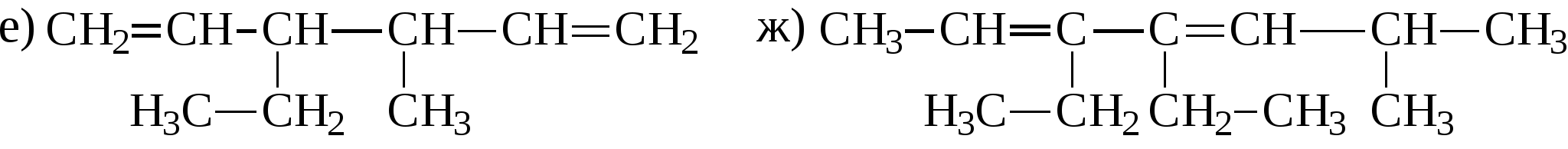 34. Напишите структурные формулы изомерных диеновых углеводородов C5H8. Назовите их. Обратите внимание на цис-транс-изомерию. 35. Напишите схему получения хлоропрена из ацетилена. 36. Напишите уравнения взаимодействия 2-метилпентадиена-1,3: а) с бромом; б) с бромоводородом. 37. Напишите все возможные изомеры, получающиеся при присоединении одной молекулы НВr: а) к хлоропрену; б) к изопрену. Условия и катализаторы самые разнообразные. 38. Напишите схему цепной полимеризации хлоропрена. Покажите механизм радикальной и ионной полимеризации. 39. Приведите схему технического получения дивинила по способу Лебедева. Укажите условия реакции. 40. Получите дивинил и изопрен дегидрогенизацией соответствующих смесей предельных и этиленовых углеводородов. 41. Предложите схему получения изопрена из пентановой фракции нефти. 3.1.4. АЛКИНЫ Алкины (ацетиленовые углеводороды). Это углеводороды, в молекулах которых присутствует тройная связь (СС). Общая формула гомологического ряда алкинов СnН2n-2. Родоначальником ряда является ацетилен НСCH. Простейшие представители этого ряда алкинов: CH3-CCH метилацетияен, пропин CH3-СН2-CCH этилацетилен, бутин-1 CH3-CC-СН3 диметилацетилен, бутин-2 Названия ацетиленовых углеводородов строятся от названий соответствующих алканов с заменой окончания -ан на -ин. Далее - подобно правилам образования названий алкенов: а) за главную принимается цепь, содержащая тройную связь; б) нумерация главной цепи начинается с конца, к которому ближе тройная связь; в) в названии главной цепи необходимо указать номер атома углерода, после которого находится тройная связь. Например: 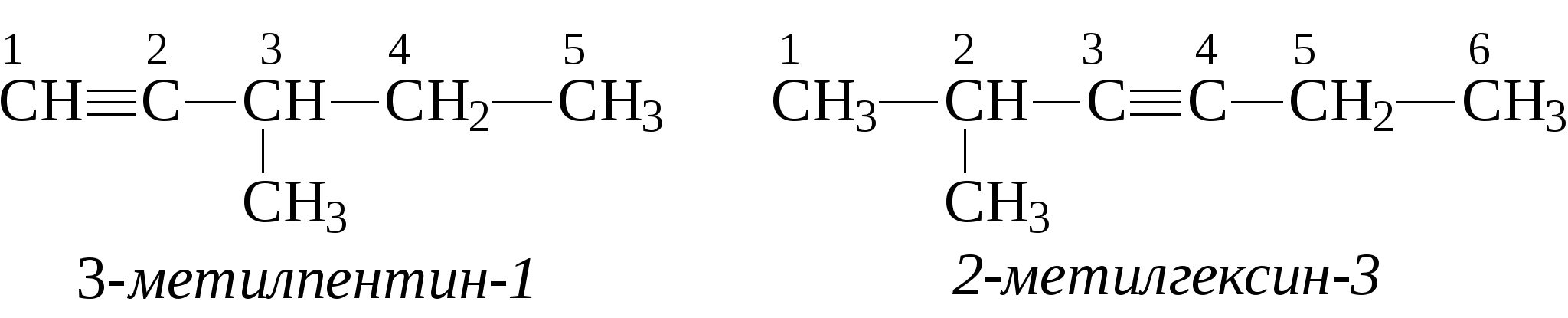 В нефтях и природных газах ацетиленовые углеводороды не содержатся. Ацетилен (до 1%) может присутствовать в газах процесса пиролиза (700-900°С). Синтетические методы получения ацетиленовых углеводородов следующие: 1. Действием воды на карбид кальция (СаС2) получают ацетилен: 2. Также в промышленности ацетилен получают пиролизом метана (СН4) при 1200-1500С : 3. Ацетилен и его гомологи получают действием спиртового раствора щелочи на дигалогенпроизводные углеводородов: 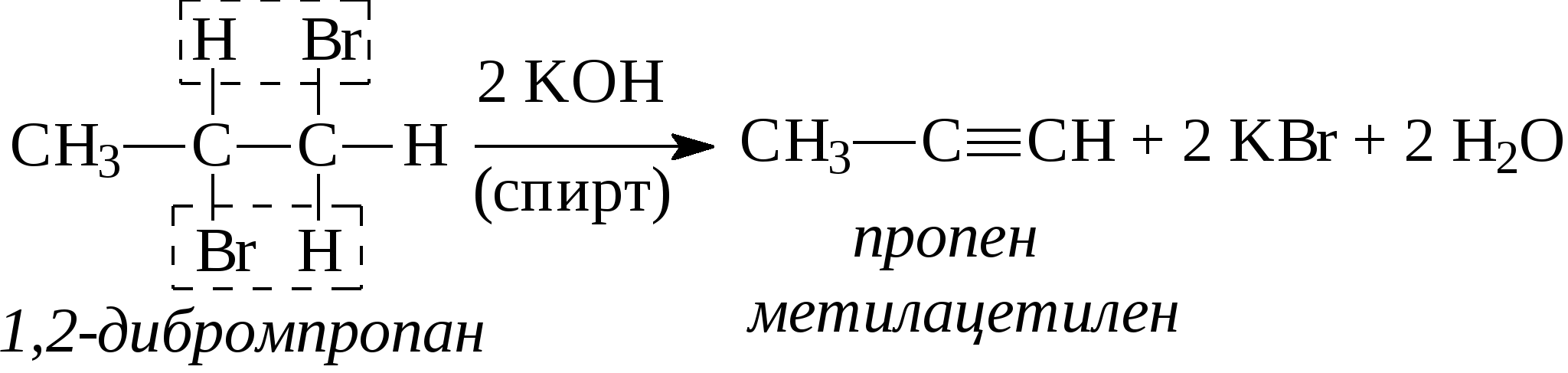  Для алкинов, также как для алкенов, характерны реакции присоединения. Однако у алкинов после присоединения первой молекулы реагента остается еще двойная связь, которая может присоединить еще одну молекулу реагента. Это видно на примере следующих реакций:
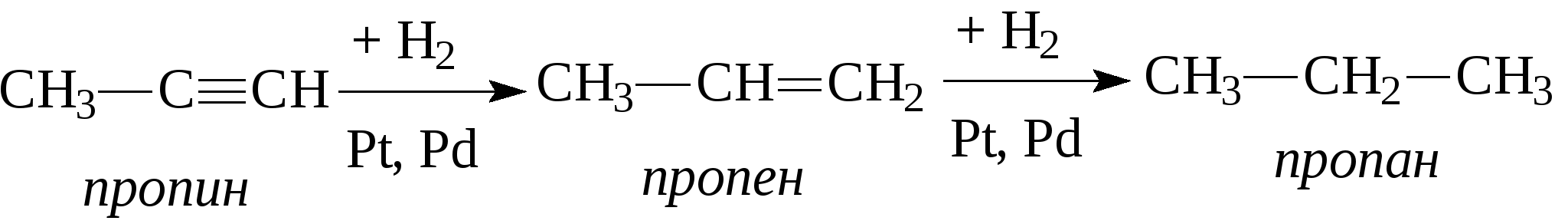
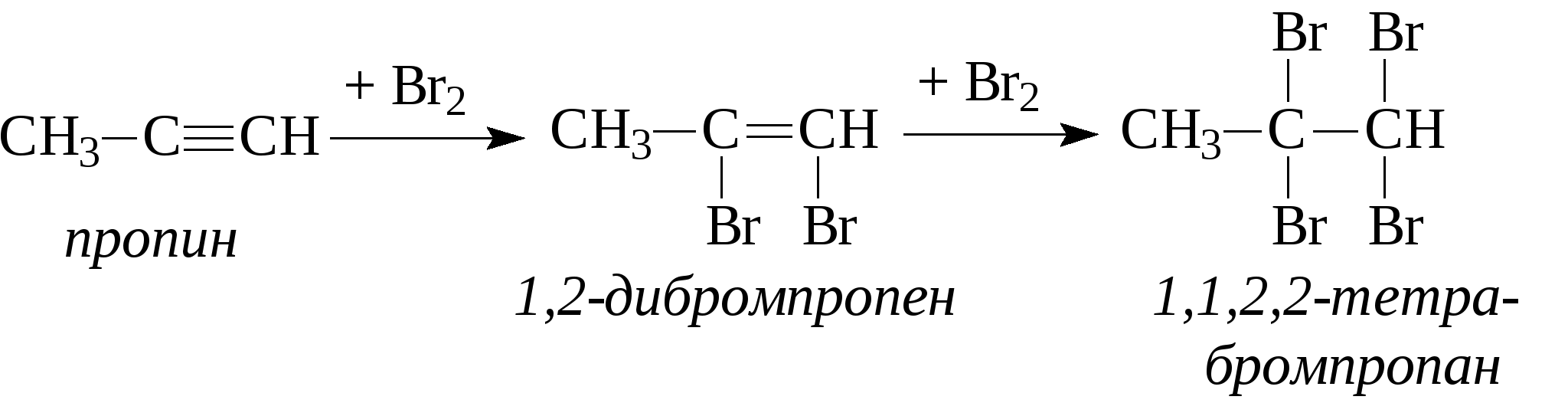
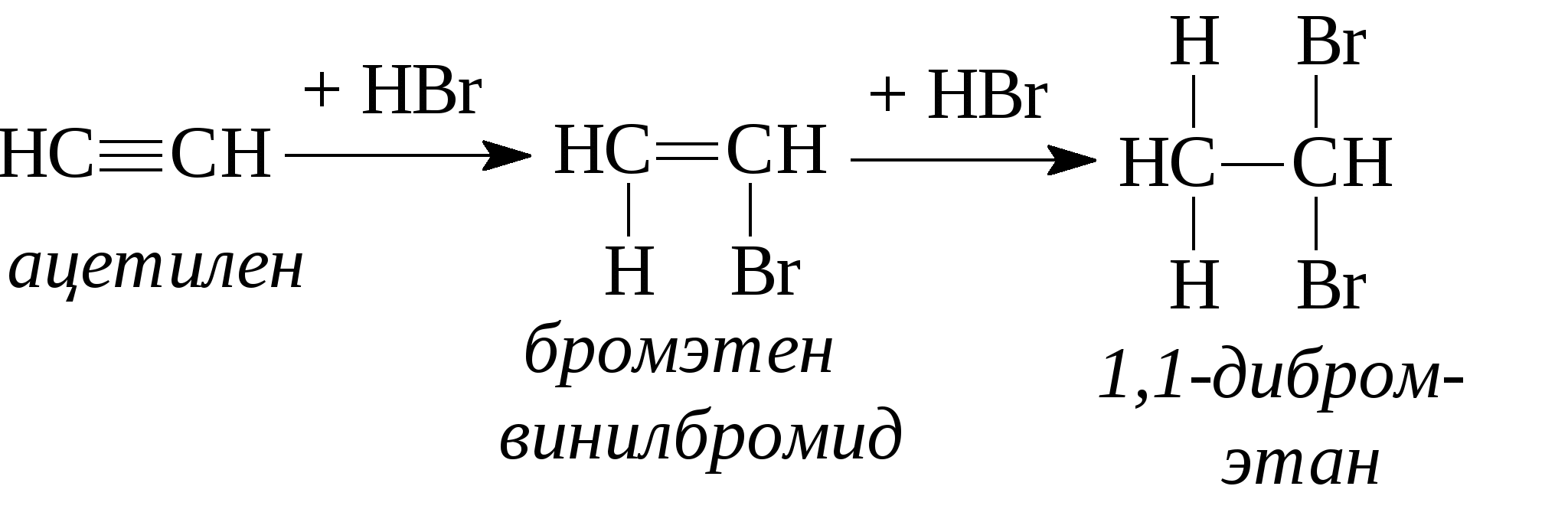 При присоединении второй молекулы галогеноводорода, водород всегда идет к наиболее гидрогенизованному атому углерода. При присоединении к несимметричным алкинам галогенводорода также соблюдается правило Марковникова - водород идет к более гидрогенизованному атому углерода.  4. Присоединение воды (реакция Кучерова). Молекула воды присоединяется к ацетиленовым углеводородам в присутствии солей двухвалентной ртути в сернокислом растворе. При этом из ацетилена получается уксусный альдегид, из гомологов ацетилена - кетоны:  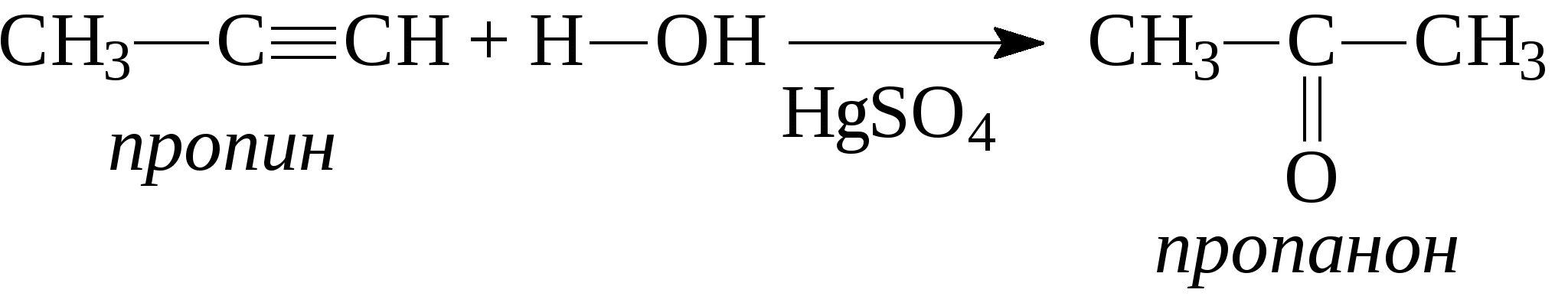 Кроме того, для ацетиленовых углеводородов характерным свойством является способность замещать на металлы атомы водорода, находящиеся при атомах углерода тройной связи. При этом получаются ацетилениды: 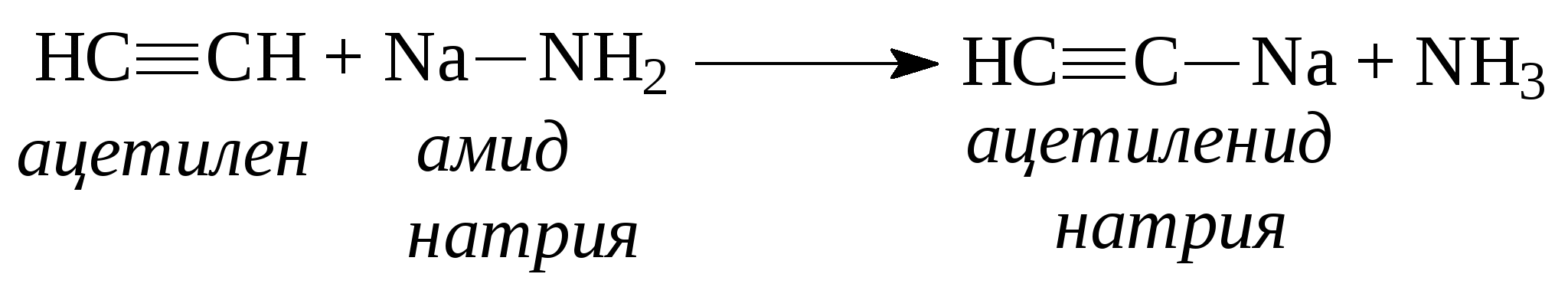 Также как и алкены, ацетиленовые углеводороды способны к полимеризации. Например, при пропускании ацетилена через кислые растворы NH4Cl из двух молекул ацетилена образуется винилацетилен (реакция димеризации), который используется для синтеза каучука. 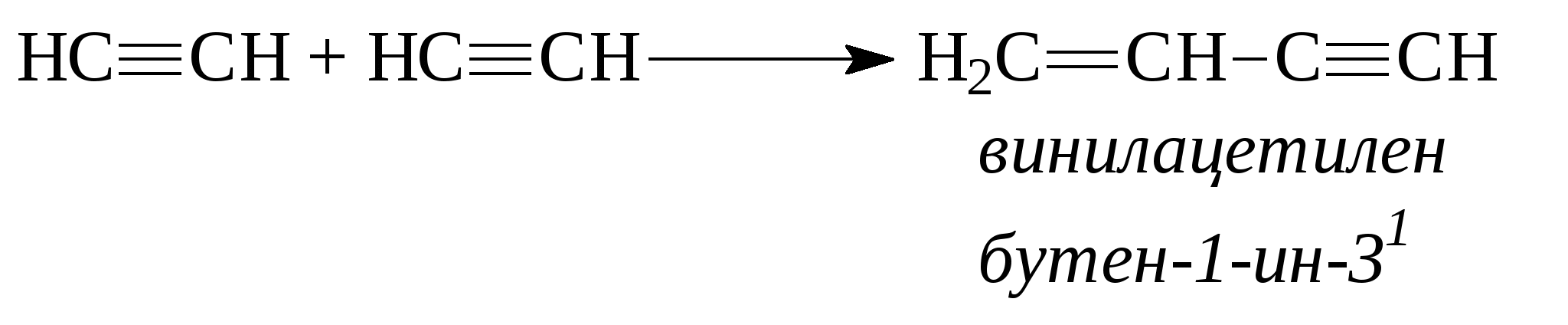 3 3При пропускании ацетилена над активированным углем при температуре 600°С из трех молекул ацетилена получается бензол (реакция тримеризации).  Контрольные вопросы
Задачи
3.1.5. Практикум Лабораторная работа 4. Методы получения и химические свойства ациклических углеводородов (алканы, алкены, алкины) Алканы Опыт 1. Получение и свойства метана В ступке растирают одну часть ацетата натрия (CH3COONa) с двумя частями натронной извести (NaOH). Смесь пересыпают в сухую пробирку с газоотводной трубкой и нагревают сначала осторожно, а затем сильно. Через 1-2 мин поджигают выходящий из трубки метан. Он сгорает голубоватым пламенем:  Чтобы убедиться в том, что метан трудно вступает в химические реакции, его пропускают в пробирки, наполненные раствором перманганата калия и бромной водой. Окраска растворов при этом не изменяется, так как в обычных условиях метан не окисляется и не вступает в реакции замещения. Опыт 2. Свойства жидких метановых углеводородов В качестве примера жидких метановых углеводородов берут н-гексан С6Н14 и наблюдают, как он реагирует при обычных условиях с галогенами, кислотами и окислителями. В четыре пробирки наливают по 1 мл н-гексана. В первую пробирку к н-гексану прибавляют 0,5 мл бромной воды. Обесцвечивания не происходит, т.е. в обычных условиях н-гексан с бромом не реагирует. Во вторую пробирку к н-гексану приливают 0,5 мл конц. H2SO4, а в третью - 0,5 мл конц. НNО3. Содержимое пробирок встряхивают. Наблюдения показывают, что н-гексан не изменяет окраску, не происходит смешения слоев и разогрева. Таким образом, можно сделать вывод, что н-гексан при нормальных условиях не реагирует с концентрированными кислотами (Н2SO4 и НNО3). В четвертую пробирку к 1 мл н-гексана приливают 1 мл раствора перманганата калия (КМnО4). После встряхивания содержимого пробирки отмечают, что изменений не происходит, раствор не обесцвечивается, т.е. реакция не идет. Опыт 3. Качественная проба на присутствие в нефтяной фракции нормальных парафиновых углеводородов Готовят насыщенный раствор мочевины в воде или метаноле, предварительно перегнанном над едким натром. На 100 г метанола требуется 20—32 г мочевины. Избыток мочевины отфильтровывают, раствор хранят в склянке с корковой пробкой. В пробирку наливают 1 мл раствора мочевины, прибавляют 2—3 капли испытуемого раствора и пробирку встряхивают. Выпадающий белый кристаллический осадок указывает на наличие нормальных парафиновых углеводородов. Одновременно проводят холостой опыт. Чувствительность пробы около 0,3% нормальных парафинов в смеси. Метод пригоден и для количественного определения или отделения алканов от нафтеновых, ароматических и разветвленных парафиновых углеводородов. Алкены Опыт 4. Получение и свойства этилена В пробирку с газоотводной трубкой помещают 1 мл этилового спирта и, осторожно взбалтывая, приливают 4 мл концентрированной серной кислоты. В разогревшуюся смесь бросают кипелку и начинают медленно и осторожно нагревать пробирку до начала равномерного выделения газа. Реакционная смесь при этом темнеет: 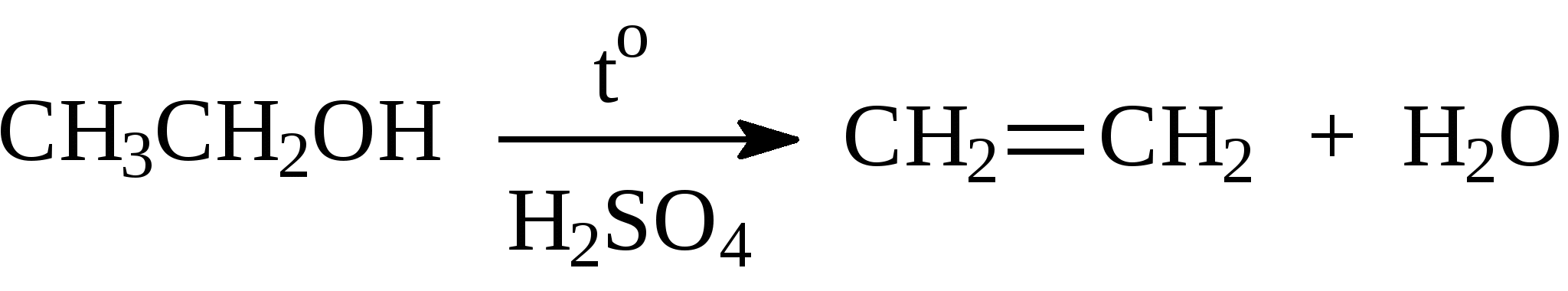 Заранее готовят две пробирки, заполненные на 2/3 объема бромной водой и раствором перманганата калия. Как только из газоотводной трубки начинает выделяться этилен, опускают поочередно газоотводную трубку в эти пробирки. Непредельный характер этилена проявляется в быстроте его бромирования и окисления. Бромная вода обесцвечивается, так как бром присоединяется к этилену: При окислении этилена раствором перманганата калия образуется этиленгликоль, в результате чего также происходит обесцвечивание раствора: Эти две реакции (обесцвечивание бромной воды и раствора перманганата калия) используют как качественные реакции, позволяющие обнаруживать непредельные углеводороды в нефтепродуктах. Затем, не прекращая нагревания пробирки со смесью спирта и кислоты, газоотводную трубку поворачивают отверстием вверх и поджигают выделяющийся этилен. Этилен горит более ярким пламенем, чем метан. Опыт 4. Свойства жидких алкенов Для исследования свойств жидких алкенов возьмем гексен-1 (СН2=СН-СН2-СН2-СН2-СН3) и посмотрим, как он реагирует с кислотами и галогенами. В две пробирки наливают по 1 мл гексена-1. В первую пробирку добавляют 1 мл бромной воды и встряхивают содержимое пробирки, при этом наблюдается исчезновение окраски, т.е. гексен-1 прореагировал с бромом: Во вторую пробирку к гексену-1 добавляют 1 мл конц. H2SО4 и осторожно встряхивают. Наблюдается разогревание смеси в пробирке и полное смешение слоев. Получается алкисерный эфир, растворимый в серной кислоте. Опыт 5. Определение двойной связи в сложных соединениях В пробирку внести 1 мл водного раствора перманганата калия. Затем прикапать 4-5 капель насыщенного спиртового раствора транс-стильбена (1,2-дифенилэтилена), хорошо встряхнуть и наблюдать обесцвечивание раствора. Записать уравнение реакции. Алкины Опыт 6. Получение и свойства ацетилена В сухую пробирку помещают кусочки карбида кальция, затем прикапывают несколько капель воды и быстро закрывают пробирку пробкой с газоотводной трубкой. В пробирке наблюдается вспенивание за счет выделения газа. Повернув газоотводную трубку вверх, подожгите выделяющийся газ. Ацетилен на воздухе горит коптящим пламенем. Затем опустите газоотводную трубку в пробирки с заранее приготовленными растворами бромной воды и перманганата калия. Наблюдается обесцвечивание растворов: 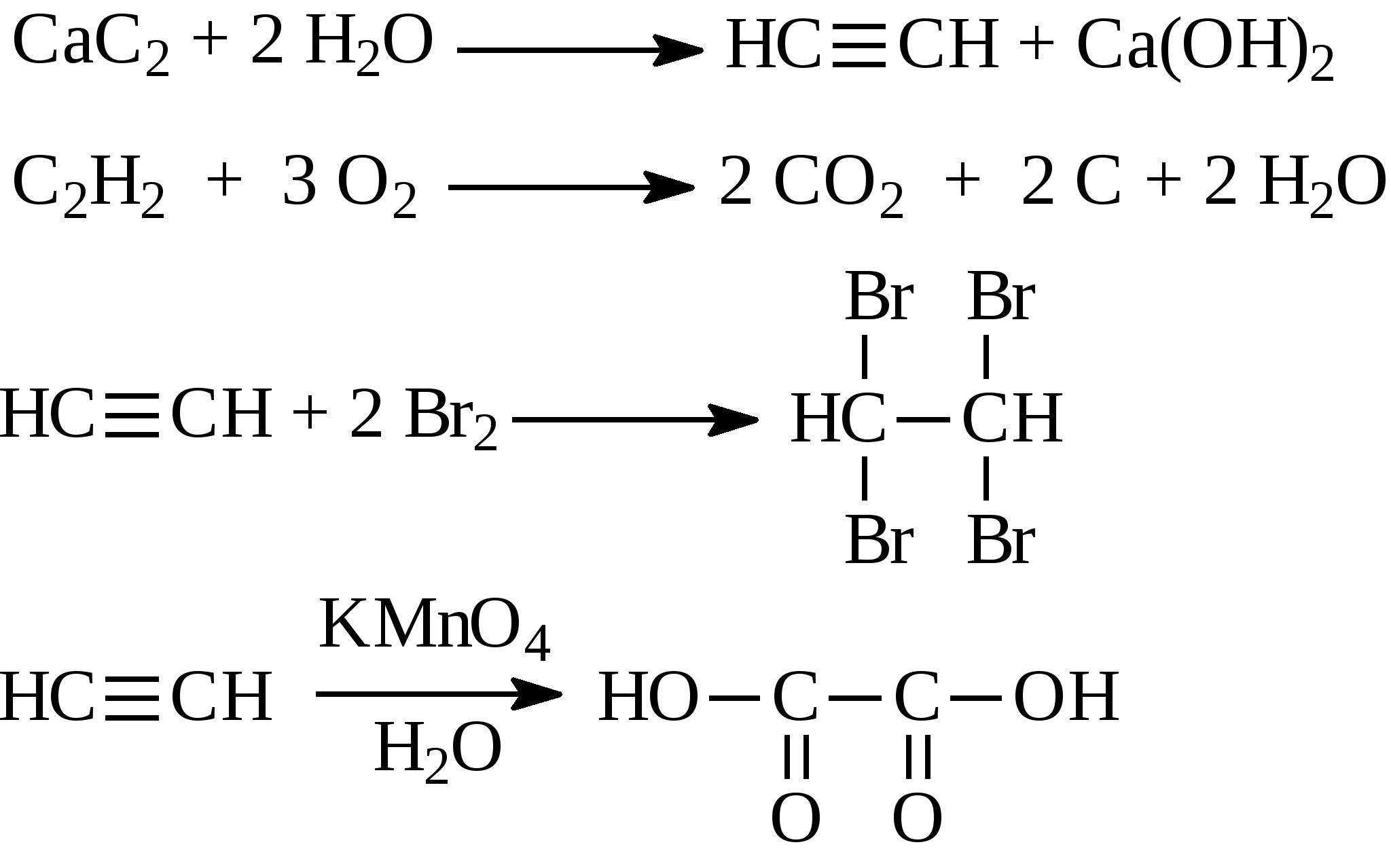 3.2. ЦИКЛИЧЕСКИЕ УГЛЕВОДОРОДЫ 3.2.1. Алициклические углеводороды (нафтены) Общая формула нафтенов СnН2n. Их называют еще циклопарафиновые углеводороды, циклоалканы, полиметиленовые углеводороды или нафтеновые углеводороды. 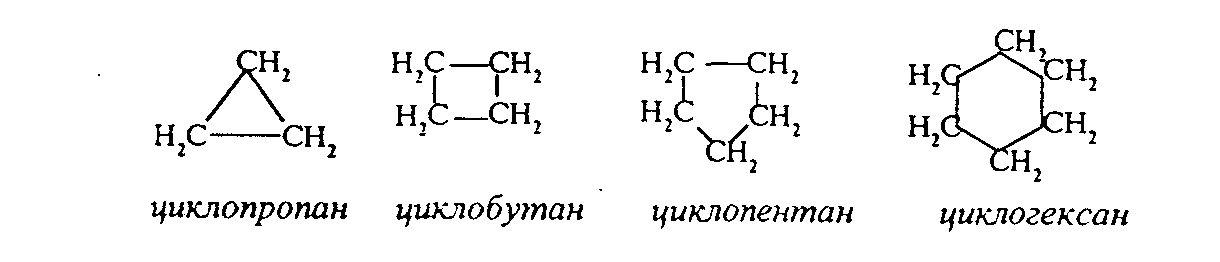 Названия циклоалканов образуют добавлением префикса цикло- к названию соответствующего алкана. Названия гомологов циклоалканов образуют следующим образом: 1) при наличии одного заместителя в цикле - сначала называется заместитель, затем называется кольцо. Например: 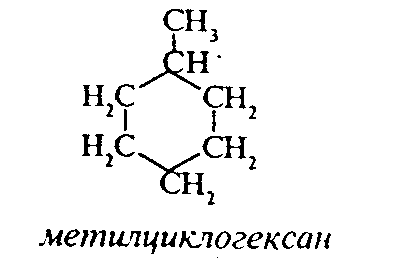 2) при наличии нескольких заместителей в цикле необходимо пронумеровать атомы углерода, образующие цикл. Нумерация начинается от одного из атомов углерода кольца, связанных с заместителем, и направление нумерации выбирается так, чтобы заместители получили наименьшие коэффициенты. Например: 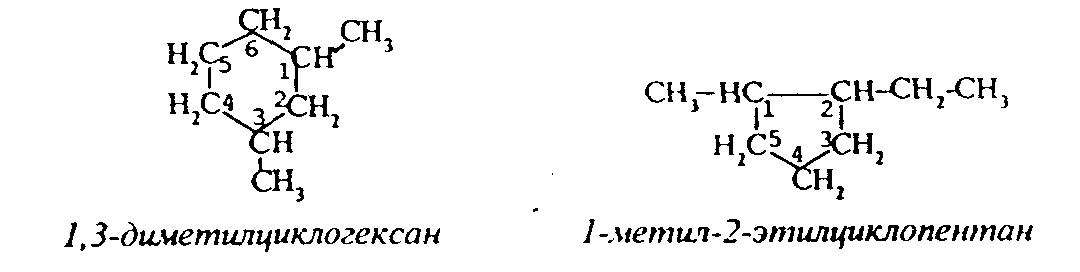 Природными источниками этих углеводородов являются нефти. Впервые этот класс углеводородов был открыт в нефтях в 1881 году В.В. Марковниковым, который и назвал их нафтеновыми углеводородами. Однако необходимо иметь в виду, что в нефтях не найдено циклопропановых и циклобутановых углеводородов, а содержатся в основном пятичленные и шестичленные структуры, т.е. углеводороды с циклопентановыми и циклогексановыми кольцами. Содержание нафтеновых углеводородов в различных нефтях колеблется от 40 до 70%. Циклопарафиновые углеводороды могут быть получены также синтетическими методами. Циклопропан и его гомологи могут быть получены нагреванием ди-галогенпроизводных с цинковой пылью: 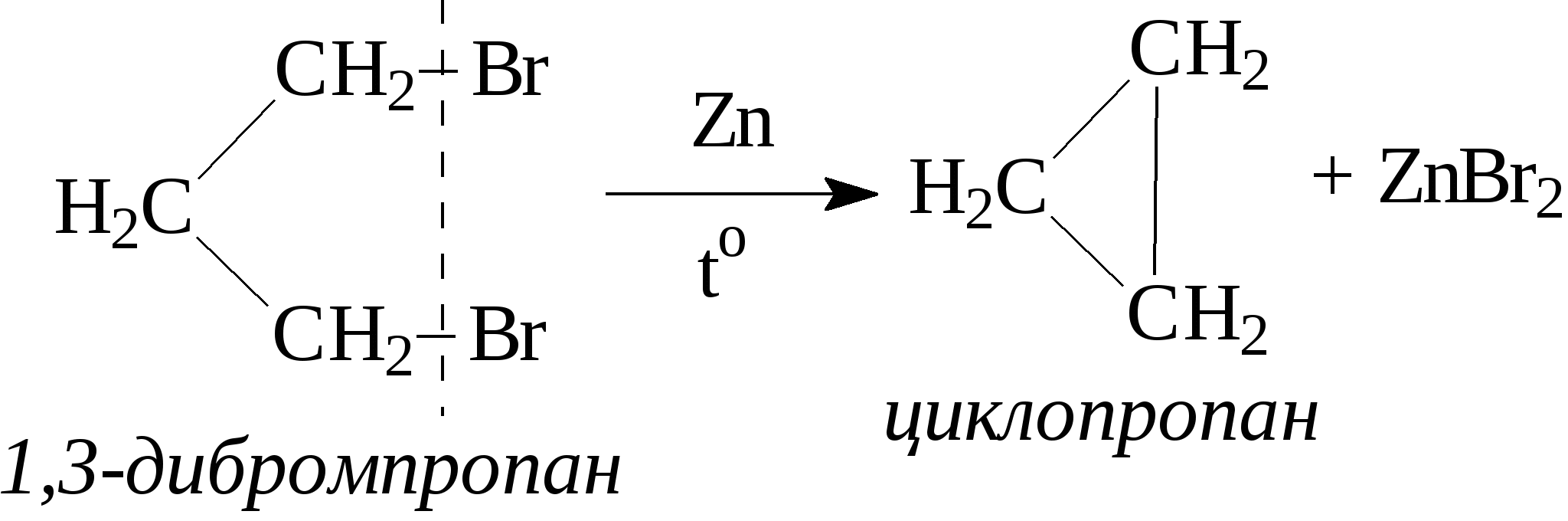 Циклогексан и его гомологи могут быть получены гидрированием бензола и его гомологов: 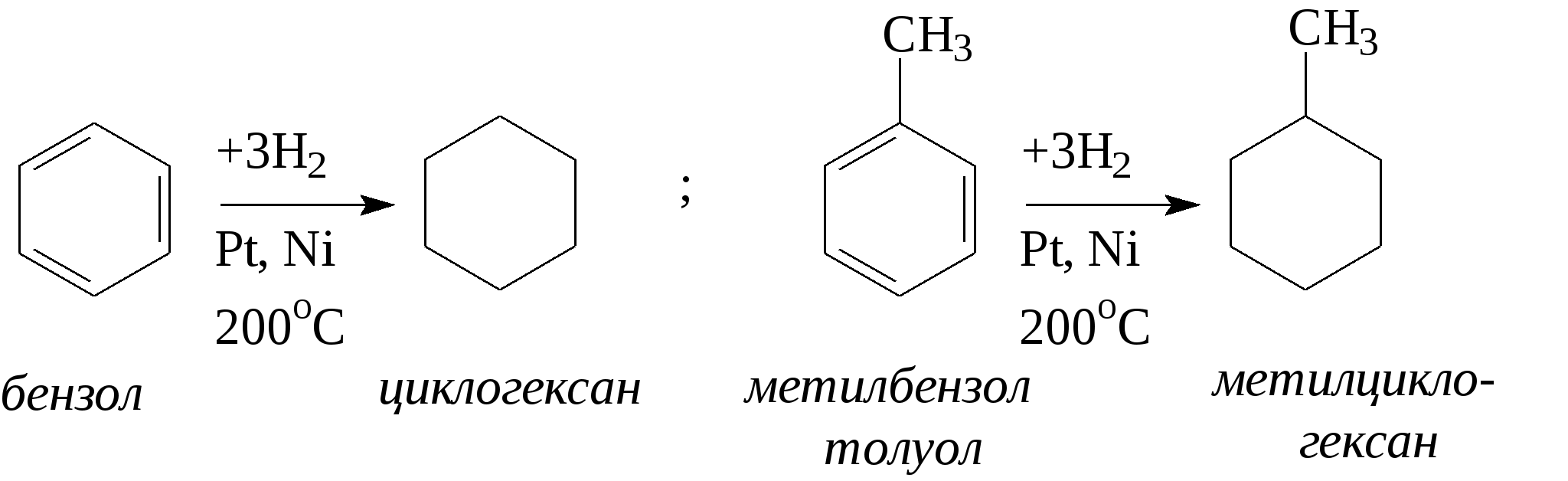 За исключением циклопропана и циклобутана циклоалканы по реакционной способности очень похожи на алканы. Трехчленные и четырехчленные кольца отличаются малой устойчивостью и при действии на них различных реагентов в обычных условиях легко разрываются с присоединением реагентов по концевым атомам углерода: 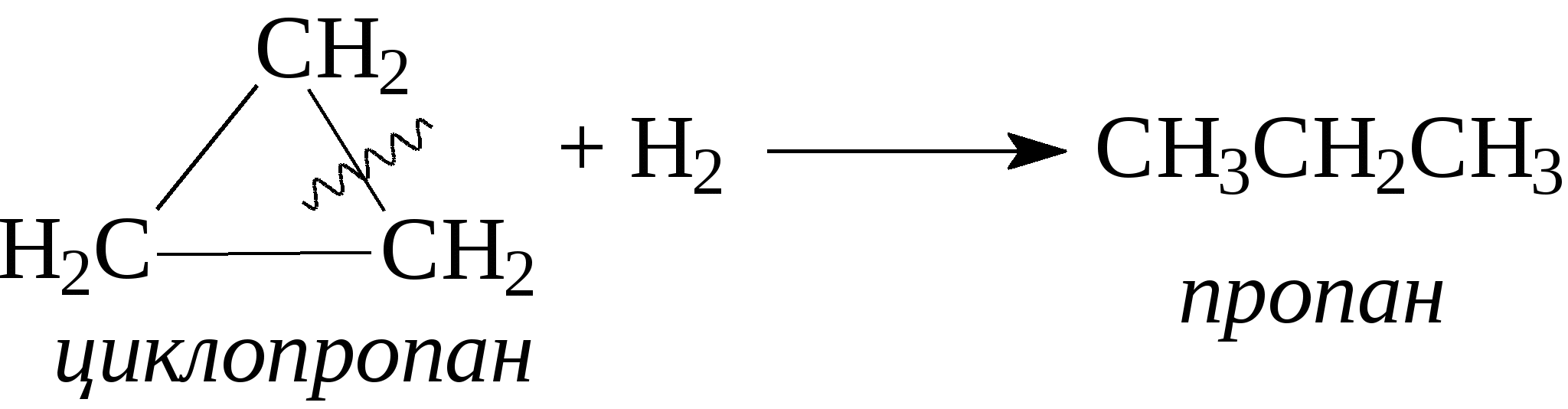 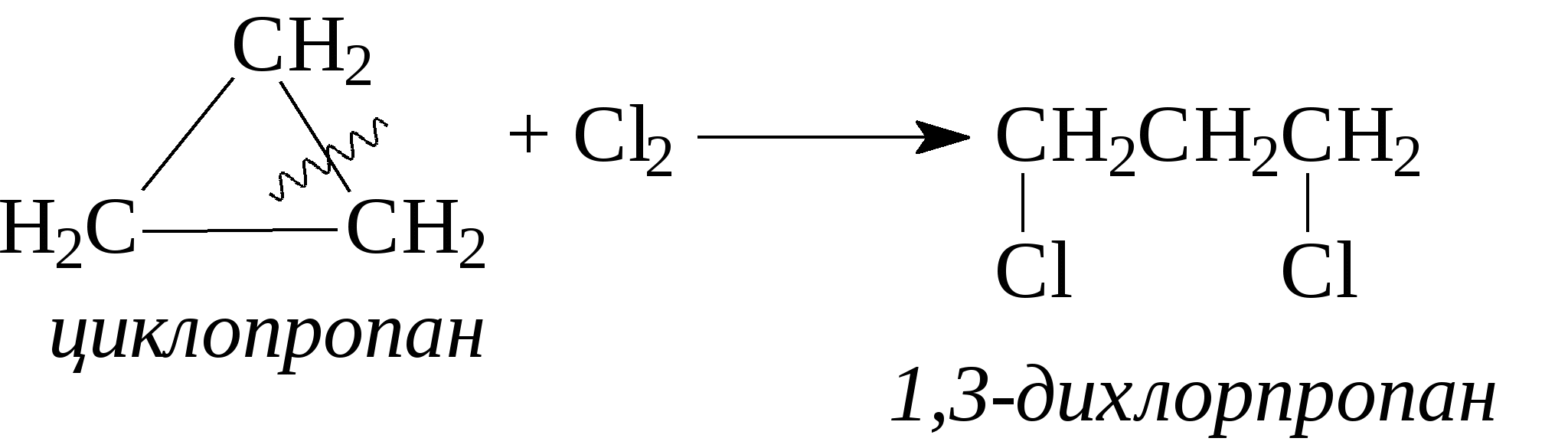 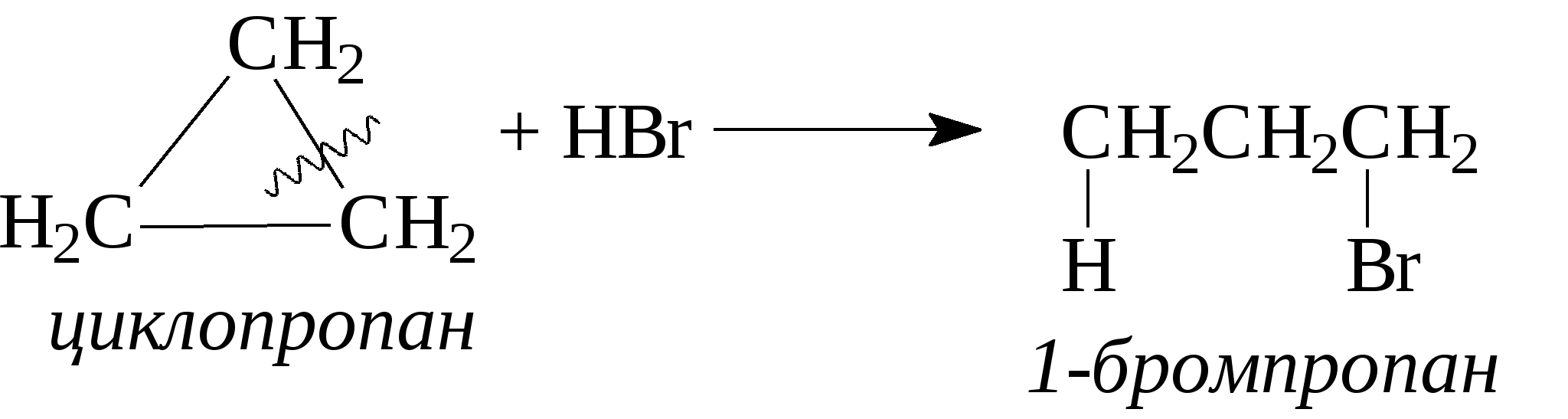 Циклопентан и циклогексан реагируют с различными реагентами так же, как и алканы в аналогичных условиях, т.е. для них основными являются реакции замещения атомов водорода на другие атомы или функциональные группы. 1. При обычных условиях они не присоединяют водород, однако при 300С на катализаторе (Pd или Pt) циклогексан и его гомологи дегидрируются до бензола и его гомологов:  2. С галогенами идет реакция замещения при нагревании или ультрафиолетовом освещении:  3. С галогеноводородами (НСl, НВr) и серной кислотой они не реагируют. С азотной кислотой идет реакция нитрования по методу Коновалова: 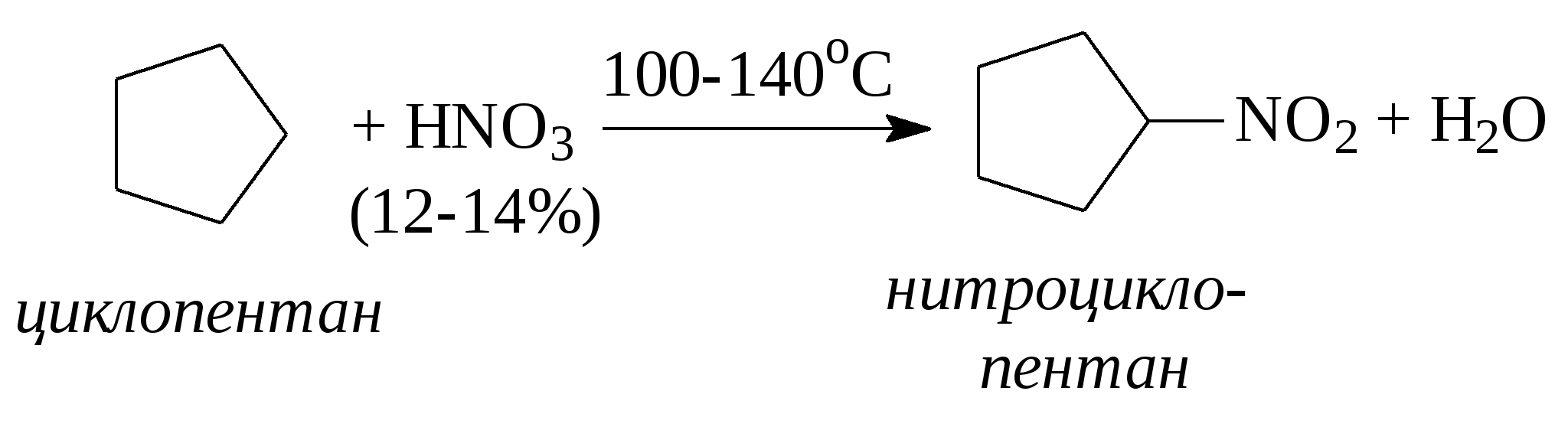 4. При действии сильных окислителей (конц. раствор КМnO4) идет окисление с разрывом кольца и образуются дикарбоновые кислоты : 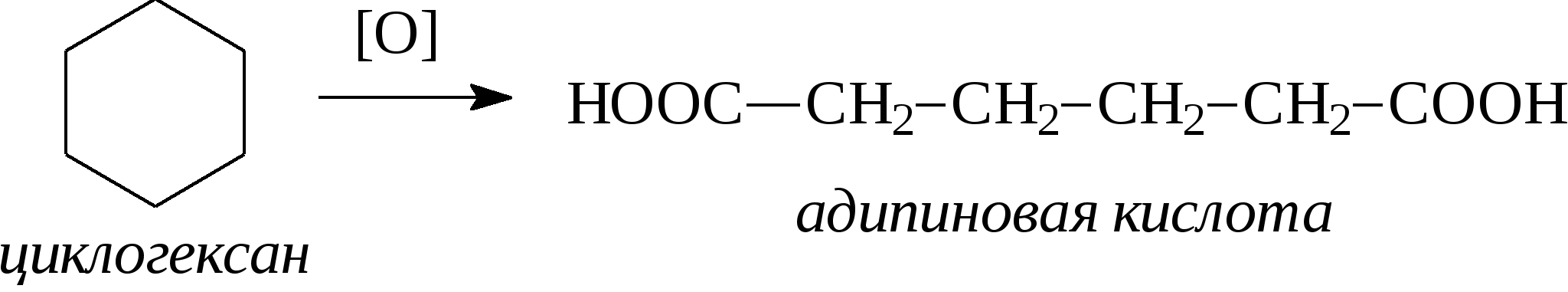 |
