ПРАКТИКУМ ПО ХИМИИ НЕФТИ И ГАЗА. Практикум по химии нефти и газа для студентов заочной дистанционной
 Скачать 1.82 Mb. Скачать 1.82 Mb.
|
Контрольные вопросы1. Напишите структурные формулы: а) бензола; б) этилбензола; в) толуола; г) орто-, мета- и пара-ксилолов; д) нафталина. 2. Получите реакцией Фриделя- Крафтса: а) толуол; б) этилбензол. 3. Какие вещества образуются при каталитическом гидрировании: а) бензола; б) этилбензола; в) толуола? 4. Напишите реакции бромирования, нитрования, сульфирования: а) толуола; б) этилбензола; в) нитробензола. Задачи 58. Напишите структурные формулы всех изомерных углеводородов бензольного ряда состава С8Н10. Назовите их. 59. Напишите структурные формулы: а) 2-метил-3-этилбензола; б) 1,3,5-три-метилбензола; в) 1-метил-4-изобутилбензола; г) 1,4-диизопропилбен-зола. 60. Напишите структурные формулы: а) о-метилэтилбензола; б) п-диэтил-бензола; в) .м-метилизопропилбензола. 61. Напишите структурные формулы: а) фенилпропана; б) фенилгексана; в) фенилэтана; г) фенилбутана. 62. Напишите для бензола реакции (с образованием однозамещенных производных): а) бромирования; б) нитрования; в) сульфирования. Назовите образующиеся соединения. 63. Сколько бромбензола можно получить при бромировании бензола массой 117 г бромом массой 316 г? Какое из исходных веществ останется в избытке? 64. Напишите формулы строения промежуточных и конечных продуктов в следующих схемах: 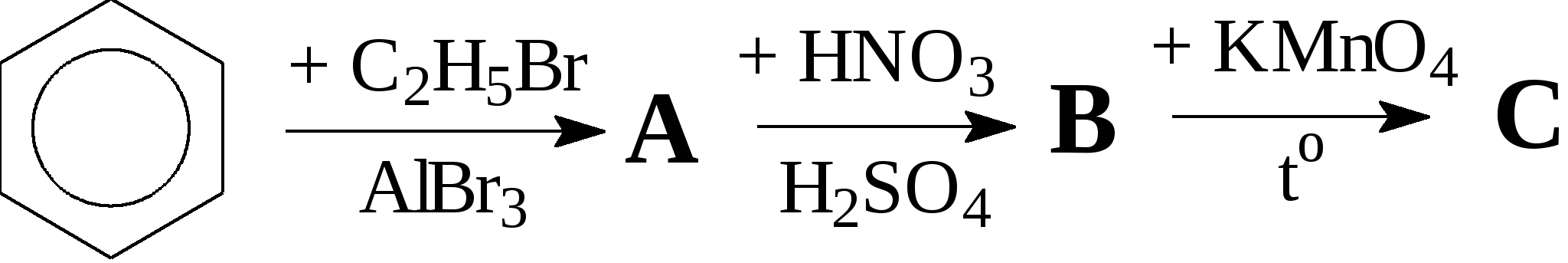 65. Установите строение ароматического углеводорода C8H10, при окислении которого получается фенилендикарбоновая кислота, а при нитровании — только одно мононитропроизводное. 66. С помощью каких реактивов и в каких условиях можно осуществить следующие превращения: 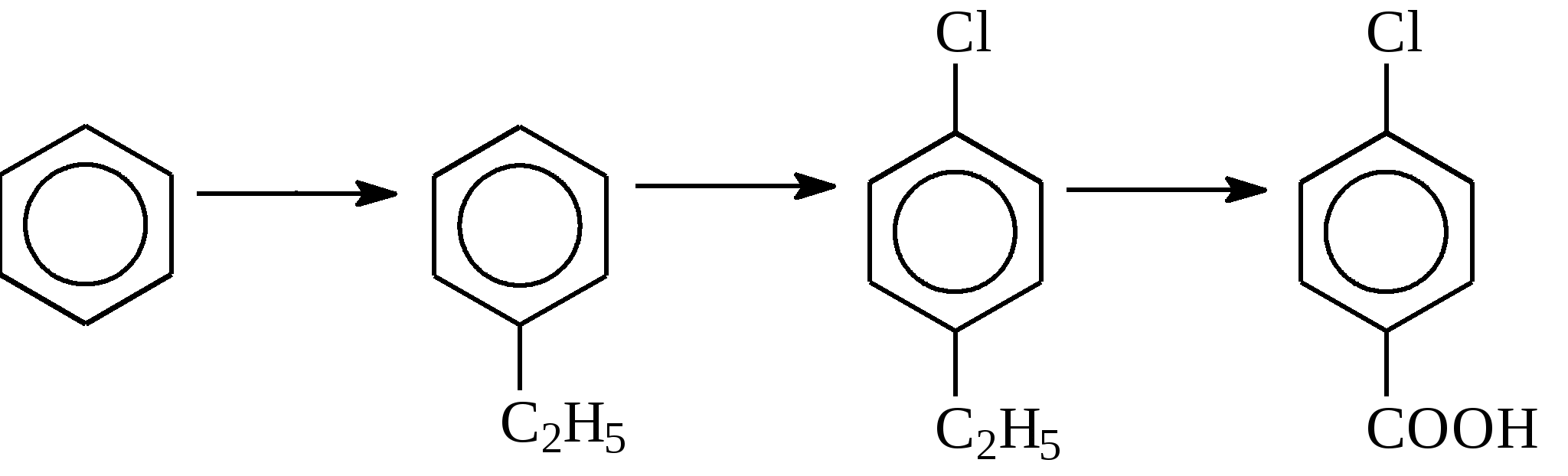 3.3. КИСЛОРОДСОДЕРЖАЩИЕ ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ К кислородсодержащим соединениям относят большую группу органических соединений, в молекулах которых содержатся углеродные атомы, непосредственно связанные с кислородом. К этим соединениям относятся: 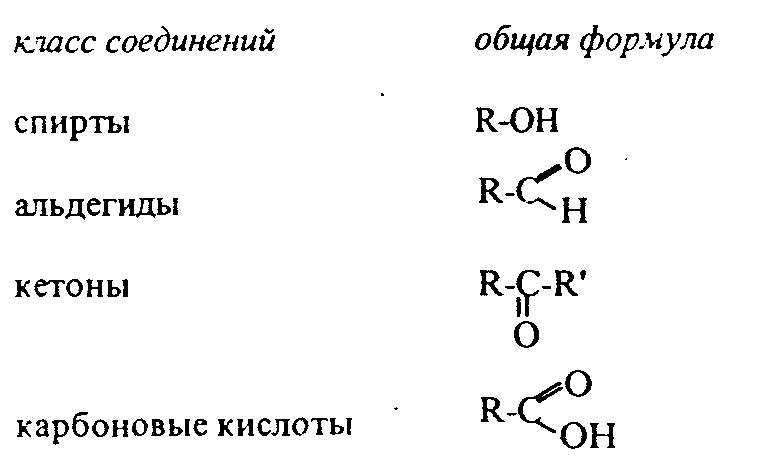 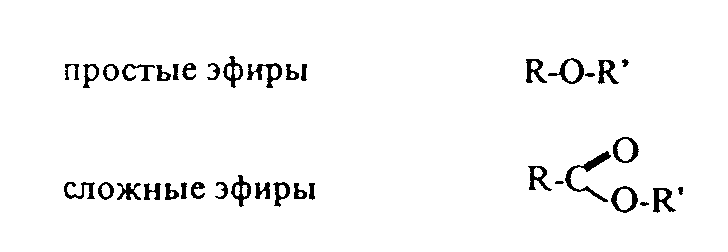 Каждый из этих классов имеет группу определенного состава и строения, содержащую кислород - функциональную группу. Наличием этой группы в молекулах кислородсодержащих соединений определяются во многом особенности химических свойств каждого класса соединений. 3.3.1. Спирты Спирты - это класс соединений, в состав которых входит функциональная группа -ОН. Например: Предельные спирты: СН3-ОН метиловый спирт, метанол СН3-СН2-ОН этиловый спирт, этанол СН3-СН2-СН2-ОН пропиловый спирт, пропанол-1 СНз-СН(ОН)-СНз изопропиловый спирт, пропанол-2 Непредельные спирты: СН2=СН-СН2-ОН - аллиловый спирт Соединения, в которых гидроксильная группа связана непосредственно с углеродным атомом ароматического кольца, называют фенолами, а если гидроксильная группа находится в боковой цепи -ароматическими спиртами. Например: 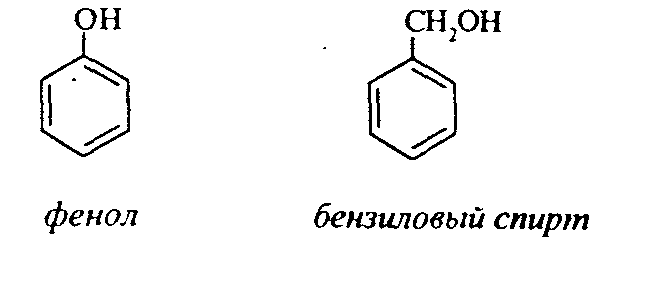 Приведенные выше спирты имеют в своем составе только одну гидроксильную группу, поэтому их называют одноатомными спиртами. Спирты, имеющие в молекуле две гидроксильные группы, называют двухатомными спиртами или гликолями. Например: 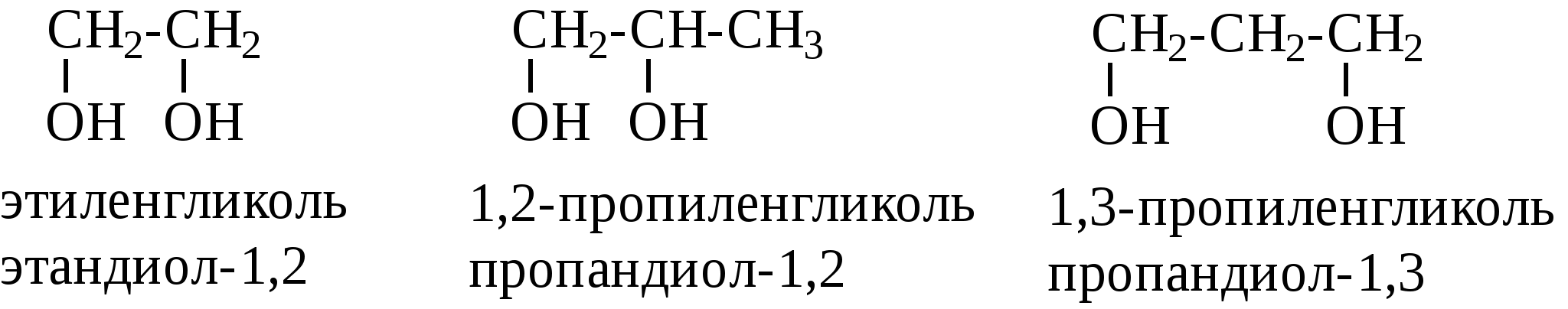 Соединения с тремя гидроксильными группами в молекуле – это трехатомные спирты. Например: СН2(ОН) –СН(ОН)-СН2(ОН) – глицерин. Методы получения спиртов1. Спирты можно получить действием воды на алкены. Реакцию проводят в присутствии серной кислоты, при этом сначала образуется эфир серной кислоты, а затем под действием воды - соответствующий спирт.  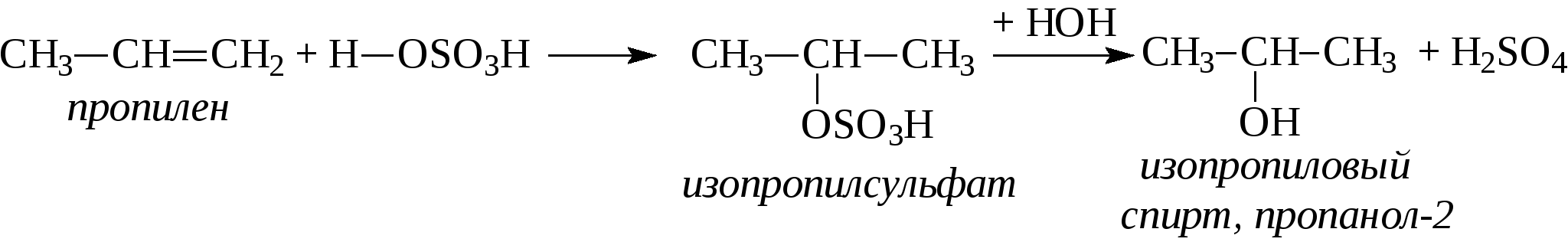 Этот метод используют в промышленности для получения этилового и изопропилового спирта. Он называется методом сернокислотной гидратации. 2. Кроме того, спирты можно получать действием водного раствора щелочи на галогенпроизводные (гидролиз галогенпроизводных): 3. Этиловый спирт получают брожением глюкозы: С6Н12О6 2 С2Н5-ОН + 2СО2 Основные реакции спиртов - это реакции по гидроксильной группе. 1. Спирты реагируют с металлическим натрием. При этом водород в гидроксильной группе замещается на металл - образуется алкоголят и выделяется водород: 2CH3-CH2-OH + 2Na 2 CH3-CH2-ONa + Н2 этилат натрия 2. Спирты взаимодействуют с минеральными и органическими кислотами, при этом происходит образование сложных эфиров: 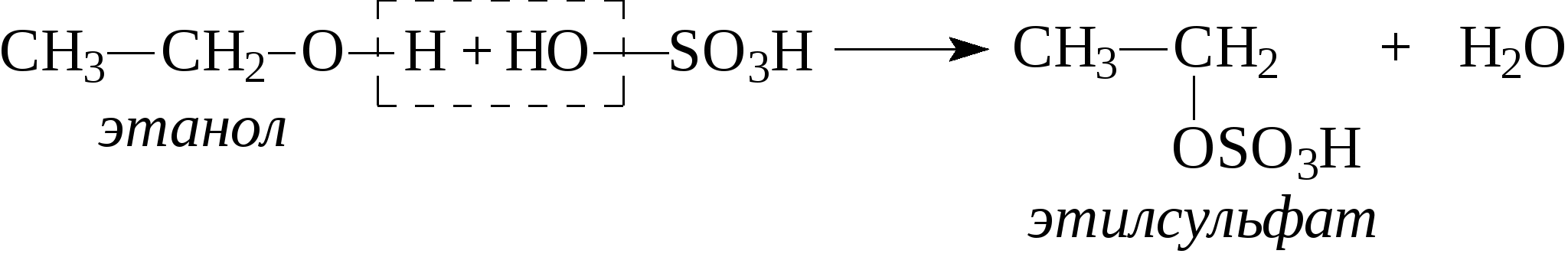  3. При нагревании спиртов с водоотнимающими средствами происходит отщепление молекулы воды от молекулы спирта и образуется алкен:  4. Если эту реакцию проводить в избытке спирта и при температуре, не превышающей 160°С, происходит отщепление молекулы воды от двух молекул спирта и образуется простой эфир: 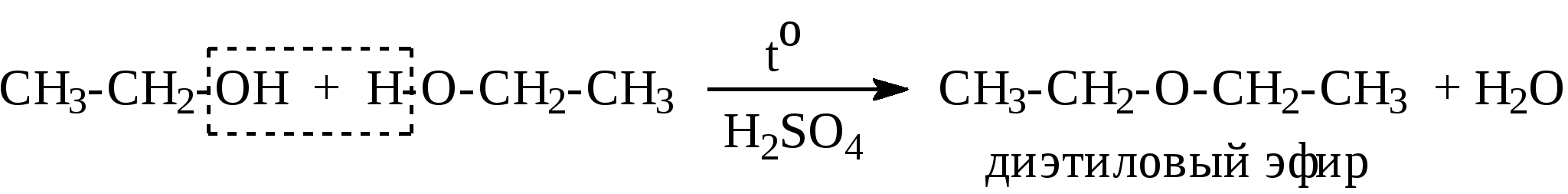 5. При действии галогенводородов (НС1, HBr, H) гидроксильная группа замещается на галоген (Cl. Br, ) 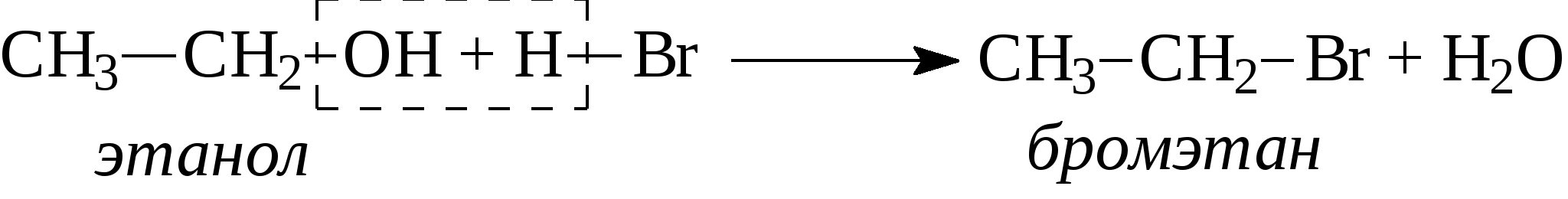 6. Спирты окисляются сильными окислителями или кислородом воздуха при температуре 300-500°С на катализаторах. При этом первичные спирты образуют альдегиды, вторичные - кетоны.   Для получения двухатомных спиртов (гликолей) применимы те же способы, что и для одноатомных спиртов. Этиленгликоль обычно получают из этилена следующими методами:   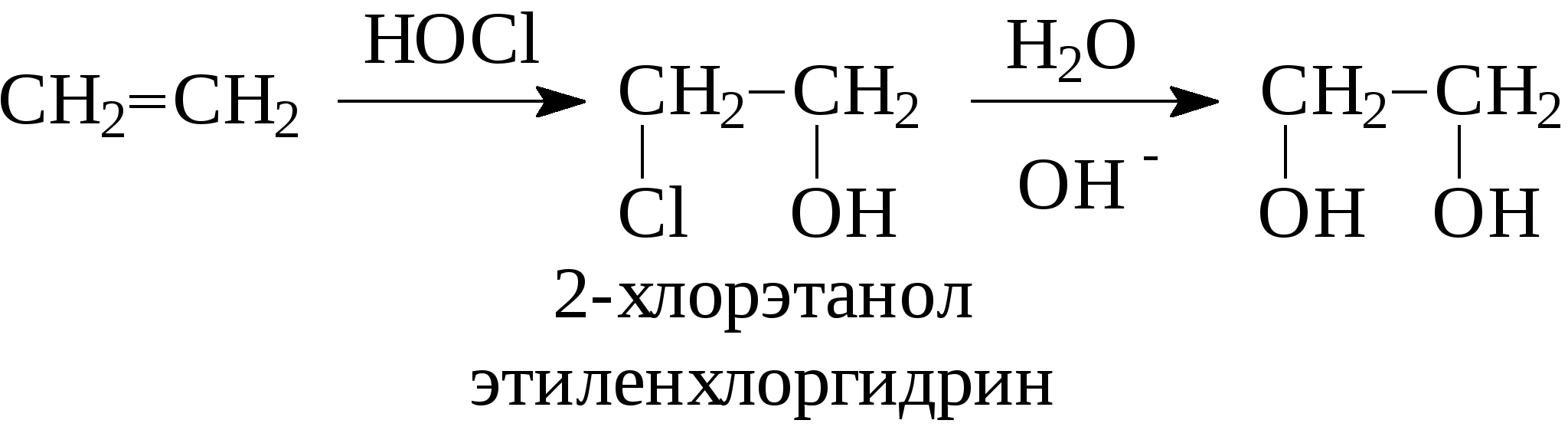 Гликоли дают все реакции одноатомных спиртов с тем лишь различием, что в реакции могут участвовать как одна, так и две гидроксильные группы. При действии на гликоли гидрата окиси меди образуется голубой осадок комплексного соединения. Эта реакция используется как качественная реакция на гликоли. 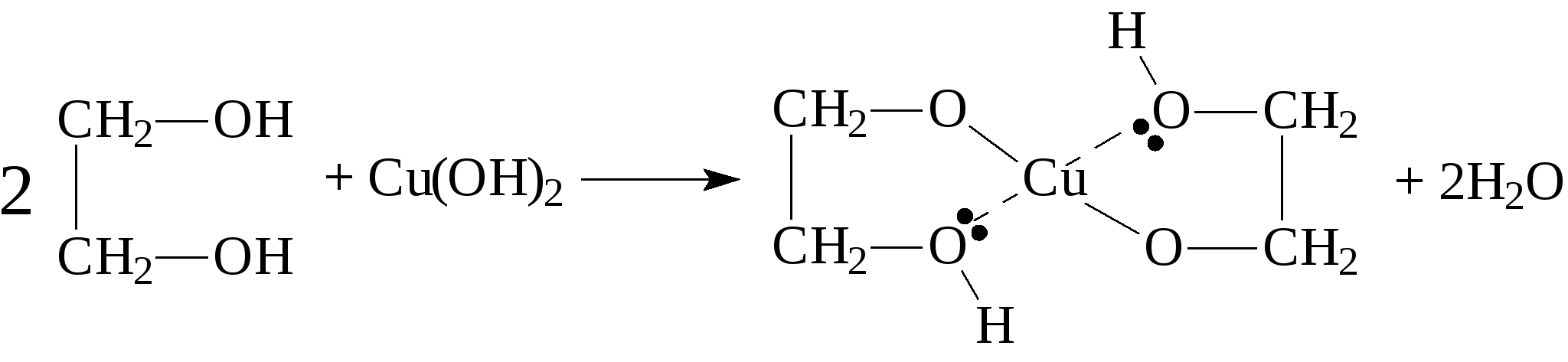 Этиленгликоль применяется как антифриз для автомобильных двигателей, т.к. понижает температуру застывания воды. Полиэфиры этиленгликоля находят применение в различных отраслях промышленности. Первым представителем трехатомных спиртов является глицерин. Его получают гидролизом жиров, которые представляют собой сложные эфиры глицерина и высших жирных кислот. Гидролиз жиров обычно называют омылением, поскольку образующиеся при этом натриевые соли высших жирных кислот являются мылами. Глицерин также получают из пропилена, который выделяют из газов процессов крекинга.  Химические свойства глицерина обусловлены наличием трех гидрок-сильных групп, при этом глицерин может давать три ряда производных: моно-, ди- и трипроизводные. Глицерин применяется в парфюмерии, кондитерском производстве, для получения нитроглицерина. А 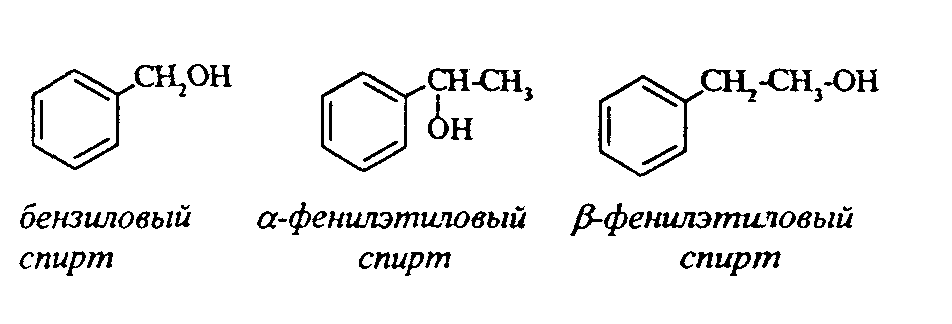 роматические соединения, у которых гидроксильная группа находится при углеродном атоме в боковой цепи, называют ароматическими спиртами. Их простейшими представителями являются: Для этих спиртов присущи способы получения и химические свойства, которые характерны для алифатических спиртов. Эти спирты представляют практический интерес, поскольку в свободном виде и в виде эфиров широко распространены в растительном мире и часто в виде сложных эфиров применяются в парфюмерии из-за приятного запаха. Например, бензиловый спирт в свободном виде или в виде эфиров встречается в масле жасмина. -Фенил-этиловый спирт является основной составляющей в розовом масле. 3.3.2. Фенолы Фенолы - органические соединения, в которых гидроксильная группа связана непосредственно с углеродным атомом ароматического кольца. Простейшие представители: 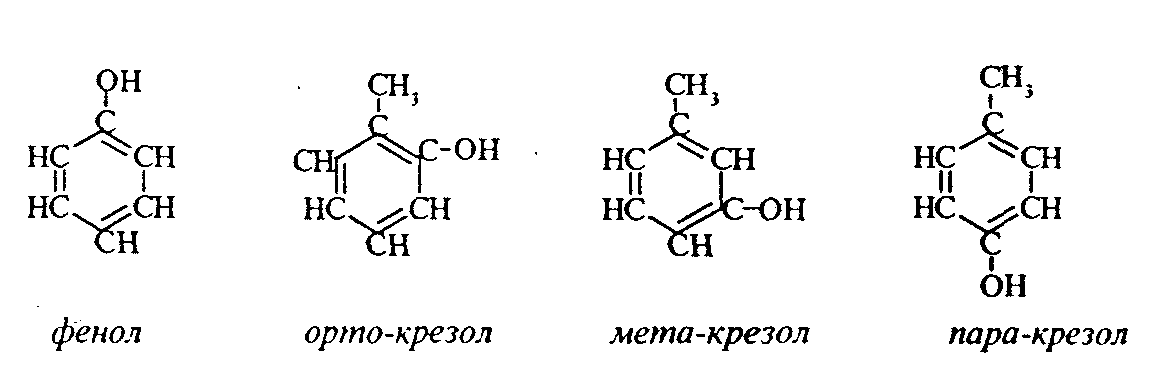 Фенол получают сплавлением солей сульфокислот со щелочами: 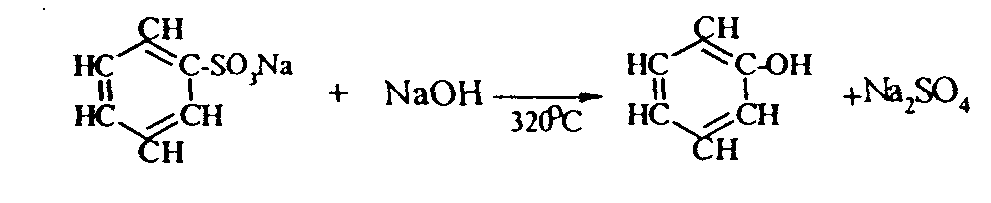 Этот метод применяется в промышленности. Фенол можно получить окислением изопропилбензола (кумола) кислородом воздуха в присутствии катализатора с последующим разложением образующегося гидропероксида кумола. В результате получаются фенол и ацетон: 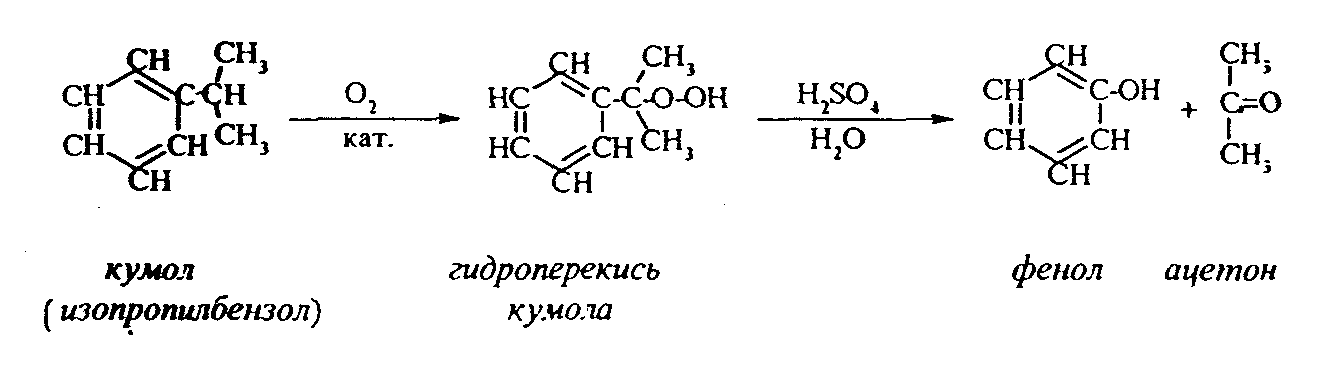 Этот метод, применяемый в промышленности для получения фенола и ацетона, называется кумольный метод. С хорошим выходом можно получить фенол пиролизом хлорбензола. 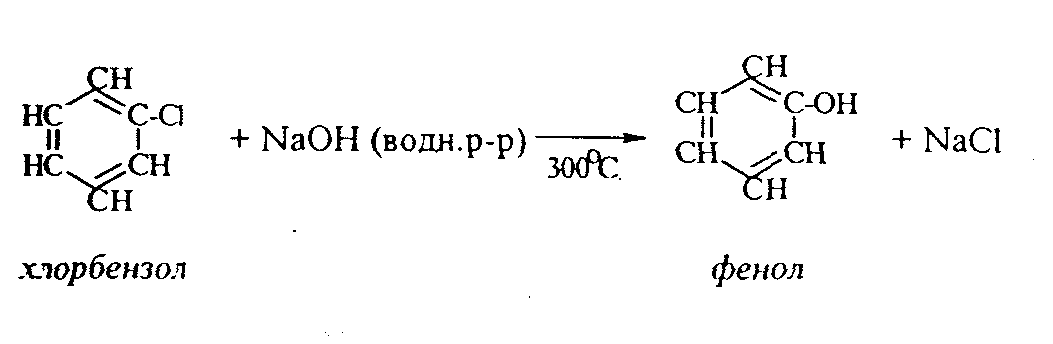 Химические свойства
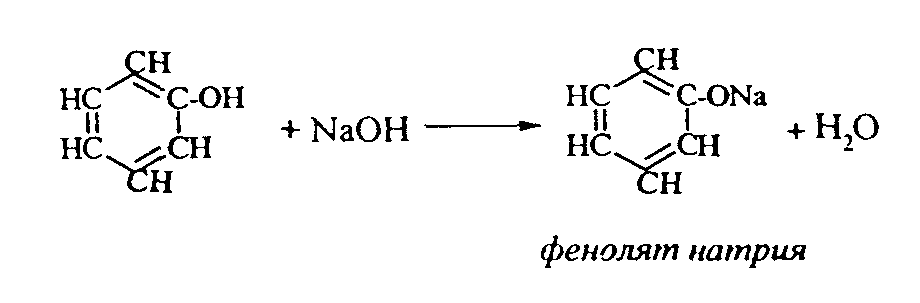 2. Феноляты реагируют с галогенпроизводными с получением эфиров фенолов: 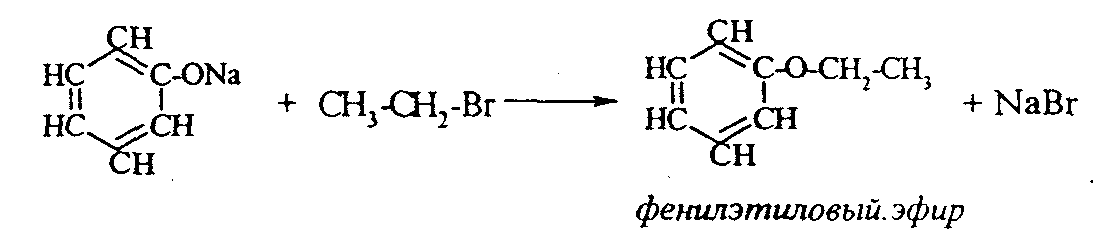 3. С галогенангидридами кислот феноляты образуют сложные эфиры: 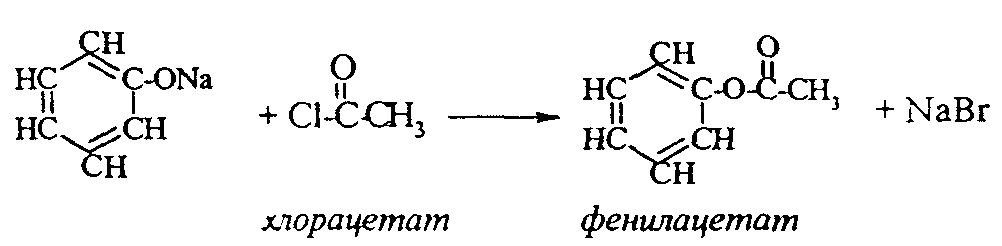 4. С хлоридом железа () FeCl3 фенол дает комплексные соединения с фиолетовым окрашиванием. Реакция используется как качественная при определении фенолов: 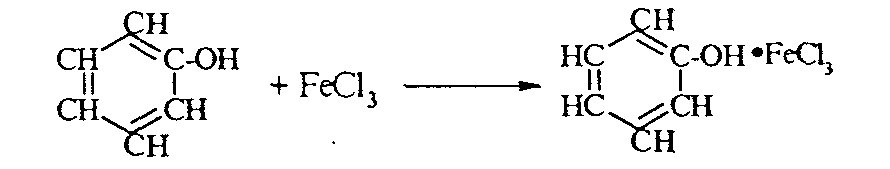 Кроме того, для фенолов характерны реакции замещения (сульфирования, нитрования, галогенирования) в ароматическом кольце, при этом группа ОН проявляет себя как очень активный заместитель первого рода, и эти реакции замещения для фенола проходят намного легче, чем для бензола. 1. Так, при действии на фенол бромной воды идет замещение сразу трех атомов водорода при углеродных атомах ароматического кольца на бром, и образуется 2,4,6-трибромфенол: 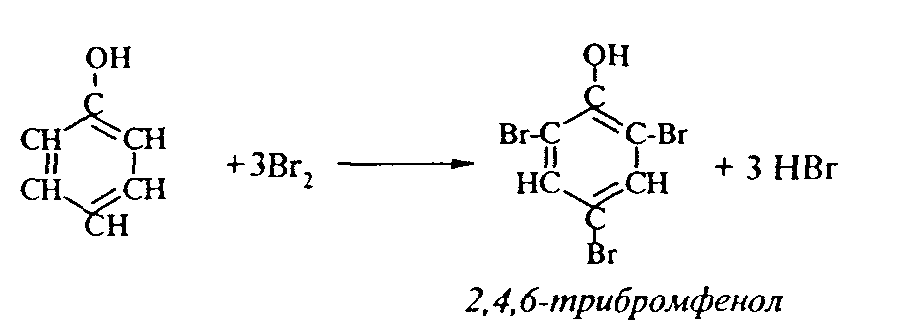 2. При сульфировании фенола получают орто- и пара-фенолсульфокислоты: 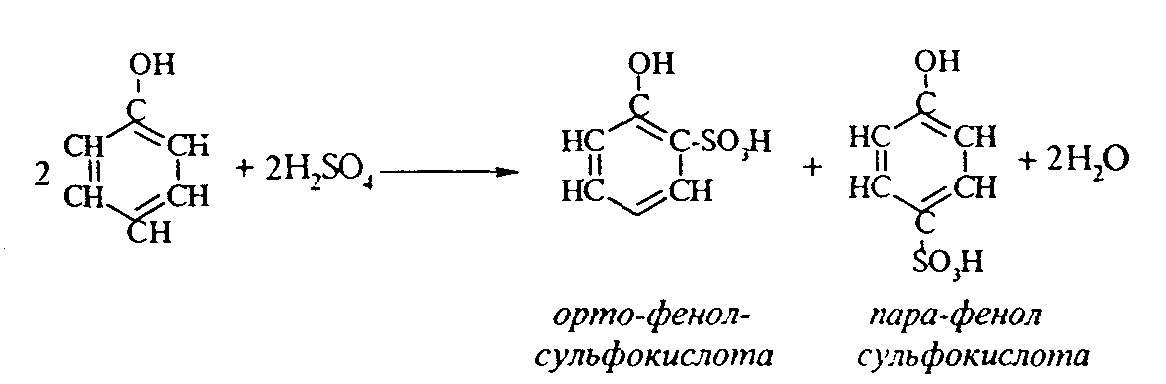 3. Нитрование фенола идет уже при действии разбавленной азотной кислоты. Получается смесь орто- и пара-нитрофенолов: 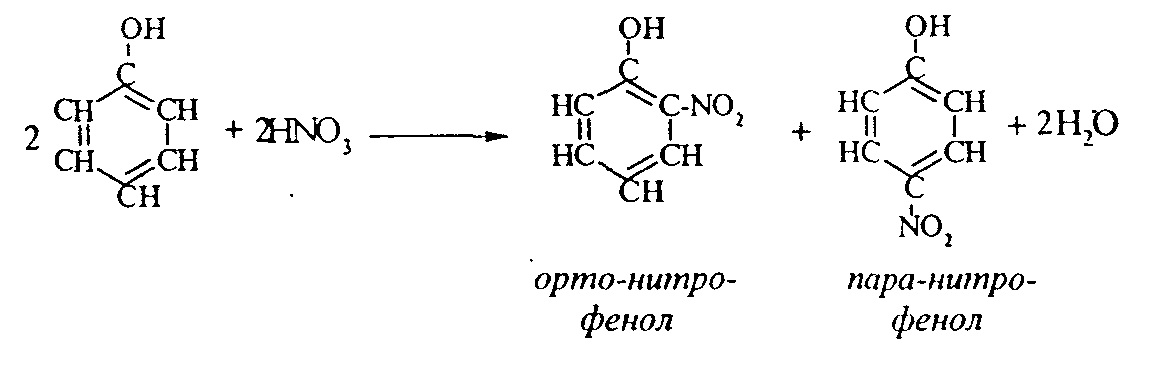 4. В присутствии кислых катализаторов фенол вступает в реакцию поликонденсации с формальдегидом: 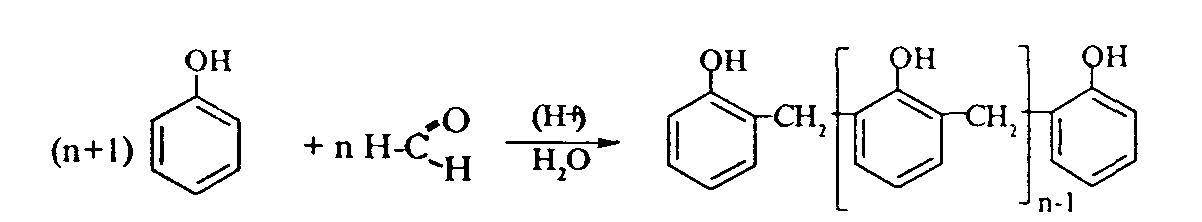 По такой схеме в промышленности получают фенол-формальдегидные смолы. 3.3.3. Карбоновые кислоты Карбоновые кислоты - это производные углеводородов, в молекулах которых содержится карбоксильная группа  Общая формула одноосновных кислот CnH2n+1COOH. Простейшие представители предельных одноосновных кислот:   Карбоновые кислоты содержатся в нефтях в количестве от десятых долей процента до 3%. В нефтях найдены карбоновые кислоты с алифатическими радикалами (CH3-, СН3-СН2- и т.д. до 24 атомов углерода в молекуле) с нафтеновыми и ароматическими радикалами. Нефтяные кислоты выделяют из нефтей и далее используют для получения мыла, антисептиков, наполнителей для взрывчатки. В промышленности кислоты получают также окислением высокомолекулярных парафиновых углеводородов, выделенных из нефтей. Окисление проводят кислородом воздуха при температуре 100-150°С в присутствии катализаторов: Кроме того, карбоновые кислоты получают окислением: а) первичных спиртов при температуре 300-500°С в присутствии катализаторов: 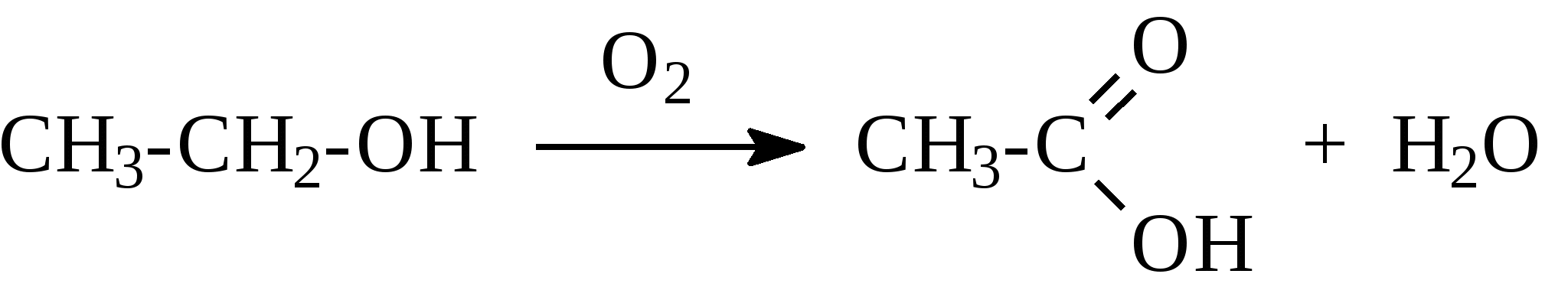 б) альдегидов: 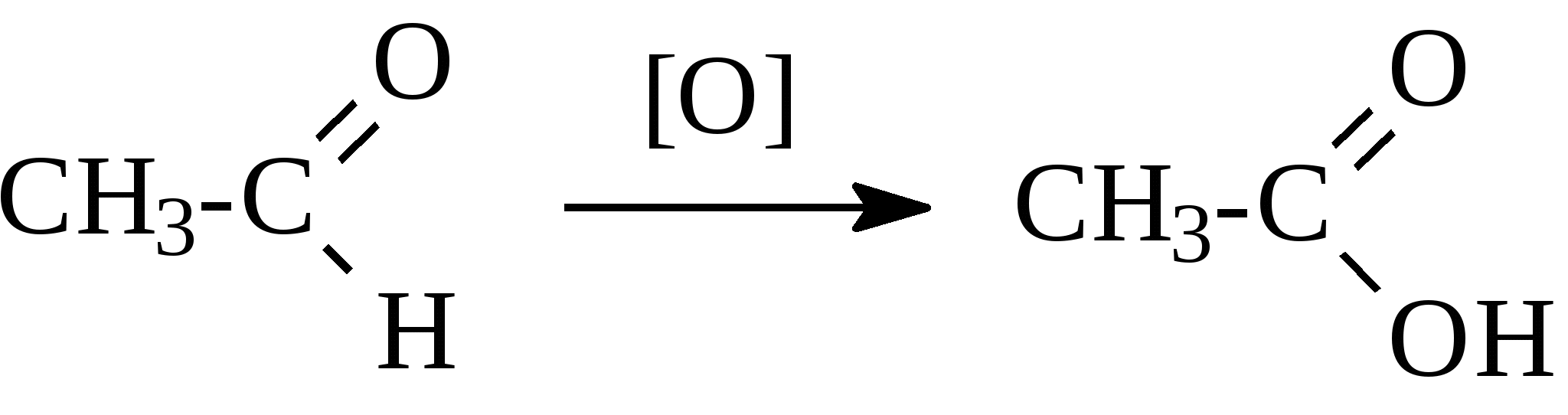 В карбоновых кислотах, в отличие от альдегидов и кетонов, не проявляются специфические свойства карбонильной группы. Основными же реакциями карбоновых кислот являются реакции замещения -Н или -ОН, приводящие к образованию различных функциональных производных. Все органические кислоты являются более слабыми кислотами, чем любая минеральная кислота. Некоторые важнейшие свойства карбоновых кислот: 1. Органические кислоты с металлами или гидроксидами металлов способны образовывать соли: СН3-СООН + NaOH СН3-COONa + Н2О уксусная кислота ацетат натрия 2СН3-СООН + 2 К 2СН3-COOК + Н2 2. При действии аммиака на кислоты образуются аммонийные соли, которые при нагревании теряют воду и образуют амиды кислот: СН3-СООН + NН3 —— СН3-СООNН4 —— CH3-CONH2 + H2O; уксусная кислота аммонийная соль ацетамид 3. При взаимодействии с РСl5 карбоновые кислоты дают хлорангидриды кислот: 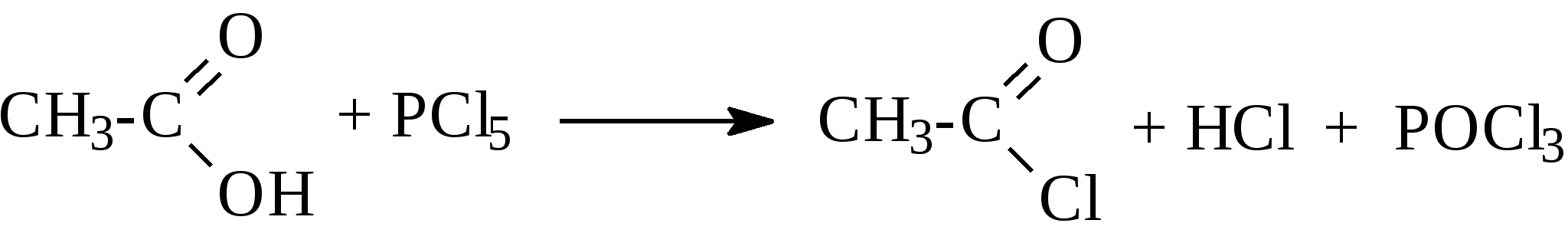 4. Со спиртами карбоновые кислоты образуют сложные эфиры. Реакция эта происходит в присутствии минеральных кислот: 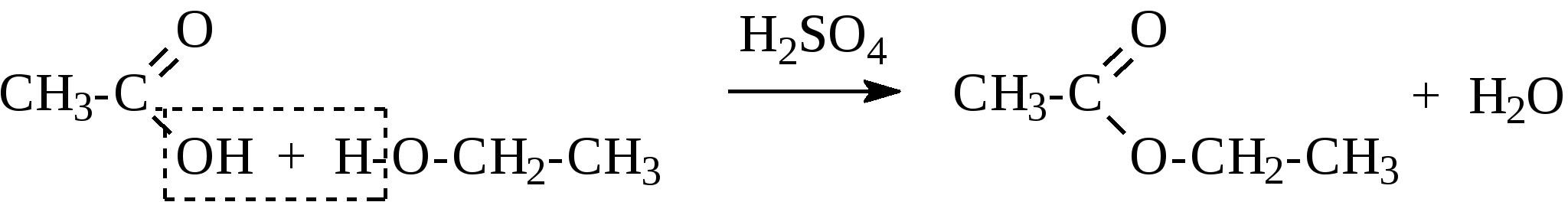 этилацетат 5. При действии Р2O5 происходит отщепление молекулы воды от двух молекул кислоты, и образуется ангидрид кислоты: 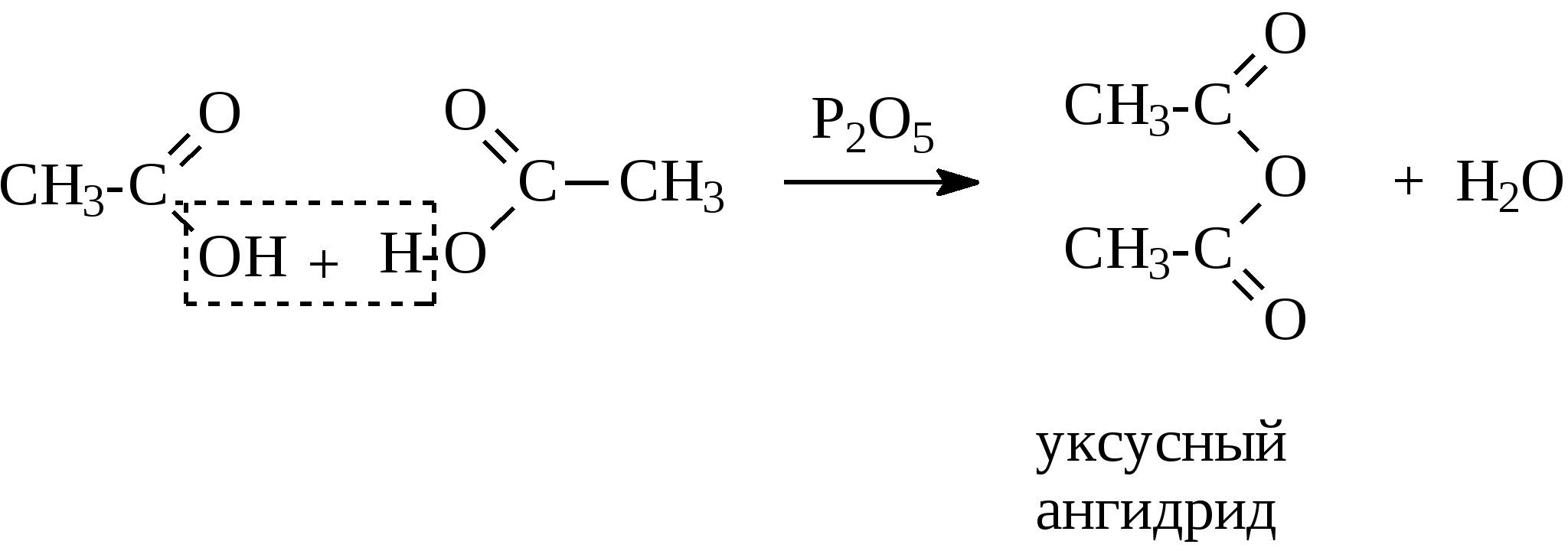 Хлорангидриды и ангидриды кислот во многих химических реакциях более активны, чем сами кислоты. 3.3.4. Практикум Лабораторная работа № 6. Кислородсодержащие органические соединения Опыт 1. Свойства спиртов а) Обнаружение воды в спирте и обезвоживание спирта. Этиловый спирт образует азеотропную смесь с водой в соотношении 96,5% спирта и 3,5% воды. Удалить эту воду из спирта можно специальными химическими методами. В фарфоровой чашке или тигле нагревают на горелке 2 г кристаллогидрата сернокислой меди (медного купороса), перемешивая соль медной проволокой до полного исчезновения голубой окраски соли и прекращения выделения паров воды. Дают остыть полученному белому порошку CuSO4 (безводн.), пересыпают его в сухую пробирку и добавляют 2-3 мл этилового спирта. При встряхивании и слабом нагревании пробирки белый порошок в ней быстро окрашивается в голубой цвет. Обезвоженный спирт осторожно сливают, индикаторной бумагой проверяют его реакцию и используют в следующем опыте. б) Образование и гидролиз этилата натрия В спирт погружают маленький кусочек металлического натрия. Охлаждая пробирку в стакане с водой, предотвращают разогревание смеси и выкипание спирта. Выделяющийся водород осторожно поджигают; его смесь с воздухом горит с характерным резким звуком. По окончании реакции удаляют непрореагировавший натрий, добавляют в пробирку 5-6 мл воды и проверяют реакцию полученного раствора с помощью фенолфталеина. 2 C2H5OH + 2Na — 2 C2H5ONa + H2 C2H5ONa + H2О — C2H5OH + NaOH После добавления фенолфталеина в пробирку с реакционной смесью появляется яркое малиновое окрашивание, указывающее на наличие щелочи. |
