новая метод. механ. Практикум по общей химии часть 1 Для студентов института механизации и технического сервиса и факультета лесного хозяйства и экологии
 Скачать 0.63 Mb. Скачать 0.63 Mb.
|
       МИНИСТЕРСТВО СЕЛЬСКОГО ХОЗЯЙСТВА МИНИСТЕРСТВО СЕЛЬСКОГО ХОЗЯЙСТВАРОССИЙСКОЙ ФЕДЕРАЦИИ Федеральное государственное образовательное учреждение высшего профессионального образования «Казанский государственный аграрный университет» Кафедра общей химии ПРАКТИКУМ ПО ОБЩЕЙ ХИМИИ Часть 1 Для студентов института механизации и технического сервиса и факультета лесного хозяйства и экологии КАЗАНЬ – 2012 год УДК 547 ББК 24.2 Г 77 Составители: доцент, к.х.н. Халиуллина З.М. ст. преподаватель, к.х.н. Шаймарданова А.А. проф., д.вет.н., Фаизов Т.Х. Ахметзянова Р.Р. Рецензенты: доцент кафедры пищевой биотехнологии КГТУ, к.х.н. Ржечицкая Л.Э. доцент кафедры агрохимии Казанского ГАУ, к.с./х.н. Муртазина С.Г. Практическое пособие утверждено и рекомендовано к печати на заседании кафедры общей химии Казанского ГАУ 9 марта 2011 года Практическое пособие обсуждено, одобрено и рекомендовано к печати на заседании методической комиссии агрономического факультета Казанского ГАУ 14 марта 2011г. протокол № 8 Методические указания предназначены для студентов 1 курса института механизации и технического сервиса и факультета лесного хозяйства и экологии Содержат основные разделы неорганической химии. С целью закрепления пройденного материала приведены контрольные вопросы. УДК 547 ББК 24.2 Г 77 © Казанский государственный аграрный университет, 2012 г.
Важнейшими классами неорганических соединений являются оксиды, основания, кислоты и соли. Оксиды – соединения элементов с кислородом, в которых кислород имеет степень окисления – 2. Оксиды делятся на: солеобразующие и несолеобразующие. Последних довольно мало (СО, NO, N2O), они не образуют солей ни с кислотами, ни со щелочами. Солеобразующие оксиды делятся на основные(их гидраты – основания), кислотные (их гидраты – кислоты), амфотерные (их гидраты проявляют свойства как кислот, так и оснований).
Гидроксиды – электролиты, которые при диссоциации в качестве анионов образуют только гидроксид-ионы. В случае металлов переменной степени окисления в скобках указывают степень окисления металла в данном гидроксиде, например Fe (OH) 2 -гидроксид железа (II), Fe (OH) 3 –гидроксид железа (III). Щелочи– это растворимые в воде гидроксиды (NaOH, KOH, LiOH и др.), а также гидроксид аммония (NH4OH). Гидроксиды способны взаимодействовать с кислотными оксидами, а также с кислотами и солями: 2 NaOH +H2SO2 = Na2SО4 + 2 H2O 2 KOH + Cu(NO 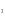 ) )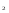 = Cu(OH)2 ↓ + 2 KNO = Cu(OH)2 ↓ + 2 KNO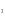 6 LiOH + P2O5 = 2 Li3 PO4 + 3 H2 O Амфотерные гидроксиды занимают промежуточное положение между кислотами и основаниями и проявляют одновременно как свойства кислот, так и свойства оснований. Be(OH) 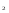 + 2 HCl = BeCl + 2 HCl = BeCl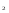 + 2H2O + 2H2OBe(OH) 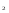 + KOH = K2[Be(OH)4] + KOH = K2[Be(OH)4]Кислоты – электролиты, при диссоциации которых в качестве катионов образуются только катионы водорода Н+ (точнее ионы гидроксония Н3О+): НCl = H+ + Cl- Кислоты классифицируют по составу (кислородные и бескислородные), основности (одно-, двух-, трехосновные и т. д.), способности к электролитической диссоциации (силе). Например: HCl – хлороводородная (бескислородная, одноосновная, сильная) H2SO4 - серная (кислородосодержащая, двухосновная, сильная) НNO 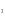 - азотная (кислородосодержащая, одноосновная, сильная) - азотная (кислородосодержащая, одноосновная, сильная)Н2SiO 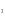 - кремневая (кислородосодержащая, двухосновная, слабая) - кремневая (кислородосодержащая, двухосновная, слабая)Н2СO 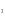 - угольная (кислородосодержащая, двухосновная, слабая) - угольная (кислородосодержащая, двухосновная, слабая)Кислоты при электролитической диссоциации образуют в водном растворе ионы Н 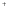 ,основания - ОН ,основания - ОН . .Соли– электролиты, при диссоциации которых образуются катионы металлов (или ионы аммония NH4+), анионы кислотных остатков. Соли делятся на средние (или нормальные), кислые и основные. Для солей, образованных металлами с переменной степенью окисления, последнюю указывают в скобках: FeSO4 –сульфат железа (II), Cr2(SO3)3 –сульфит хрома (III). Средние соли можно рассматривать как продукты полного замещения атомов водорода в кислоте атомами металла (или ионами аммония NH4+) или как продукты полного замещения гидроксогрупп основания кислотными остатками. Например, ВаСl2 – хлорид бария, СаSO 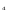 - сульфат кальция, Na - сульфат кальция, Na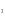 РО РО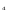 - фосфат натрия, KNO - фосфат натрия, KNO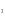 - нитрат калия, NH4F – фторид аммония. - нитрат калия, NH4F – фторид аммония. Кислые соли – продукты неполного замещения атомов водорода многоосновных кислот атомами металла (или ионами NH4+) . Их образуют только многоосновные кислоты. Например, NaHCO3 – гидрокарбонат натрия, Са(Н2РО4)2 - дигидрофосфат кальция, КНSO4 - гидросульфат калия. Названия кислых солей образуют, добавляя к названию аниона приставку гидро- если необходимо, то с соответствующим числительным): KH2PO4 – дигидрофосфат калия. Основные соли – по составу являются продуктами полного замещения гидроксогрупп основания на кислотные остатки. Основные соли образуются только многокислотными основаниями. Названия основных солей образуют, добавляя приставку гидроксо-. Например, (СuОН)2СО3 – гидроксокарбонат меди, АlОН(NО3)2 – гидроксонитрат алюминия, FeOHCl – гидроксохлорид железа (II) . Контрольные вопросы
1. Основные понятия и законы химии Основой химии является атомно-молекулярное учение. Основные положения атомно-молекулярной теории: 1.Все вещества состоят из молекул, атомов или ионов. Молекула – это наименьшая частица вещества, обладающая его химическими свойствами. 2. Молекулы находятся в постоянном хаотическом движении, называемом тепловым и с повышением температуры скорость движения молекул увеличивается. 3. Молекулы различных веществ отличаются друг от друга массой, размерами, составом, строением и химическими свойствами. 4.Молекулы простых веществ состоят из одинаковых атомов ( Fe, Si, H2 , F2 , N2), молекулы сложных веществ – из различных атомов(CO2, C6H6, NaCI) . Простые вещества – гомосоединения, сложные – гетеросоединения в агрегатном состоянии устойчивом при стандартных условиях . 5.Атомом называется наименьшая частица химического элемента. Химический элемент – совокупность атомов с одинаковым зарядом ядра и электронной оболочкой. В настоящее время известно около 120 элементов, из них в природе существует 88, а остальные получены искусственным путем. Число существующих простых веществ около 400, больше числа элементов, что объясняется явлением аллотропии. Аллотропия – явление образования нескольких простых веществ одним элементом. Простые вещества, образованные одним и тем же элементом называются аллотропными видоизменениями (модификациями). Они могут отличаться составом молекул О2 – кислород, О3 – озон или структурой – алмаз, графит, карбин. 6. Ионами называются заряженные частицы, состоящие из отдельных атомов или групп химически связанных атомов, имеющих избыток или недостаток электронов. Для атомов элементов–металлов характерно образование положительно заряженных ионов т.е. катионов. Na0 – 1e- = Na+ Для атомов элементов-неметаллов характерно образование отрицательно заряженных ионов т.е. анионов. Cl0 + 1e- = Cl- Атом – это электронейтральная частица, состоящая из положительно заряженного атомного ядра и отрицательно заряженных электронов (суммарный заряд которых равен нулю). Массы атомов химических элементов чрезвычайно малы–от 1,674 ∙ 10-27 до 4,27∙10-25кг m (H ) = 1,67 ∙ 10-27 кг m (O) = 2,66 ∙ 10-26 кг m (C) = 1,993 ∙ 10-26 кг В химии пользуются не их абсолютными значениями масс (mа), а относительными (Аr, где r означает «относительный» - от английского relative). Относительной атомной массой химического элемента называется отношение массы его атома к 1/12 массы изотопа углерода – 12С. 1/12 массы атома изотопа  принята за атомную единицу массы (а. е. м.). принята за атомную единицу массы (а. е. м.).1а.е.м. = 1/12mа(С) = 1,993 ∙ 10-26/12 =1,667х10-27кг В соответствии с этим: ma(H) 1,674 ∙ 10-27 кг Ar (Н) = ———— = —————— = 1,0079 1/12ma(C) 1,667 ∙ 10-27 кг Относительная атомная масса – величина безразмерная. ma(O) 2,66 ∙ 10-26 Аr (О) = ————— = ———— = 15,999 1/12ma(C) 1,667 ∙ 10-27 Относительная атомная масса показывает во сколько раз масса атома данного элемента больше 1/12 массы изотопа углерода. 12С. Например, относительная масса железа равна 56. Это означает, что атом железа 56Fе в 56 раз тяжелее 1/12 массы атома углерода. Единицей измерения количества вещества является Моль. Моль – это количество вещества, содержащее столько структурных единиц (молекул, атомов, ионов, электронов, эквивалентов и т.д.), сколько содержится атомов в 0,012 кг изотопа углерода 12С. Число атомов (NА)в 0,012 кг углерода (т.е. в 1 моль) легко определить, зная массу атома углерода – 1,993х10-26 кг 0,012 кг/моль NА = ———————— = 6,02 ∙ 10 23 моль-1 1,993 ∙ 10 -26 кг Эта величина называется постоянной Авогадро. Масса 1 моль вещества называется молярной массой (М) и она равна отношению массы этого вещества m к его количеству n. m M = —— г/моль или кг/моль n Численное значение молярной массы (в г/моль) совпадает с относительной молекулярной, атомной или формульной массой данного вещества. Например, масса относительная молярная Н2 — 2,0158 2,0158 г/моль ( NH4)2CO3 — 96,086 96,086 г/моль Химическому элементу соответствует атом, соединениям молекула. Основные законы стехиометрии Стехиометрия - раздел химии, рассматривающий количественные (массовые, объемные) соотношения между реагирующими веществами. Закон сохранения массы (Ломоносов. Лавуазье). Общая масса реагентов равна общей массе продуктов реакции. Для уравнения реакции: aA+bB=AaBb закон сохранения массы можно записать в следующем виде: m(A) + m(B) = m(AaBb) или в общем виде:  = = 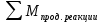 . Закон постоянства состава (Пруст). Всякое чистое вещество, независимо от способа его получения, всегда имеет постоянный качественный и количественный состав. Закон эквивалентных отношений (Рихтер). Массы реагирующих веществ относятся между собой как молярные массы их эквивалентов: 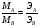 , ,где МA, МB –массы реагирующих веществ; ЭА, ЭВ – их химические эквиваленты Эквивалент химический – реальная или условная частица вещества, которая в данной кислотно-основной реакции эквивалентна одному атому водорода или в данной кислотно-восстановительной реакции – одному электрону. 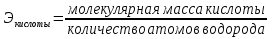 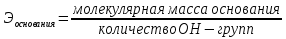  где Ч.А.М. – число атомов металла в молекуле соли Закон Авогадро. В равных объемах любых газов при одинаковых условиях содержится одинаковое число молекул. Молекулы простых газов двухатомны (H2, O2, N2). 1 моль − 22,4 л − 6,023∙1023 молекул (NА) (где NА − число Авогадро) при нормальных условиях (Т =273,15 К, Р = 101, 325 кПа) Уравнение Менделеева – Клайперона 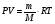 где Р− давление газа, Па: V− его объем, м3 m − масса вещества, г ; М − его мольная масса, г/моль; Т− абсолютная температура, К; R− универсальная газовая постоянная, равная 8,314 Дж/(моль∙К). Контрольные вопросы
4.Кинетика и равновесие химических реакций 4.1.Химическая кинетика |
