новая метод. механ. Практикум по общей химии часть 1 Для студентов института механизации и технического сервиса и факультета лесного хозяйства и экологии
 Скачать 0.63 Mb. Скачать 0.63 Mb.
|
|
Раздел химии изучающий скорость и механизм химических реакций, а также их зависимость от различных факторов (концентрации, температуры, давления и т.д.) называется химической кинетикой. Скорость химической реакции измеряют по изменению концентрации реагирующих (исходных) веществ (Δс) в единицу измерения (Δτ). V = Δс / Δτ Согласно основному закону химической кинетики скорость реакции пропорциональна произведению концентраций реагирующих веществ, возведенных в степени их стехиометрических коэффициентов (закон действующих масс). Например, для реакции аА + bB → dD + eE математическое выражение закона: V = k · (CA)a · (CB)b где CA и CB – концентрации реагирующих веществ. k – коэффициент пропорциональности, называемый константой скорости химической реакции. При CA= CB =1 моль/л V = k. В этом физический смысл константы скорости. Влияние температуры на скорость химической реакции определяется правилом Вант-Гоффа: при повышении температуры на 10º скорость реакции возрастает примерно в 2-4 раза. Это увеличение скорости называют температурным коэффициентом γ. VT2 = VT1 · γ(T2-T1)/10 Т1, Т2 – начальная и конечная температуры; V1, V2 – скорости; γ – коэффициент, варьирующийся от 2 до 4. 4.2. Химическое равновесие Все химические реакции можно разделить на необратимые и обратимые. Необратимыми реакциями называются такие реакции, которые протекают в одном направлении и идут до конца. К ним относятся реакции, сопровождающиеся выпадением осадка, выделением газа, образованием малодиссоциирующих веществ и т.п. Обратимыми называются такие реакции, которые одновременно протекают в двух взаимно-противоположных направлениях. Если протекает обратимая реакция mА + nВ 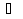 рС + qD , рС + qD , то согласно закону действующих масс КР = [С]p · [D]q / [А]m · [В]n где Кр - константа равновесия. Смещение равновесия определяется принципом Ле-Шателье: если изменить одно из условий, при которых система находится в состоянии химического равновесия (например, температуру, давление или концентрацию), то равновесие смещается в направлении той реакции, которая противодействует произведенному изменению. Среди многочисленных факторов, влияющих на скорость химической реакции, особое значение придается катализаторам. Катализаторы - вещества, изменяющие скорость химического процесса, но остающиеся после реакции в химически неизменном виде и первоначальном количестве. Контрольные вопросы 4.1. Начальные концентрации веществ в реакции. СО + Н2О 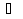 СО2 + Н2 СО2 + Н2были равны (моль/л): С СО – 0,5 , 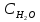 – 0,6, – 0,6, 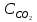 – 0,4, Сн2 – 0,2. – 0,4, Сн2 – 0,2. Вычислите концентрации всех участвующих в реакции веществ после того, как прореагировало 60 % Н2О. 4.2. Во сколько раз следует увеличить давление, чтобы скорость образования NO2 по реакции 2NO + O2 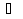 2NO2 2NO2Возросла в 1000 раз. 4.3. В какую сторону сместится химическое равновесие в системах: 2СО + О2 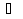 2СО2; ΔH˚ = - 566 кДж 2СО2; ΔH˚ = - 566 кДжN2 + O2 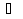 2NO; ΔH˚ = + 180,7 кДж 2NO; ΔH˚ = + 180,7 кДж2NO + O2 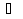 2NO2; Δ H˚ = - 113,0 кДж 2NO2; Δ H˚ = - 113,0 кДжа) при повышении температуры; б) при повышении давления? 4.4. Константа равновесия реакции 2NO + O2 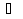 2NO2 2NO2при 494˚ С равна 2,2 . В состоянии равновесия С NO = 0,02 моль/л, 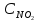 =0,03 моль/л. Вычислить исходную концентрацию кислорода. =0,03 моль/л. Вычислить исходную концентрацию кислорода.5. Химическая термодинамика Термодинамика - это наука, изучающая переходы энергии из одной формы в другую, от одних частей системы к другим, а также направление и пределы самопроизвольного протекания процессов. Химическая термодинамика – область химии, изучающая энергетику химических процессов, возможности и условия самопроизвольного протекания химических реакции, а также условия установления химических равновесия. Объектам изучения термодинамики является система, т.е. тело или совокупность тел, состоящих из множества молекул или атомов, мысленно или фактически обособленных от окружающей среды. Химические вещества, входящие в состав системы, являются её составными частями или компонентами. Системы могут быть одно - двух - и многокомпонентными. Термодинамические системы делятся на гомогенные (однородные) и гетерогенные (неоднородные). Гомогенные системы, в отличие от гетерогенных, не имеют поверхности раздела между отдельными участками, т.е. являются однофазными. При этом под фазой подразумевается совокупность однородных частей системы, имеющих одинаковый состав, строение, свойства и отделенных от других частей системы поверхностью раздела или граничной поверхностью. Примером гомогенных систем могут служить смеси газов, жидкие или твердые растворы и др. Гетерогенные системы содержат несколько фаз, например: лед- вода, лед- вода- пар и др. Термодинамические системы могут быть открытыми (возможен обмен с окружающей средой как веществом, так и энергией), закрытыми (обмен веществом с окружающей средой невозможен) и изолированными (отсутствуют какие-либо формы обмена). В ходе различных превращений система переходит из одного энергетического состояния в другое. То или иное состояние системы определяется или характеризуется термодинамическими параметрами. Основными параметрами системы являются: объем, давление, температура и концентрация. В зависимости от того, какие параметры при переходе системы из одного состояния в другое остаются постоянными, процессы делятся на: изохорные (проходящие при постоянном объеме, V=const), изобарные (проходящие при постоянном давлении, Р = const) и изотермические (проходящие при постоянной температуре ,T = const). Термодинамические функции В химических процессах наиболее часто используются следующие термодинамические функции состояния системы: Внутренняя энергия (U); Энтальпия (Н); Энтропия (S);Энергия Гиббса (G). Внутренняя энергияU и её изменение 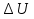 при V=const. при V=const.Внутренняя энергия системы (U) –это полная энергия системы, включающая кинетическую энергию всех видов движения молекул, атомов, ядер, электронов и других структурных единиц, а также потенциальную энергию взаимодействия и др., кроме кинетической и потенциальной, энергии всей системы как целого по отношению к другим системам. Запас внутренней энергии системы зависит от параметров состояния системы, природы вещества и прямо пропорционален массе вещества. Абсолютное значение внутренней энергии определить невозможно, так нельзя привести систему в состояние, полностью лишенное энергии. Можно лишь судить об ее изменении(  U) при переходе из начального состояния 1 (которому соответствует U1) в конечное состояние 2 (которому соответствует U2),: U) при переходе из начального состояния 1 (которому соответствует U1) в конечное состояние 2 (которому соответствует U2),: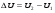 Энтальпия ( теплосодержание) Н и ее изменение 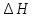 при Р= const; при Р= const; Энтальпия, как и внутренняя энергия, являясь функцией состояния, зависит от параметров состояния системы, ее природы, физического состояния и количества вещества, а ее изменение (H) определяется только начальным и конечным состоянием системы и записывается в виде: ∆H =H 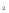 -H -H . .Энергия не исчезает бесследно и не возникает из ничего, а лишь переходит из одной формы в другую в эквивалентных количествах.  При переходе неизолированной системы из одного состояния в другое, изменение ее внутренней энергии осуществляется путем обмена с окружающей средой. Основными формами обмена являются совершение работы и выделение или поглощение теплоты Теплоты химических процессов, протекающих в изохорно-изотермических и изобарно-изотермических условиях, называют тепловыми эффектами. Тепловые эффекты реакций измеряются в Дж/моль или кДж/моль. При этом теплота в ходе реакции может, как выделяться, так и поглощаться. В тех случаях, когда теплота выделяться(  H<0 или H<0 или  U<0), реакции называются экзотермическими, а когда поглощается ( U<0), реакции называются экзотермическими, а когда поглощается ( H>0 или H>0 или  U>0) – эндотермическими. Тепловые эффекты реакций определяются как экспериментально, так и с помощью термохимических расчетов. В расчетах используют не абсолютные значения H и U (т.к. измерить их невозможно), а их изменение( U>0) – эндотермическими. Тепловые эффекты реакций определяются как экспериментально, так и с помощью термохимических расчетов. В расчетах используют не абсолютные значения H и U (т.к. измерить их невозможно), а их изменение( H и H и  U) . U) .Уравнения химических реакций, записанные с указанием их теплового эффекта называют термохимическими уравнениями. Например: аА+вВ=сС+дД;  H H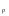 Для проведения термохимических расчетов вводят специальные понятия - энтальпия (теплота) образования и сгорания вещества. Энтальпией или теплотой образования вещества называют тепловой эффект реакции образования одного моля вещества из простых веществ, устойчивых при данных условиях. Энтальпии (теплоты) образования веществ, отнесенные к стандартному состоянию (p=1атм и Т= 298 К 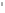 ), называются стандартными, обозначаются как ), называются стандартными, обозначаются как  H H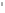 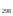 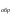 или или  H H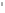 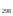 . В последнее время – просто как . В последнее время – просто как  H H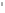 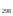 и выражают в Дж/моль или кДж/моль. Верхний индекс отмечает стандартное состояние вещества, нижний - стандартную температуру. и выражают в Дж/моль или кДж/моль. Верхний индекс отмечает стандартное состояние вещества, нижний - стандартную температуру. В основе термохимических расчётов реакций лежит закон Гесса: тепловой эффект реакции (∆Нр) не зависит от пути его протекания, а определяется только природой и физическим состоянием исходных веществ и конечных продуктов. Закон Гесса имеет два практически важных следствия. Согласно одному из них: тепловой эффект реакции равен сумме теплот образования продуктов реакции за вычетом суммы теплот образования исходных веществ: ∆Нр=∑∆Нобр.прод.- ∑∆Нобр.исх. с учётом числа молей всех участвующих в реакции веществ. Согласно другому следствию, термохимические уравнения можно складывать, вычитать и умножать на численные множители. Пример 1. Вычислить тепловой эффект реакции: С2Н5ОН(ж)+3О2(г)=2СО2(г)+3Н2О(ж); ∆Н-? Решение: В соответствии с законом Гесса тепловой эффект реакции рассчитывается по уравнению: ∆Нр=[2∆H0oбр СО2(г)=3∆Н0обрН2О(ж)]-[∆H0обрС2Н5ОН(ж)+3∆Н0обрО2(г)]. Используя значения стандартных энтальпий (теплот) образования указанных веществ (см.приложение 1), вычисляем ∆Нр: ∆Нр=2(-393,5)+3(-285,8)+276,6 - 3. 0=-1366,9 кДж/моль Пример 2. Исходя из теплоты образования газообразного диоксида углерода ∆Н0обрСО2(г)=-393,5 кДж/моль и термохимического уравнения: С(графит)+2N2O(г)=СО2(г)+2N2(г); ∆Н0=-557,5 кДж/моль, вычислите теплоту образованияN2O(г). Решение: В соответствии с законом Гесса: ∆Нр=[∆H0обрСО2(г)+2∆Н0обрN2(г)]-[∆H0обрС(графит)+2∆Н0обрN2O(Г)]. Отсюда: ∆Н0обрN2O(г)=1/2[∆H0обрСО2(Г)+2∆Н0обрN2(Г) - ∆Н0обрС(графит) - ∆Нр] = = 1/2[ (-393,5) + 2. 0 – 0 –(-557,5) ]= =+82,0 кДж/моль. Теплотой (энтальпией) сгорания вещества является тепловой эффект реакции окисления кислородом одного моля данного вещества до СО2(Г) и Н2О(Ж); При этом у остальных элементов в каждом конкретном случае указывают продукты их окисления, а стандартные теплоты сгорания высших оксидов и кислорода принимают равными нулю. Стандартная теплота (энтальпия) сгорания обозначается как ∆Н0298 сгор. измеряется в кДж/моль. Тепловой эффект реакции равен разности между суммой теплот сгорания исходных веществ и суммой теплот сгорания конечных продуктов: ∆Нр= ∑ (∆Н0сгор.) исх. - ∑ (∆Н0сгор.) прод. Энтропия S и её изменение 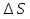 . .Мерой разупорядоченности или хаотичности системы в термодинамике служит энтропия . В изолированных системах самопроизвольно могут протекать процессы, сопровождающиеся увеличением энтропии, S2 > S1 или ∆S >0. Энтропия зависит от всех видов движения частиц, составляющих систему, их количества, числа степеней свободы и возрастает с повышением температуры. Поэтому в процессах, вызываемых увеличением движения частиц, т.е. при нагревании, испарении, плавлении, разрыве связей между атомами и т.п., энтропия возрастает. Наоборот, упрочнение связей, охлаждение, конденсация, кристаллизация, полимеризация, т.е. процессы, связанные с упорядочением системы, сопровождаются уменьшением энтропии. Энтропия пропорциональна также массе вещества. Её обычно относят к молю вещества и выражают в Дж/моль К. Энтропия, отнесённая к стандартной температуре 25 C ( 298 K ) и стандартному давлению (1 атм), называется стандартной ( S0). ∆S = S2 - S1 Энергия Гиббса G и её изменение 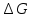 при Р- const и T- const. при Р- const и T- const.С учётом одновременного действия этих двух противоположных факторов такой движущей силой (функцией состояния) для реакций, протекающих при постоянной температуре и давлении, является энергия Гиббса (G), называемая также изобарно – изотермическим потенциалом, или свободной энергией. В качестве критерия для определения направления самопроизвольного протекания химических процессов используется изменение энергии Гиббса ∆G (∆ G = G2 – G1). В зависимости от знака её изменения возможны три случая
Отсутствие изменения энергии Гиббса является термодинамическим условием установления химического равновесия в реакционной системе. Энергия Гиббса связана с энтальпией, энтропией и температурой: ∆G = ∆H – T• ∆ S Стандартная энергия Гиббса образования простых веществ условно принимается равной нулю. |
