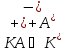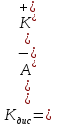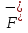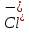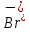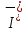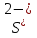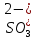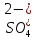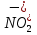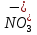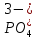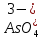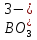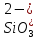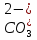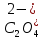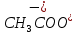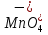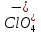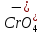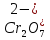Приготовьте два небольших приблизительно одинаковых кусочка мела. Один из них разотрите пестиком на кусочке бумаги и пересыпьте в коническую пробирку, второй целиком поместите в другую пробирку. В обе пробирки одновременно добавьте по 15—20 капель концентрированной соляной кислоты (пл. 1,19 г/см3). Напишите уравнение реакции. Отметьте наблюдаемые явления и объясните их. Какой фактор в данном случае влияет на увеличение скорости реакции?
Лабораторная работа № 3
Приготовление растворов с заданной концентрацией
Рассчитать количество вещества и объем воды, необходимый для приготовления следующих растворов:
200 г 15%-го раствора хлорида натрия;
250 г 10%-го раствора карбамида;
350 г 12%-го раствора аммиачной селитры;
400 г 7%-го раствора нитрата натрия.
Приготовить раствор.
С помощью ареометра измерить плотность раствора.
Рассчитать молярную концентрацию раствора.
Заполнить таблицу.
Таблица
-
Масса вещества, г
|
Объем воды, мл
|
Плотность раствора, г/см3
|
t, 
|
Молярная концентрация, моль/л
|
|
|
|
|
|
Лабораторная работа № 4
Определение характера среды растворов с помощью индикаторов
Для каждого индикатора подготовьте две пробирки: одну с 0,01 н. НCl, другую – с 0.01н раствором NaOH (2 мл). Внесите в каждую пробирку по две капли индикатора. Перемешайте. Запишите цвет, оценку рН в следующую таблицу
Таблица
Индикатор
|
Цвет /рН
Кислый раствор
|
Щелочной раствор
|
Метиловый красный
Метиловый оранжевый
Фенолфталеин
Лакмус
|
|
|
2.Определение рН исследуемого раствора. Получите у преподавателя задание (раствор соли, кислоты, основания). Определите рН раствора с помощью универсальной индикаторной бумаги, рН- метра . По найденной величине рН (найденной с помощью рН- метра) оцените степень диссоциации раствора.
Лабораторная работа №5
Определение характера среды в растворах солей.
Поместите в чистые пробирки 5-6 капель каждого из предложенных растворов солей, внесите по две капли индикатора и зафиксируйте значения рН. Заполните таблицу и напишите уравнения гидролиза каждой соли.
Таблица
Раствор
|
Окраска индикаторов
|
Значения рН
(>или<7)
|
Метиловый оранжевый
|
Фенолфталеин
|
Лакмус
|
Na2CO3
CrCl3
Na2SiO3
NaCl
|
|
|
|
|
Лабораторная работа №6
Окислительно – восстановительные реакции
Зависимость характера продуктов окислительно восстановительной реакции от рН среды
Уравнять реакции методом электронного баланса, расставить коэффициенты.
Отметить изменение цвета раствора после добавления реактива.
KMnO4 + H2SO4 + Na2SO3 → K2SO4 + MnSO4 + Na2SO4 + H2O
KMn04 + H2O + Na2SO3 → MnO2 ↓ + Na2SO4 + KOH
KMnO4 + KOH + Na2SO3 → K2MnO4 + Na2SO4 + H2O
При избытке Na2SO3
K2MnO4 + Na2SO3 + H2O → K2SO4 + MnO2 ↓ + NaOH
K2Cr2O7 + H2SO4 + Na2SO3 →K2SO4 + Na2SO4 + Cr2(SO4)3 + H2O
K2Cr2O7 + H2SO4 + KJ → K2SO4 + Cr2(SO4)3 + J2 + H2O
KMnO4 + MnSO4 + H2O → MnO2 ↓ + K2SO4 + H2SO4
Приложение 1
Названия важнейших кислот и солей
-
Кислота
|
Соль
|
формула
|
название
|
анион
|
название
|
HF
|
Фтороводородная (плавиковая)
|
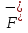
|
Фторид
|
HCl
|
Хлороводородная (соляная)
|
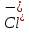
|
Хлорид
|
HBr
|
Бромоводородная
|
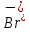
|
Бромид
|
HI
|
Иодоводородная
|
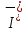
|
Иодид
|
H2S
|
Сероводородная
|
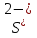
|
Сульфид
|
H2SO3
|
Сернистая
|
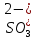
|
Сульфит
|
H2SO4
|
Серная
|
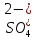
|
Сульфат
|
HNO2
|
Азотистая
|
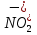
|
Нитрит
|
HNO3
|
Азотная
|
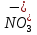
|
Нитрат
|
H3PO4
|
Фосфорная (орто)
|
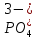
|
Ортофосфат
|
H3AsO4
|
Ортомышьяковая
|
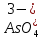
|
Ортоарсенат
|
H3BO3
|
Ортоборная
|
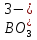
|
Ортоборат
|
H2SiO3
|
Кремневая
|
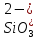
|
Силикат
|
H2CO3
|
Угольная
|
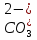
|
Карбонат
|
H2C2O4
|
Щавелевая
|
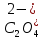
|
Оксалат
|
CH3COOH
|
Уксусная
|
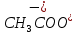
|
Ацетат
|
HMnO4
|
Марганцевая
|
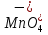
|
Перманганат
|
HClO4
|
Хлорная
|
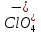
|
Хлорат
|
H2CrO4
|
Хромовая
|
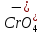
|
Хромат
|
H2Cr2O7
|
двухромовая
|
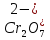
|
Дихромат
|
Приложение 2
Произведения растворимости малорастворимых в воде веществ при 25 º С
-
Вещество
|
ПР
|
Вещество
|
ПР
|
AgBr
|
7,7 ·10-13
|
CdS
|
1 ·10-29
|
AgCN
|
2,0 ·10-12
|
Co(OH)2
|
2 ·10-16
|
AgSCN
|
1 ·10-12
|
Cu2S
|
2,5 ·10-50
|
AgCl
|
1,6 ·10-10
|
CuS
|
4 ·10-38
|
Ag2CO3
|
6,2 ·10-12
|
FeCO3
|
2,5 ·10-11
|
Ag2CrO4
|
4,05 ·10-12
|
Fe(OH)2
|
4,8 ·10-16
|
AgI
|
1 ·10-16
|
Fe(OH)3
|
4 ·10-38
|
BaCO3
|
8,0 ·10-9
|
FeS
|
4 ·10-19
|
BaC2O4
|
1,7 ·10-7
|
Hg2Cl2
|
2 ·10-18
|
BaCrO4
|
2,3 ·10-10
|
Mg(OH)2
|
5 ·10-12
|
BaSO4
|
1,1 ·10-10
|
MgS
|
2,0 ·10-15
|
CaCO3
|
4,8 ·10-9
|
Mn(OH)2
|
4 ·10-14
|
CaC2O4
|
2,5 ·10-9
|
MnS
|
1,4 ·10-15
|
CaSO4
|
6,1 ·10-5
|
NiCO3
|
1,4 ·10-7
|
Ni(OH)2
|
7 ·10-14
|
Sb2S3
|
1,0 ·10-30
|
PbCO3
|
1,5 ·10-13
|
H2SiO3
|
1,0 ·10-10
|
PbCl2
|
1,7 ·10-5
|
SnS
|
1 ·10-28
|
PbCrO4
|
1,7 ·10-13
|
SrCO3
|
1,0 ·10-9
|
PbI2
|
8,7 ·10-9
|
SrC2O4
|
5,6 ·10-8
|
Pb(OH)2
|
2 ·10-16
|
SrSO4
|
2,8 ·10-7
|
PbS
|
1 ·10-29
|
Zn(OH)2
|
5 ·10-17
|
PbSO4
|
2 ·10-8
|
ZnS
|
8 ·10-26
|
Приложение 3
Константы диссоциации кислот и оснований
 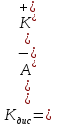
Соединение
|
Формула
|
|
Азотистая
|
HNO2
|
5,1·10-4
|
Кремневая
|
H2SiO3
|
2,2· 10-10 (К1)
1,6 ·10-12 (К2)
|
Муравьиная
|
HCOOH
|
1,7· 10-4
|
Сернистая
|
H2SO3
|
1,3·10-2 (К1)
6,3· 10-8 (К2)
|
Сероводородная
|
H2S
|
8,9 ·10-8
1,3 ·10-13
|
Синильная
|
HCN
|
4,9 ·10-10
|
Угольная
|
Н2СО3
|
4,5· 10-7 (К1)
4,7· 10-11 (К2)
|
Уксусная
|
CH3COOH
|
1,7 ·10-5
|
Фосфорная
(орто)
|
H3PO4
|
7,6·10-3
6,2·10-8
4,4·10-13
|
Щавелевая
|
H2C2O4
|
5,6·10-2 (К1)
5,1·10-5 (К2)
|
Гидроксид аммония
|
NH4OH
|
6,3 ·10-5
|
Гидроксид
бария
|
Ba(OH)2
|
2,3 ·10-1
|
Гидроксид кальция
|
Ca(OH)2
|
4,3·10-2 (К2)
|
Гидроксид магния
|
Mg(OH)2
|
2,5·10-3 (К2)
|
Гидроксид
меди
|
Cu(OH)2
|
3,4·10-7 (К2)
|
Гидроксид серебра
|
AgOH
|
1,1·10-4
|
Гидроксид
хрома
|
Cr(OH)3
|
1,02·10-10 (К3)
|
Гидроксид
цинка
|
Zn(OH)2
|
4,0·10-5 (К2)
|
Гидроксид
марганца
|
Mn(OH)2
|
5,0·10-4 (К2 )
|
Гидроксид
никеля
|
Ni(OH)2
|
2,5·10-5 (К2 )
|
Гидроксид
железа
|
Fe(OH)3
|
1,35·10-12 (К3 )
|
Гидроксид
алюминия
|
Al(OH)3
|
1,38·10-9 (К3 )
|
|
 Скачать 0.63 Mb.
Скачать 0.63 Mb.