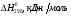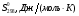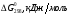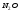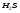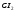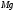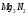Приложение 4 Приложение 5Ряд напряжения металлов Приложение 5Ряд напряжения металлов
Электрод ВФ/ОФ
|
Приэлектродная реакция
ОФп+ + n·ē← ВФ
|
Ео, В
|
Li /Li+
|
Li+ + ē → Li
|
-3,05
|
Ca /Ca2+
|
Ca2+ + 2 ē → Ca
|
-2,87
|
Mg /Mg2+
|
Mg2+ + 2 ē → Mg
|
-2.36
|
Al /Al3+
|
Al3+ + 3 ē → Al
|
-1,66
|
Mn/Mn2+
|
Mn2+ + 2 ē → Mn
|
-1,18
|
Zn/Zn2+
|
Zn2+ + 2 ē → Zn
|
-0,76
|
Cr/Cr3+
|
Cr3+ + 3 ē → Cr
|
-0,74
|
Fe/Fe2+
|
Fe2+ + 2 ē → Fe
|
-0,44
|
Co/Co2+
|
Co2+ + 2 ē → Co
|
-0,28
|
Ni/Ni2+
|
Ni2+ + 2 ē → Ni
|
-0.25
|
Pb/Pb2+
|
Pb2+ + 2 ē → Pb
|
-0,13
|
H2/2H+
|
2H+ + 2 ē → H2
|
0
|
Cu/Cu2+
|
Cu2+ + 2 ē → Cu
|
+0,34
|
Aq/Aq+
|
Aq+ + ē → Aq
|
+0,80
|
Hq/Hq2+
|
Hq2+ + 2 ē → Hq
|
+0,85
|
Au/Au+
|
Au+ + ē → Au
|
+1,70
| Приложение 6Стандартные термодинамические потенциалы образования некоторых химических веществ
Вещество
|
Состоя-
ние
|
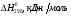
|
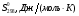
|
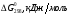
|
BaO
|
K
|
-558,6
|
70,6
|
-528,4
|
BaCO3
|
K
|
-1218,0
|
112,6
|
-1138,8
|
BeO
|
K
|
-600,6
|
14,5
|
-581,6
|
BeCO3
|
K
|
-1012,0
|
|
-944,7
|
C
|
Графит
|
0
|
5,4
|
0
|
С
|
Алмаз
|
1,8
|
2,4
|
2,55
|
CH4
|
Г
|
-74,9
|
186,2
|
-50,8
|
C2H2
|
Г
|
226,8
|
200,8
|
209,2
|
C2H4
|
Г
|
52,3
|
219,7
|
68,1
|
C2H6
|
Г
|
- 89,67
|
229,5
|
- 32,9
|
C6H6
|
Ж
|
82,9
|
269,2
|
129,7
|
С8Н18
|
Ж
|
-250,0
|
361,2
|
|
C2H3OH
|
Ж
|
-201,2
|
126,8
|
-
|
C2H5OH
|
Ж
|
-276,6
|
160,7
|
-174,8
|
CO
|
Г
|
-110,5
|
197,5
|
-137,1
|
CO2
|
Г
|
-393,5
|
213,7
|
-394,4
|
CaO
|
К
|
-635,5
|
397
|
-604,2
|
Ca(OH)2
|
К
|
-986,6
|
76,1
|
-896,8
|
CaCO3
|
К
|
-1207,0
|
88,7
|
-1129,7
|
Ca3(PO4)2
|
К
|
-4142,0
|
242,0
|
-3867,3
|
Fe
|
К
|
0
|
27,15
|
0
|
Fe3O4
|
К
|
-1120,9
|
146,4
|
-1014,2
|
FeO
|
К
|
-270,0
|
55,2
|
-244,3
|
Fe2O3
|
К
|
-828,2
|
82,4
|
-740,3
|
H2
|
Г
|
0
|
131,0
|
0
|
H2O
|
Г
|
-241,8
|
188,7
|
-228,9
|
H2O
|
Ж
|
-285,8
|
70,1
|
-237,3
|
HCl
|
Г
|
-92,3
|
186,8
|
-95,1
|
N2
|
Г
|
0
|
191,5
|
0
|
NH3
|
Г
|
-46,2
|
192,6
|
-16,7
|
NO
|
Г
|
90,3
|
210,6
|
88,6
|
NO2
|
Г
|
33,5
|
240,2
|
51,5
|
C2H3OH
|
Ж
|
-201,2
|
126,8
|
-
| Стандартные термодинамические потенциалы образования некоторых химических веществПродолжение
1
|
2
|
3
|
4
|
5
|

|
Г
|
83,3
|
307,0
|
140,5
|
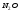
|
Г
|
82,0
|
219,9
|
104,1
|
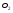
|
Г
|
0
|
205,0
|
0
|
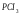
|
Г
|
-273,1
|
312,1
|
-286,2
|

|
Г
|
-369,4
|
352,7
|
-324,6
|
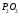
|
К
|
-1492,0
|
114,5
|
-1348,8
|
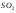
|
Г
|
-296,0
|
248,1
|
-300,2
|

|
Г
|
-395,8
|
256,7
|
-371,2
|
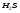
|
Г
|
-435,9
|
82,6
|
-408,0
|
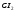
|
Г
|
0
|
222,9
|
0
|

|
Г
|
-92,3
|
186,8
|
-95,2
|
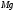
|
К
|
0
|
32,5
|
0
|
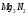
|
К
|
-461,1
|
87,9
|
-400,9
| Литература
Коровин Н.В. Курс общей химии/ Коровин Н.В. // Москва, Высш. шк.,- 2003.-557 с.
Хомченко Г.П. Неорганическая химия/ Хомченко Г.П., Цитович И.К // Москва, Высш. шк.-1987.- 463 с.
Глинка Н.Г. Задачи и упражнения по общей химии/ Глинка Н.Г. // Москва, «Химия» - 1980.
Платонов Ф.П. Практикум по неорганической химии / Платонов Ф.П., Дейлова З.Е.//Москва Высш. шк.-1985. – 252 с.
Практикум по общей химии/ Под редакцией д. х. н. профессора Глебова А.Н., - 5е изд.// Казань, «Экоцентр» - 2006. – 92 с.
Князев Д.А. Неорганическая химия. / Князев Д.А., Смарыгин С.Н. //Москва, «Дрофа» - 2005 – 591 с.
Артеменко А.И. Справочное руководство по химии. / Малеванный В.А., Тикунова И.В. // Москва Высш. шк.-1990. – 303 с.
Рабинович В.А. Краткий химический справочник/ Хавин З.Я.// Ленинград «Химия»-1991-432с.
|
1.Основные классы неорганических соединений
|
3
|
Основные понятия и законы химии
|
6
|
3.Строение атома и периодический закон
3.1.Строение атома и радиоактивность
|
9
|
Периодический закон и система Д.И. Менделеева
Свойства элементов
|
12
|
Кинетика и равновесие химических реакций.
Химическая кинетика.
|
13
|
4.2. Химическое равновесие
|
13
|
5. Химическая термодинамика
|
15
|
6. Растворы
|
21
|
6.1. Способы выражения концентраций растворов
|
21
|
6.2. Коллигативные свойства растворов
|
23
|
7.Теория электролитической диссоциации и гидролиз солей.
7.1. Электролитическая диссоциация и рН растворов
|
24
24
|
Слабые электролиты. Константа и степень диссоциации
|
27
|
7.3.Обменные реакции в растворах электролитов. Гидролиз солей
|
28
|
Произведение растворимости и растворимость малорастворимых солей и оснований
|
32
|
9. Окислительно – восстановительные реакции
|
34
|
10.Электрохимические процессы и системы
|
39
|
Порядок работы в химической лаборатории
|
44
|
Лабораторные работы
|
46
|
Приложения
|
51
|
Литература
|
58
|
|
| СОДЕРЖАНИЕ |
 Скачать 0.63 Mb.
Скачать 0.63 Mb.