Ответы ординатура БАКТЕРИОЛОГИЯ. Правила работы и поведения в бактериологической лаборатории общего назначения
 Скачать 1.49 Mb. Скачать 1.49 Mb.
|
|
Определение микробного числа воды. Водопроводную воду засевают в количестве 1мл, воду открытых водоемов — по 1,0; 0,1; 0,01 мл. Все пробы вносят в стерильные чашки Петри, после чего их заливают 10...12 мл расплавленного и охлажденного до 40...45 °С питательного агара, который тщательно перемешивают с водой. Посевы инкубируют при 37 °С в течение 1...2сут. Воду из открытых водоемов засевают параллельно на две серии чашек, одну из которых инкубируют при 37 ºС в течение суток, другую — 2 сут при 20 °С. Затем подсчитывают количество выросших на поверхности и в глубине колоний и вычисляют микробное число воды — количество микроорганизмов в 1 мл. Определение коли-титра и коли-индекса воды. Минимальное количество воды в мл, в котором обнаруживают бактерии группы кишечных палочек (БГКП), называют коли-титром воды, количество БГКП, содержащихся в 1л исследуемой воды, называют кол и-и ндексом воды. Коли-титр и коли-индекс воды определяют титрационным (бродильным) методом или методом мембранных фильтров. Титрационный метод. В глюкозо-пептонную среду (1%-я пептонная вода, 0,5%-й раствор хлорида натрия, 0,5%-й раствор глюкозы, индикатор Андреде и поплавок) проводят посевы различных объемов воды. Воду открытых водоемов исследуют в объемах 100; 10; 1 и 0,1 мл. Для анализа водопроводной воды делают посевы трех объемов по 100 мл, трех объемов по 10 мл и трех объемов по 1 мл. Посевы инкубируют при 37 °С в течение суток. О брожении судят по образованию пузырьков газа в поплавке. Из забродивших или помутневших проб делают посевы на среду Эндо. Из выросших колоний готовят мазки, окрашивают по Граму и ставят оксидазный тест, с помощью которого дифференцируют бактерии родов Escherichia, Citrobacter и Enterobacter от грамотрицательных бактерий семейства Pseudomonadaceae и других оксидазоположительных бактерий, обитающих в воде. С этой целью 2...3 изолированные колонии наносят «штрихом» на фильтровальную бумагу, смоченную диметил-n-фенилендиамином. При отрицательном оксидазном тесте цвет бумаги не изменяется, при положительном она окрашивается в синий цвет в течение 1 мин. Грамотрицательные палочки, не образующие оксидазу, вновь исследуют в бродильном тесте — вносят в полужидкий питательный агар с 0,5 % глюкозы и инкубируют при 37 °С в течение суток. При положительном результате определяют коли-титр и коли-индекс по статистической таблице. Метод мембранных фильтров. Определенный объем воды пропускают под давлением через мембранный фильтр № 3, предварительно стерилизованный кипячением в дистиллированной воде. Водопроводную воду и воду артезианских скважин фильтруют в объеме 333 мл. Чистую воду открытых водоемов фильтруют в объеме 100, 10, 1 и 0,1 мл, более загрязненную воду перед фильтрованием разводят стерильной водой. Фильтры накладывают на агар Эндо в чашки Петри и после инкубации при 37 °С в течение суток подсчитывают количество выросших красных колоний. Из двух-трех колоний делают мазки, окрашивают их по Граму и ставят оксидазный тест. Грамотрицательные палочки, не образующие оксидазу, принадлежат к БГКП. По существующим нормативам (ГОСТ 2874—82) питьевую воду считают качественной, если ее коли-индекс не более 3, а микробное число — не более 100. 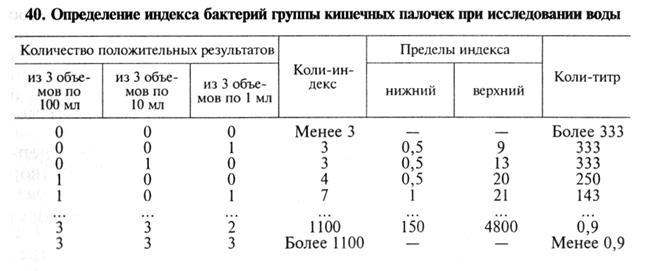 Общепринятым дополнительным показателем фекального загрязнения воды служит количество S.faecalis. Для определения его титра цельную воду и ее 10-кратные разведения засевают в жидкую элективную среду (щелочная полимиксиновая среда). После инкубирования при 37 ºС в течение двух суток, а затем еще через сутки и двое суток делают высевы на плотные элективные среды. Фекальные стрептококки идентифицируют по морфологическим, культуральным и тинкториальным свойствам. Есть данные о корреляции между содержанием в воде фекальных кишечных палочек и фагами бактерий группы кишечных палочек. Поэтому определение данных фагов служит косвенным показателем возможного присутствия кишечных палочек в исследуемой пробе воды. Санитарно-микробиологическое исследование воздуха. Микрофлора воздуха зависит от микрофлоры почвы и воды. Воздух — неблагоприятная среда для обитания микроорганизмов из-за отсутствия питательных веществ, действия солнечных лучей, высушивания. Наряду с сапрофитами в воздухе могут находиться патогенные бактерии, споры грибов родов Aspergillus, Mucor и др. Санитарную оценку воздуха осуществляют по двум показателям: 1) определение микробного числа воздуха; 2) определение количества санитарно-показательных бактерий — гемолитических стрептококков и стафилококков. Количественные микробиологические методы исследования воздуха основаны на принципах осаждения (седиментации), аспирации или фильтрации. Седиментационный метод осаждения Коха. Чашки Петри с МПА оставляют открытыми на 5...10 мин. Для определения санитарно-показательных бактерий берут чашки Петри с кровяным МПА и время экспозиции увеличивают до 40 мин. Чашки выдерживают при 37 °С и комнатной температуре 24 ч и подсчитывают выросшие колонии. Микробное число воздуха (общее количество бактерий в 1 м3) определяют по формуле Омелянского Х= а * 100 * 1000 * 5 / (b * 10 * T), где X— количество микробов в 1 м3 (1000 л) воздуха; а — количество выросших колоний в чашках; b — площадь чашки; Т— время, в течение которого чашка была открыта; 5 — время по правилу Омелянского; 10 — объем воздуха в литрах. (Правило Омелянского предусматривает, что на поверхности агара в чашке Петри площадью 100 см3 за 5 мин из воздуха оседает такое количество микробов, которое находится в его 10 л.) Прямое обнаружение патогенных микробов воздуха проводят только при специальных показаниях.  Аспирационный метод. Более точный количественный способ определения микробного числа воздуха, так как посев микроорганизмов из воздуха производят с помощью приборов. При использовании аппарата Кротова воздух с заданной скоростью засасывается через щель плексигласовой пластины и ударяется о поверхность питательной среды открытой чашки Петри, находящейся на вращающейся подставке, благодаря чему происходит равномерный посев бактерий из воздуха на поверхность МПА (при определении микробного числа) или кровяного МПА (при выделении гемолитических стафилококков и стрептококков). После инкубации в термостате в течение двух суток подсчитывают количество выросших колоний и определяют микробное число воздуха. При исследовании воздуха могут быть использованы и другие приборы (Дьякова, Киктенко, ПАБ-1 — прибор аэрозольный бактериологический и ПОВ-1 — прибор для отбора воздуха). В практику входят ускоренные методы индикации микрофлоры воздуха с помощью мембранных фильтров, каскадных им-пакторов, фильтров Петрякова и др. 57. Санитарная микробиология. Методы санитарно-биологической оценки почвы. Санитарно-микробиологическое исследование почвы. Анализ почвы включает в себя определение микробного числа, коли-тит-ра, перфрингенс-титра и титра термофильных бактерий. По эпидемиологическим признакам проводят определение в почве патогенных микроорганизмов: сальмонелл, шигелл, возбудителей столбняка, ботулизма, злокачественного отека, сибирской язвы. Бактериологический анализ почвы нужен при выборе территории под пастбище, ферму, хозяйственные постройки, детские сады, больницы и др. Предварительно делают отбор проб почвы. На обследуемой территории площадью до 1000 м3 выделяют два участка по 25 м3 (один — вблизи источника загрязнения, другой — в отдалении от него), берут пробы из 5 точек (4 — по углам участка, 1 — в центре) на глубине 10...20 см стерильным совком (из более глубоких мест — с помощью специального бура Некрасова или Френкеля). Пробы почвы по 200...300 г отбирают в широкогорлые стеклянные банки с ватными пробками (можно все взятые с одного участка пробы перемешать и на исследование направить 1 кг). На банки наклеивают этикетки, отправляют с нарочным и сопроводительным письмом. Пробы почвы полагается исследовать сразу же или в течение 6... 18 ч, сохраняя их при температуре не выше 1...5ºС. В лаборатории почву измельчают, освобождают от камней, осколков стекол, корней растений, просеивают через сито, тщательно перемешивают и отвешивают 30 г. В колбу на 500 мл наливают 270 мл стерильной водопроводной воды и вносят в нее отвешенную пробу почвы, все интенсивно встряхивают 10 мин, не давая отстояться частицам суспензии, готовят серию десятикратных последовательных разведений. Для относительно чистых почв достаточно 4 степени разведения, для загрязненных — 6...9 разведений. В штатив ставят нумерованные пробирки с 9 мл стерильной воды в каждой. В первую вносят 1 мл суспензии пробы почвы, смешивают, затем 1 мл из первой пробирки вносят во вторую, смешивают, из нее — 1 мл в третью и т. д. В результате в пробирке № 1 получается разведение 1 : 100, № 2 — 1 : 1000 и т.д. Подготовленные таким образом пробы почвы исследуют. Определение общего микробного числа. Из последних 3...4 пробирок с разведенной суспензией отдельными стерильными пипетками вносят по 1 мл в стерильные чашки Петри (каждое разведение в отдельности). В каждую чашку добавляют еще по 10... 15 мл расплавленного и охлажденного до 45 ºС МПА. Равномерными осторожными круговыми движениями содержимое чашек перемешивают, оставляют на столе для уплотнения (затвердения) агара. С застывшей средой чашки перевертывают вверх дном, надписывают и помещают в термостат для культивирования на 24...48 ч при 37 °С. Выросшие колонии подсчитывают в каждой чашке, умножают на степень разведения, полученные числа суммируют и вычисляют среднеарифметическое число, что составит количество микробов, содержащихся в 1 г почвы. Определение коли-титра, перфрингенс-титра и титра термофильных бактерий почвы. Для определения коли-титра почвы различные разведения почвенной взвеси засевают по 1 мл в пробирки со средой Кесслера (на 1л дистиллированной воды — 10г пептона, 50 мл бычьей желчи — 2,5 г лактозы, 4 мл 1%-го водного раствора генцианвиолета) и инкубируют при 43 ºС в течение 48 ч. В дальнейшем исследования проводят по схеме, применяемой при определении коли-титра воды. Наибольшее разведение почвенной суспензии, в котором отмечена ферментация лактозы (газообразование), соответствует коли-титру почвы. Для определения перфрингенс-титра почвы различные разведения почвенной суспензии по 1 мл засевают в пробирки со стерильным обезжиренным молоком или железосульфитной средой Вильсона— Блера, приготовленной ex tempore. Посевы инкубируют при 43 °С в течение 24...48 ч, после чего учитывают результаты по свертыванию молока или по образованию черных колоний С. perfringens в агаровом столбике среды Вильсона—Блера. Из колоний делают мазки, окрашивают по Граму, микроскопируют и вычисляют перфрингенс-титр, который соответствует наибольшему разведению почвы, вызвавшему почернение и разрыв среды Вильсона— Блера в первые 12 ч роста. Для определения титра термофильных бактерий разведения почвенной суспензии по 1 мл вносят в чашки Петри, заливают расплавленным и охлажденным агаром. Посевы инкубируют в течение суток при 60 ºС, а затем подсчитывают количество выросших колоний и пересчитывают на 1 г почвы. Санитарно-микробиологическую оценку почвы проводят по комплексу показателей, из которых наиболее важный ление степени фекального загрязнения.  |
