Биохимия. Предмет биохимии
 Скачать 0.58 Mb. Скачать 0.58 Mb.
|
ЭНЕРГИТИЧЕСКИЙ ОБМЕН.  В обычных тепловых машинах освобожденую энергию можно использовать по схеме: окисление тепло работа, при этом Т1 – Т2 где Т – температура.  КПД = Т1 Но в клетке разницы (Т1-Т2) нет, то-есть эта схема не пойдет. Работами В.А. Энгельгардта (1932 год), В.А. Белицера (1939 год) было установлено, что в процессе дыхания, при переносе электронов происходит образование АТФ. Это процесс получил название окислительное фосфорилирование. Принципы окислительного фосфорилирования заключаются в следующем: образование АТФ из АДФ и фосфорной кислоты сопряжено с процессом электронного транспорта, при котором электроны высокоэнергетического донора переносятся промежуточными переносчиками к терминальному акцептору электронов с образованием низкоэнергетического продукта. Такой тип реакций является общим для всех организмов и представляет собой универсальный биохимический принцип нашей биосферы. Необходимым условием процесса окислительного фосфорилирования в большинстве нефотосинтезирующих клеток является синтез высокоэнергетических доноров электронов, например, НАДН, ФАДН2, в ходе катаболизма. Принцип окислительного фосфорилирования применим и к фотосинтезирующим клеткам, но в этом случае он начинается с синтеза высокоэнергетических доноров электронов, отличных от НАДН, причем этот процесс происходит за счет световой энергии и его называют фотофосфорилирование. Таким образом, энергия, необходимая для синтза АТФ, берется за счет химической энергии, выделяющейся при переносе электронов по дыхательной цепочке.     Есть зависимость между процессами переноса электронов и изменением свободной энергии: F = - 23n E, где: F – свободная энергия (та часть, которая используется на работу). 23 – коэффициент. n – число электронов, переносимых на молекулу кислорода (их по дыхательной цепи переносится два).   Е – разность потенциалов. Для дыхательной цепи между НАДН (-0,32) и о/в кислородом (+0,82) = 1,14в. Следовательно F для дыхательной цепи при переносе двух электронов на кислород равна 52 ккал / моль.   Концепция: окисление синтез АТФ работа была сформулирована еще в 1941 году. С тех пор было сформулировано три теории окислительного фосфорилирования. 1) Химическая (предполагался химический посредник между окислением и синтезом АТФ, но его не нашли). 2) Конформационная (предполагалось, что ферменты, участвующие в окислении, меняют конформацию, переходя в возбужденное состояние, но это не объясняло весь механизм окислительного фосфорилирования ).   3) Хемиосмотическая (теория П.Митчелла): (1961) год в основе теории предлжено наличие целостных, непроницаемых для протонов мембран. Мембраны митохондрий состоит из внешней и внутренней мембраны. А окисление, как мы знаем, происходит на внутренней мембране митохондрий. В процессе дыхания (окисления), на одной стороне внутренней мембраые митохондрий (точнее, в межмембранном пространстве) концентрируются протоны, то-есть по обе стороны внутренней мембраны создается различная концентрация протонов, что приводит к возникновению двух сил: разности концентраций рН и, поскольку протон имеет заряд, разности потенциалов Фи. Сумма этих двух сил называется протон-движущей силой, или протонным поетнциалом:      рН + Ф = Н(+). То-есть по Митчеллу: окисление АТФ работа. Но, чтобы синтезировать АТФ из АДФ и Н3РО4, используя энергию протонного потенциала, нужен фермент. Давно была найдена АТФ-аза, которая катализирует гидролиз АТФ. Затем нашли протонную АТФ-азу, которая катализирует синтез АТФ. Ее называют иногда АТФ-синтетазой. Она отличается от обычной АТФ-азы тем, что имеет в своем составе дополнительных пять белков, которые способны проводить протоны через мембрану (через так называемые протонные каналы), способствуя синтезу АТФ. Протонная АТФ-аза встроена во внутренюю мембрану митохондрий   Внешняя        мембрана Протонный канал Внутренняя Мембрана По протонному каналу протоны резко устремляются из меж мембранного пространства в матрикс. Утолщение (на месте встроенной АТФ-азы) – это фосфорилирующая часть, где и идет активация АДФ и Н3РО4 (активируются протонами) и идет синтез АТФ. Процесс переноса электронов (дыхание) и образование АТФ прочно сопряжены. Принцип сопряжения состоит в том, что энергетически выгодная реакция связана с образованием продукта, которое само по себе не выгодно. То-есть по сути идет сопряжение энд- и экзэргонических реакций. Так, процесс переноса электронов (сопровождающийся выделением энергии, то-есть экзэргоническая реакция) в сопряжении с синтезом АТФ из АДФ и не органического фосфата (требующим затрат энергии, то-есть эндэргоническая реакция). Если в среде отсутствуют АДФ и Н3РО4, то прекращается перенос электронов (дыхание), а если внести в среду АДФ, то увеличивается потребление кислорода (это феномен называется дыхательный контрль). Для определения эффективности работы дыхательной цепи с процессом синтеза АТФ используется коэффициент Р/О, показывающий число молей Н3РО4, пошедших на синтез АТФ путем фосфорилирования АДФ при переносе двух электронов н кислород. Было показано, что в процессе переноса двух электронов по дыхательной цепи на кислород, коэффициент Р/О в идеальных условиях равен трем (это при полном сопряжении), то-есть образуется три молекулы АТФ. При этом утилизируется около 50% энергии (для синтеза АТФ), остальная идет на тепло. Молекулы АТФ синтезируются на определенных участках дыхательной цепи, которые называются участками дыхательной цепи, которые называются участками сопряжения. В длинной цепи – это 1), 3), 4), комплексы, в укороченной – 3), 4) – дыхательные комплексы. Регуляция окислительного фосфорилирования идет путем дыхательного контроля, то-есть большая концентрация АДФ ведет к повышению скорости переноса электронов, и, напротив, высокая концентрация АТФ снижает скорость переноса электронов, то-есть снижает потребление кислорода. Мы говорили, что Р/О в идеальных условиях равно трем. Но это в идеальных условиях. В то же время окислительное фосфорилирование может быть нарушено различными ингибиторами: 1) могут действовать ингибиторы на дыхательную цепь, нарушая передачу электронов (это разные ингибиторы на разные дыхательные комплексы – антимицин А и т.д. Мы о них уже говорили). 2) Действуют разобщители (то-есть вещества, не нарушающие окисление, а ингибирующие только процесс синтеза АТФ) – динитрофенол (ДНФ), молекулы жирных кислот. То-есть разобщителями становятся вещества (например, слабые кислоты), которые растворимы в жирах, так как они позволяют протонам самостоятельно проходить через мембраны, нарушая действие протон-движущей силы. Действие разобщителей подтверждают правильность хемиосмотической теории. Согласно этой теории для синтеза АТФ необходимо возникновение протонного потенциала, основой которго является появление разности концентраций Н(+) по обе стороны внутренней мембраны митохондрий. Нет протонного потенциала – нет и синтеза АТФ. Недавно открыт новый класс разобщителей (ионофоры) – некоторые из них являются антибиотиками. Ионофоры способны переносить протоны через мембраны, таким образом градиент протонов исчезает и синтез АТФ не будет сопряжен с переносом протонов через мембраны. Например, антибиотик валиномицин (представляет собй циклический пептид) способен специфически захватывать ионы калия и переносить их через мембрану. При этом переносятся и протоны что приводит к падению протонного потенциала и окислительного фосфорилирования соответственно. Антибиотик грамицидин (тоже пептид) способен играть роль разобщителя, связываясь с мембраной и образуя поры через которые могут проходить ионы калия, натрия и протоны водорода. Механизм действия динитрофенола тоже связан с его способностью связывать протоны свнешней стороны внутренней мембраны, то-есть из мембранного пространства и переносить их обратно в матрикс. Действие ингибиторв постоянно проиходит и при нормальной жизнедеятельности организма, так как процессы окислительного фосфорилирования очень четко регулируются в живом организме. Есть и физиологические процессы регулирования окислительного фосфорилирования. Чем больше сопряжение, тем больший процент свободной энергии утилизируется в АТФ и наоборот. Следовательно, ингибирование может регулировать выход тепла регулированием степени сопряжения. Регуляторами степени сопряжения могут быть гормоны (инсулин повышает, тироксин уменьшает), витамины (витамин Е увеличивает), продукты метаболизма (жирные кислоты уменьшаются). Многие болезни приводят к нарушению сопряжения (это приводит, например, к повышению температуры тела у больных). Обратите внимание: 1) полный процесс окислительного фосфорилирования (ОФ) протекает внутри митохондрий; 2) основная часть АТФ- зависимых процессов происходит вне митохондрий; 3) митохондриальная мембрана непроницаема для прямой диффузии АИФ. Каким же образом АТФ покидает митохондрии? Оказывается митохондриальная мембрана содержит специальный транспортный белок для выполнения этой функции. На каждую молекулу АТФ, переносимую из митохондрии в цитоплазму, приходится молекула АДФ, перносимая из цитоплазмы внутрь митохондрии. Утилизация         АДФ АТФ Внешняя мембрана     Транспортный      белок внутренняя мембрана  Н3РО4 + АДФ АТФ К нарушению энергообмена могут привести следующие причины: 1) Состояния, связанные с гипоксией. 2) Недостаток субстратов окисления. 3) Повреждение митохондрий (вследствие действия микробов, токсинов и т.д.). Метаболизм можно определить как совокупность всех химческих реакций, происходящих в живом организме. Число различных реакций у человека составляет до нескольких тысяч. Несмотря на разнообразие химических реакций, вполне отчетливо проявляется единство процессов метаболизма. Обычно процессы метаболизма делят на катаболические и анаболические. Катаболизм относится к последовательности реакций расщепления Анаболизм относится к последовательности реакций синтеза. Соединения, образующиеся в ходе метаболических реакций (в процессе перехода исходных веществ в конечный продукт) называются метаболитами или интермедиатами. Хотя катаболические и анаболические пути во многих отношениях различаются, тем не менее они тесно связаны друг с другом, это проявляется в следующем: 1) Реакции окисления-восстановления. Большинство стадий катаболического пути включают рекции окисления, в которых принимают участие окисленные формы ко-ферментов НАД(+), НАДФ(+) и реже ФАД(+), которые в результате восстанавливаются до НАДН, НАДФН и ФАДН2. В анаболических реакциях, а это, в основном, реакции восстановления, используются восстановленные формы этих ко-ферментов (в первую очередь НАДФН), сами же ко-ферменты в ходе этих реакций окисляются. 2) Энергетика реакций: катаболизм представляет собой экзэргонический процесс, требующий АДФ и происходящий с образованием АТФ. АТФ затем служит источником энергии в эндэргонических реакциях анаболизма, в ходе которых образуется АДФ. 3) Исходные соединения, конечные продукты и промежуточные метаболиты. Конечные продукты и метаболиты, образующееся в катаболических процессах, обычно служат исходными соединениями анаболических процессов и, наоборот, соединения, получаемые в ходе анаболических процессов могут быть исходными для катаболических путей. Все вышеуказанное позволяет сделать вывод, что катаболизм и анаболизм – это сопряженные, взаимодополняющие процессы. Общие пути катаболизма. Как известно основные органические вещества в клетке – белки, жиры, углеводы. Каждое из этих классов соединений в значительной мере отличается друг от друга по химическому составу, следовательно и пути синтеза и пути распада этих соединений отличаются друг от друга. Однако, необходимо отметить, что весь процесс клеточного метаболизма взаимосвязан и взаимозависим. Более того, процесыы катаболизма и анаболизма происходят одновременно, хотя и существуют сдвиги в сторону одного или другого процесса, в зависимости от потребности клетки. Общим же, связывающим звеном всех видов распада и синтеза является цикл лимонной кислоты (или цикл трикарбоновых кислот, или цикл Кребса). Ганс Кребс – определил последовательность реакций цикла. Рассмотрим процессы катаболизма. Чисто условно катаболизм основных органических веществ в организме делят на три этапа: 1) распад сложных органических веществ до мономеров (белки - аминокислоты, жиры – жирные кислоты плюс спирты, сложные углеводы - моносахара). Это специфичные пути катаболизма для каждого вида биомолекул. Энергия при этих процессах не образуется; 2) полученные на первом этапе продукты (аминокислоты, жирные кислоты и т.д.) превращаются в общие продукты катаболизма (ПВК и ацетил- КоА). Это тоже специфичные пути. При этих реакциях образуется некоторое количество энергии; 3) общие пути катаболизма. Так как различные органические соединения (белки, жиры, углеводы) имеют разную химическую структуру, то и распадаются они по-разному. Но на определенных этапах распада белков, жиров и углеводов образуются общие для всех видов распада соединения, которые либо запускают цикл Кребса, либо являются его интермедиатами. Так, углеводы при распаде превращаются в ПВК. Жирные кислоты – превращаются в ацетил - КоА. Различные аминокислоты превращаются в различные интермедиаты цикла Кребса и включаются в цикл на определенном этапе (например: аланин, треонин, глицин, цистеин, серин – превращаются в пируват; аспарагин – в оксалоацетат (ЩУК), тирозин – в фумарат; валин, метионин – в сукцинил-КоА; лейцин, изолейцин, триптофан – в ацетил-КоА и т.д.). Из всех указаных соединений, в которые превращаются белки, жиры и углеводы при распаде, только ПВК не является составной частью цикла Кребса. Однако ПВК превращается в ацетил-КоА под действием пируват ДГ-комплекса. Общую схему катаболизма мы можем представить так:     Белки Углеводы Жиры   Аминокислоты ПВК Глицерин Жирные    кислоты Ацетил КоА  Цикл Кребса  СО2 + НОН + Энергия. Таким образом, общими путями катаболизма мы можем назвать цикл Кребса и, в какой-то мере, превращение ПВК в ацетил КоА. Окислительное декарбоксилирование ПВК. Большинство аэробных организмов использует углеводы в качестве основного источника углерода и энергии в ходе совместных процессов цикла Кребса и гликолиза. Сопряжение этих двух путей происходит на уровне превращения  ПВК ацетил КоА, катализируемого в митохондриях пируватдегидрогеназным комплексом (ПДК). Хотя пируват, как мы уже видели может образоваться и в ходе распада белков и жиров. ПВК образуется, в основном, в цитозоле, а реакция перехода ПВК в ацетил КоА имеет место в митохондриях. ПВК транспортируется в митохондрии с помощью специальных переносчиков. В ходе этой реакции проиходит образование тиоэфира (ацетил КоА) и окислительное декарбксилирование альфа-кето (ПВК). Полученный в результате реакции ацетил КоА поступает в цикд Кребса, где и распадается до СО2, НОН, SH-КоА + энергия. Общая схема реакции: СН3 СН3 | ПДК |  C=O + HAD(+) + HS-KoA C=O + HADH + CO2 + H | | COOH S – KoA ПВК Ацетил КоА. ПДК состоит из трех различных ферментов, которые используют 5 различных ко-ферментов. Е1 – ПВК-ДГ (ее называют так же пируватдекарбоксилаза). В качестве ко-фермента служит тиаминпирофосфат (фосфорилирванная форма витамина В1 - тиамина). Е1 катализирует декарбоксилирование ПВК, причем ацетильная группа переносится на тиамин пирофосфат.   NH2 N+ CH3        N __CH2 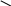   CH2 – CH2 – P – P S CН3 Тиаимнпирофосфат В этой реакции принимают участие ионы магния. При недостатке витамина В1 в тканях накапливаются кетокислоты, возникает дефицит НАДФН2 что приводит к первичной дегенерации нервной ткани(антиневритный витамин) – поражаются органы движения (развивается мышечная атрофия, контрактуры конечностей), нарушена чувствительность, ослаблена работа сердечно-сосудистой системы, развиваются отеки, появляется чувство страха, галлюцинации, снижается интеллект, то-есть симптомы болезни бери-бери (хотя, точнее, бери-бери развивается при дефиците комплекса витаминов группы В). Кроме указанной реакции, витамин В участвует в транскетолазной реакции ПФП окислении углеводов. Участвует в окислительном декарбоксилировании других кислот. Содержится витамин В1 в дрожжах, желтке куриного яйца, злаках, печени и т.д. Сутчная потребность 1-2 мг. Е2 – дигидролипоилтрансацетилаза. В качестве ко-фермета использует липоевую кислоту. Липоевоя кислота представляет собой низкомолекулярную серусодержащиую карбоновую кислоту, содержащую в качестве активной группировки две сульфгидрильных тиогруппы (они могут быть представлены в виде дисульфидног мостика – S – S - )  +2H  СН2 – СН2 – СН – (СН2)4 – СООН СН2 – СН2 – СН – (СН2)4 – СООН | | - 2H | |  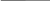 S S SH SH Липоевая кислота. Липоевая кислота в качестве ко-фермента участвует в реакциях двух типов: либо перенос атомов водорода, либо перенос ацильной группы. Е2 (имея ко-ферментом липоевую кислоту) катализирует перенос ацетильной группы с тиамин-пирофосфата на липоевую кислоту. Ацитилированная липоевая кислота затем атакуется HS-КоА, в результате чего образуется ацетил КоА и восстанавливается трансацитилаза-липоат. КоА состоит из аденина, рибозы, трех остатков фосфорной кислоты, пантатеновой кислоты и тиоэтанолаимна. Тиоэтаноламин – пантатеновая кислота – фосфорная кислота – фосфорная кислота – 5` - рибоза - аденин | 3` - фосфорная кислота Пантатеновая кислота (витамин В3) СН3 | СН2 – С – СН – СО – NH – CH2 – CH2 - COOH | | | ОН СН3 СН3 (АЛЬФА, ГАММА –диокси, бета, бетабутерил – бета - аланин ). КоА участвует в активировании и переносе ацильных и ацитильных остатков, в распаде жирных кислот, холестерина, ацетилхолина и в синтезе этих же соединений. При недостаточности витамина В3 развивается дерматит, дистрофия, поражается сердечно-сосудистая система, отмечается выпадение волос и т.д. Е3 – дегидролипоил ДГ – способствует реакислению восстановленной формы дегидролипоилтрансацетилазы. Представляет собой ФАД-содержащий флафопротеин. Восстановленная форма флавопротеина окисляется с участием НАДН(+), играющего роль акцептора водорода .Таким образом в ходе окислительного декарбоксилирования ПВК образуется ацетил КоА (который поступает в цикл Кребса) и НАДН (который поступает в дыхательную цепь и может дать энергию в процессе переноса электронов по цепи, достаточную для синтеза трех молекул АТФ). Арсенаты, а так же ионы ртути образуют комплексы с тиогруппами липоевой кислоты и ингибируют пируваДГ. Активность пируватДГ уменьшается и при недостатоочном содержании в диете тиамина, это может привести к накоплению ПВК. Недостаток тиамина возникает, например, у алкоголиков с нарушенным режимом питания, при введении им глюкозы может происходить быстрое оьразование ПВК и лактата, приводящие к лактатоцидозу (возможен летальный исход). Отмечена и наследственная недостаточность ПВК ДГ. ПВК ДГ комплекс ингибирует АТФ, НАДН и активируется АДФ и НАД+ Цикл Кребса. Практически во всех оганизмах цикл Кребса выступает в роли центрального метаболического пути углерода, входящего в состав всех остальных классов биомолекул, а также, совместно с процессом ОФ обеспечивает основной источник метаболической энергии в форме АТФ. Цикл лимонной кислоты состоит из 8 стадий (работают 8 ферментов). Начинается он с конденсации оксалоацетата (ЩУК) с ацильным остатком ацетил КоА с образованием цитрата и оканчивается опять-таки образованием ЩУК CH3 COOH COOH COOH | | +HOH; HS-KoA | - HOH | НОН    C=O + CH2 CH2 CH2   | | цитратосинтаза | аконитатгидро- | S-KoA C=O HO – C - COOH таза (акомитаза) C – COOH Аконитатгидротаза Ацетил | | || КоА COOH CH2 CH ЩУК | | COOH COOH Лимонная Цис-аконитовая Кислота кислота COOH COOH COOH ГТФ  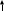 | HAD + HADH2 | HAD+ HADH2 +HSKoA | +НОН     CH2 -CO2 CH2 -CO2 CH2 ГДФ+ФК -НSKoA  | | |   CH-COOH цитрат ДГ СН2 Адьфа-кетоглютарат С Н2 сукцинил КоА | | ДГ-комплекс | синтетаза CHOH C=O C=O(сукцинилтиокиназа) | | | COOH COOH S-KoA Изолимонная альфа-глутаровая Сукценил КоА Кислота кислота СООН СООН СООН 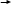  | ФАД ФАДН2 | +HOH | HAD+ HADH2   CH2 CH CH2    | || |  CH2 сукцинат ДГ СН фумарат гидротаза СНОН | | фумараза | малат ДГ СООН СООН СООН Янтарная Фумаровая Яблочная Кислота кислота кислота (сукцинат) (малат) СООН | оксалоацетат (ЩУК) CH2 | C=O | COOH В ходе одного полного цикла происходит: 1) полное окисление ацетильного остатка до двух молекул углекислого газа; 2) образование 3 молекул НАДН и одной ФАДН2; 3) образование одной молекулы ГТФ. Рассмотрим работу отдельных ферментов: 1) цитратсинтаза – идет образование –с – с- связи, но эта рекция не требует расхода АТФ. Необходимая энергия обеспечивается гидролизом тиоэффирной связи. При этом увеличивается реакционная способность альфа-углеродного атома ацетила. Фермент обладает высокой специфичностью, а сама реакция представляет собой объект регуляции всего цикла. Ингибиторами фермента являются: АТФ, НАДН и сукцинил КоА. 2) Аконитаза – катализирует переход цитрата в изоцитрат путем дегидратации цитрата до цис-аконитовой кислоты с последующей ее гидратацией и переходом в изолимонную кислоту. Обладает абсолютной стереоспецифичностью. В регуляции значительной роли не играет. Ингибируется фтороцитратом. Этим объясняется токсичность некоторых растений, содержащих фтороацетат, из которого синтезируется фтороцитрат (например, астрогал). 3) Изоцитрат-ДГ – катализирует первую из 3 реакций цикла, в ходе которых синтезируется НАДН. Игрет одну из основных регуляторных ролей в цикле. Активаторы – АДФ, НАД+; ингибиторы – АТФ, НАДН. Изоцитрат-ДГ обнаружена и в цитоплазме, где она катализирует аналогичную реакцию, но использует в качестве ко-фермнта НАДФ. В цитоплазме этот фермент играет роль источника альфа-кетоглютарата для синтеза акминокислот и источника НАДФН для анаболических реакций. 4) Альфа-кетогютарат-ДГ – комплекс (содержит три фермента, пять ко-ферментов – те же, что и ПДК, работают аналогично). 5) Сукцинилтиокиназа – расщепляется макроэргическая связь в молекуле сукцинил КоА, при этом энергия сохраняется путем образования нуклеозидтрифосфата (ГТФ). Это единственная стадия в цикле, в ходе которой прямо выделяется энергия метаболизма. 6) Сукцинат ДГ – абсолютно стереоспецифична. Это пример реакции субстратного фосфорилирования. Отщепляется Н+ только в транс-положении. Единственный фермент, локализованный на метохондриальной мембране (все остальне ферменты – растворимые в воде белки – локализованные внутри митохондрий). 7) Фумараза – также обладает стереоспецифичностью (действует только на образование L-малата). В регуляции участия не принимает. 8) Малат ДГ – есть и в цитозоле, принимет при этом участие в работе малатного челночного механизма, способствуя проникновению НАДН из цитозоля в митохондрии. Так же связывает цикл Кребса с процессом биосинтеза пиримидинов и некоторых аминокислот. Обладает абсолютной специфичностью. Значение цикла Кребса. 1)Энергетическое (образуется три молекулы НАДН, ФАДН2, которые могут в ходе передачи электронов в дыхательной цепочки дать энергию, достаточную лдля синтеза 11 молекул АТФ: 3*3 НАДН + 1*2 ФАДН). Кроме того, в ходе цикла образуется молекула ГТФ, при гидролизе которой выделяется столько же энергии, как и при гидролизе АТФ. То-есть всего в ходе цикла мы можем получить 12 молекул АТФ. 2) Цикл Кребса играет большую роль и для анаболических процессов, так как промежуточные продукты используются для самых разных синтетических процессов. Так, ЩУК используется для синтеза пирувата ( через образования фосфоенолпирувата), который в свою очередь идет на синтез углеводов, некоторых аминокислот (глицерина, валина, аланина, серина, цистеина, фенилаланина, тирозина, триптофана и т.д.). Ацетил КоА используется для синтеза жирных кислот. Сукцинил КоА на синтез гема и т.д. Регуляция цикла Кребса. Мы уже упоминали регуляцию отдельных ферментов цикла. Следует лишь добавить, что при анаболических процессах расходуется ЩУК и, чтобы реакции цикла не тормозились, происходит дополнительное образование ЩУК: СН3 СООН | АТФ АДФ + ФК | C=O + CO2 CH2  | | COOH С=О ПВК пируваткарбокслаза | (ко-фермент биотин, СООН или витамин Н ЩУК Как правило, сигналом дополнительного образования ЩУК служит накопление ацетил- КоА (в случае отвода интермедиатов цикла на синтетические процессы). Ацетил КоА является сильнейшим аллостерическим активатором пируваткарбоксилазы. Следовательно, интенсивность цикла зависит и от наличия ПВК. При диабете отмечается дефицит ПВК, следовательно образуется дефицит ЩУК, ЦТК – блокирован, накапливается ацетил-КоА, что приводит к увеличению синтеза жирных кислот, холестерина, ацетоновых тел. Вторй путь дополнительного образования ЩУК – получение его путем окислительного дезаминирования из аспарагиновой кисслоты (аспартата). Схематично: СООН | CH2  | ЩУК CH – NH2 окилительное | дезаминирование COOH |
