Биохимия. Предмет биохимии
 Скачать 0.58 Mb. Скачать 0.58 Mb.
|
| || |F N=C=S2,4 – динитробензол Фенилизотионат Однако, даже в случае использовании автоматического аминокислотного секвинатора, максимальное возможное число операций с использованием реактива Эдмана ограничено отщеплением 40 – 60 аминокислотных остатков. Полипептидные цепи же обычно гораздо длиннее. Например.141 аминкислотный остаток в альфацепи гемоглобина, 188 – в гормоне роста, 332 – в глицероальдегиддегидрогеназе. Поэтому, наилучшей является следующая стратегия: большие полипептиды расщепляются на несколько фрагментов. Каждый из которых затем выделяется и секвенируется с помощью реактива Эдмана. Для получения фрагментов используют эндопептидазы (трипсин – предпочтительно расщепляет пептидные связи, содержащие карбоксильные группы основных аминокислот: лизин, аргинин; химотрепсин – то же самое, только ароматических аминокислот: тирозин, фенилаланин, триптофан). Есть и химические реактивы, например, бромциан BrCN – расщепляет пептидные связи, образованные карбоксильной группой метионина. Обычно фрагментирование проводят комбинированно, используя различные комбинации реагентов, чтобы достаточно точно определять последовательнсть фрагментов. Несколько важных обобщений, касающихся определения амиокислотной последовательности: общей1) Не существует одной частичной последовательности, для всех белков.2) Была обнаружена каждая из комбинаций двух последовательно соединенных аминокислот.3) Белки выполняющие разные функции, имеют разные последовательности4) Белки со сходными функциями имеют похожие последовательности, однако это совпадение проявляется лишь в малой степени.5) Одинаковые белки, выполняющие одинаковые функции, и выделенные из разных организмов имеют значительное сходство в последовательностях аминокислот. 6)одинаковые белки, выполняющие одинаковые функции и выделенные из организмов одного вида почти всегда обладают совершенно одинаковой последовательностью 2) Вторичная структура – определяется регулярно повторяющейся формой укладки полипептидных цепей в пространстве. Или, можно сказать, что это пространственная ориентация основной полипептидной цепи без учета различной по составу и конформации белковых цепей. Остов любой цепи: R1 R2 R3 | | | NH2-CH-CO-NH-CH-CO-NH-CH-CO-NH-CH-COOH Мы уже говорили о том, что атомы углерода и азота в пептидной связи находятся в одной плоскости и поэтому исключают вращение. А вот альфа-углеродный атом и его радикал находятся под углом к основной цепи, да еще альфа-углеродный атом является ассиметричным , что и обуславливает вращение. Специфический тип ориентации (то-есть вторичная структура) является результатом того или иного вида свободного вращения вокруг связей цепи, соединяющих альфа-углеродные атомы. В природных полипептидных полипептидных цепях обнаружены 3 основных вида структуры: 1)Спираль; 2)Складчатая структура; 3)Статистический клубок. В полипептидных цепях со спиральной структурой, состоящих из альфа-аминокислот, наиболее часто встречается правая альфа-спираль. Шаг спирали (один полный виток) равен 5,4 анстрем (А) (1А=10 в –10 степени метра). В один шаг укладывается 3,6 аминокислотных остатка. Такое построение альфа-спирали максимально соответствует тому, чтобы группы С=О одного витка соответствовали группам N-H другого (соседнего) витка. Это нужно для образования максимально большого количества водородных связей. Чем больше образуется водородных связей, тем меньше уровень свободной энергии, тем система более стабильна. Альфа-спираль в 1951 году математически расчитали Л.Полинг и Ф.Кори. Эксперементально это было доказано в 1957 году. Содержание альфа-спиралей в глобулярных белках сильно варьирует: от 0% до 80-90% (глобулярный белок не может иметь 100% спирализации, в этом случае он будет фибрилярным). Спиральную структуру могут нарушить 2 фактора: 1)Наличие остатков пролина, циклическая структура которого вносит излом в полипептидную цепь; 2)Существование локального электрического отталкивания, когда напротив друг друга оказываются либо положительно заряженные R-группы лизина и аргинина, либо отрицательно заряженные группы аспарагиновой и глбтаминовой кислот. Существуют и другие виды спиралей, например, бетта-спираль, 310 – спираль и т.д. Все они отличаются только параметрами: то-есть имеют различный шаг спирали и в один виток укладывается разное количество аминокислотных остатков. Складчатая структура (ее иногда называют бетта-складчатой) формируется на неспирализованных участках полипептидной цепи. Возникают водородные связи между двумя или большим числом цепей (как правило, в фибриллярных белках) или между различными участками одной цепи ( в глобулярных белках). Есть 2 типа складчатой структуры в зависимости от взаимного положения атомов в различных цепях или участках одной цепи: 1)Параллельная (если обе цепи направлены в одну сторону, то-есть совпадают их N и С концы; 2)Антипараллельная (если С и N концы у двух цепей направлены в разные стороны). Более стабильным считается антипараллельное расположение, так как больше совпадений групп С=О и N-H, соответственно больше возникает и водородных связей. Вторичная структура формируется путем самосборки, то-есть ее образование полностью зависит от аминокислотной последовательности полипептидной цепи, то-есть от первичной структуры. Изучают вторичную структуру с помощью рентгено-структурного анализа и поляриметрии. Статистический клубок образуется в полипептидных цепях глобулярных белков на участках, не обладающих спиральной или складчатой структурой, вследствии упорядоченных взаимодействий с участием R-группы и образованием дисульфидных связей. 3) Третичная структура – это специфичная форма ( для каждого белка) укладки полипептидных цепей в пространстве, то-есть она описывает полную трехмерную архитектуру белка, в том числе и ориентацию простетической группы. Третичная структура фибриллярных белков: полипептидные цепи имеют полностью спирализованную структуру или полностью складчатую структуру. Интактный белок, однако, состоит не из одиночных пептидных цепей, а из агрегатов двух или большего числа полипептидных цепей. Например, белок шелка фиброин состоит из нескольких цепей со складчатой структурой, уложенных стопкой так, что каждая цепь со всех четырех сторон окружена антипараллельными цепями. Белок кератин (волосы, ногти и т.д.) представляет собой скрученные спиральные цепи, связанные в пучки или взаимоперекрученные. Для изучения третичной структуры глобулярных белков большое значение имели работы М.Перутца (1934 – 1959года – работал над третичной структурой гемоглобина) и Д.Кендрью (1947 – 1957года – миоглобин). Для расшифровки третичной структуры использовался метод рентгеноструктурного анализа, практически, единственный метод, пригодный для этих целей (поскольку разрешающая способность приблизительно равна 1,5 Ангстрем). В отличие от фибриллярных белков, конформация глобулярных белков гораздо более компактна из-за наличия сложным образом согнутых, свернутых и скрученных участков полипептидной цепи. Однако, не существует единой для всех глобулярных белков формы. Некоторые из них – почти правильные сферы, другие – вытянутые эллипсоиды, большинство – имеют промежуточную форму между этими крайними случаями. Необходимо помнить: 1)Нативная конформация белка – индивидуальное структурное свойство данного белка, которое, в свою очередь, определяет его индивидуальность. Зависимость биологической активности белка от его третичной структуры впервые показал Кристиан Анфинсен в 1964 году на примере РНКазы. 2)Нативная конформация определяется инструкциями, заложенными в аминокислотной последовательности. Нативная конформация (третичная структура) – это конформация с минимальной энергией, то-есть максимально стабильная конформация. Стабилизация третичной структуры осуществляется за счет практически всех видов связей (водородные, электростатические, гидрофобные, взаимодействие в простетической группе – например, между ионом металла и различными R-группами). Сейчас третичная структура описана более, чем для 100 белков. 4)Четвертичная структура – определяется числом и пространственным расположением субъединиц белков, то-есть, по сути, четвертичная структура рассматривает нековалентное агрегирование двух и большего числа полипептидных цепей. Субъединица – это часть белковой молекулы, способная выполнять какую-то функцию. Четвертичная структура характерна для белков, существующих в виде агрегатов двух или большего числа полипептидных цепей, соединенных друг с другом посредством лишь нековалентных связей (электростатические и водородные связи). Ковалентные связи, например, дисульфидные мостики – отсутствуют. Белки такого типа называются олигомерными, соответственно есть и мономерные белки – 1 цепь. Причем чаще всего встречаются димеры, тримеры и тетромеры, хотя есть и белки с большим числом компонентов. Каждую отдельную цепь в составе таких белков называют протомером. Выделяют гомогенные олигомеры (у которых все протомеры идентичны) и гетерогенные олигомеры (у которых цепи различны). Иногда число субъединиц равно числу протомеров. Олигомерным белкам свойственны кооперативные изменения конформации протомеров. Это можно рассмотреть на примере миоглобина и гемоглобина. Миоглобин, белок из мышц млекопитающих, переносящий кислород, состоит из 153 аминокислотных остатков, образующих единичную полипептидную цепь. Кислород присоединяется к белку, связываясь с атомом железа в простетической группе – геме. Гемоглобин является гетерогенным тетрамером, он состоит из двух альфа-цепей и двух бетта-цепей. В каждой из цепей есть простетическая группа – гем, в которой происходит связывание кислорода с железом. Альфа-цепь имеет 141 аминокислотный остаток, бетта-цепь – 144. Миоглобин и по отдельности альфа- и бетта- цепи гемоглобина очень похожи по третичной структуре. Но полностью молекула гемоглобина (2альфа- + 2бетта- цепи) очень отличаются от миоглобина по конфигурации, вследствии кооперативных изменений протомеров. Поэтому, в случае гемоглобин первый связанный лиганд кислорода облегчает связывание второй молекулы кислорода со вторым гемом, что в свою очередь облегчает связывание 3й молекуле кислорода с третьим гемом, а это облегчает связывание последней молекулы кислорода. Графики насыщения кислородом выглядят так: 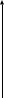 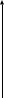     100---- 100---- РО2 рО2 Миоглобин Гемоглобин По отдельности каждая цепочка гемоглобина имеет график насыщения кислородом идентичный с миоглобином. Суть объяснения сводится к тому, что белок может принимать различные трехмерные конформации, обладающие разной активностью. Изучают с помощью рентгено структурного анализа. Олигомерные белки значительно лучше регулируются, что способствует лучшему выполнению функции в меняющихся условиях среды. Четвертичная структура собирается также по принципу самосборки. Некоторые олигомерные белки существуют в трех и более гибридных формах. Это явление открыто в 1957 году для липоилдегидрогеназы. Гибридные формы называют изоферментами. Клетки и биологические жидкости (например, кровь) обычно содержат изоферменты во вполне определенных, характерных ддя них соотнощениях. Измерение уровни изоферментов используются для диагностики различных патологий. КЛАССИФИКАЦИЯ БЕЛКОВ. 1)Основанная на функциях (ферменты, гормоны, транспортные и так далее) 2) Основанная на различиях в форме белковой молекулы: а) фибриллярные (в виде нити) – например коллаген. б) глобулярные (сфера, элипс) – например, все ферменты. 3) Основана на составе белков: а) простые (состоят только из аминокислот ) б) сложные (состоят из органической и неорганической группировки не пептидной природы, которая называется простетической группой, соединенных с пептидной цепью). 1) Простые белки (протеины): Альбумины. Глобулины. Протамины Гистоны. Проламины. Глютеллины. Протеиноды. 2)Сложные белки (протеиды): 1) Хромопротеиды: а) гемопротеиды, б) флавопротеиды 2) Липопротеиды. 3) Гликопротеиды. 4) Нуклеопротеиды. 5) Фосфопротеиды. 6) Металлопротеиды. ХАРАКТЕРИСТИКА ОСНОВНЫХ ГРУПП ПРОСТЫХ БЕЛКОВ. 1) Альбумины – молекулярная масса составляет 30000 – 40000 Дальтон. Изоэлектрическая точка равна пяти (Pi), так как содержит в составе много глютаминовой кислоты. Трудно осаждается (осаждаются только насыщенными растворами сульфата аммония). Широко распространены в тканях: плазме крови, печени, мышцах и так далее. Их содержание в плазме достигает 40 – 50 г/л. синтезируется в печени. Будучи высокогидрофильными белками, обеспечивают онкотическое давление крови.,осуществляет тарнспорт многих гормонов, витаминов, билирубина и других веществ. При длительном голодании могут играть роль белкового резерва. Участвует в связывании и последующей инактивации многих эндогенных веществ. 2) глобулины – молекулярная масса достигает нескольких сотен тысяч Дальтон. Изоэлектрическая точка Pi = 7. Не растворимы в воде, но растворимы в слабых солевых растворах 5 – 10 Na%(K) Cl. Осаждается полунасыщенным раствором сульфата аммония. Их содержание в плазме крови составляет 20 – 30 г/л. Синтезируется в печени и некоторые виды – в лимфоцитах. Входят в состав иммунной системы организма, которая отвечает не только за иммунный ответ организма на внедрение антигенов (чужеродный белок, микроорганизмы и так далее), но и участвуют, в сочетании с другими белками, в белковом ответе на острые воспалительные процессы. Методом электрофареза глобулины сыворотки крови делят на фракции: альфа 1, альфа 2, бэтта, гамма. В клинике часто определяют альбумино-глобулиновый коэффициент (то-есть отношение между альбуминами и глобулинами). В норме этот коэффициент составляет от 1,5 до 2. 3) Протамины – белки с небольшой молекулярной массой (около 5000 Дальтон), то-есть они, в принципе, занимают промежуточное положение между белками и пептидами. Их изоэлектрическая точка лежит в щелочной среде. Потамины обладают основными свойствами, что обусловлено особенностями их аминокислотного состава (в их составе высок процент основных аминокислот: аргинина (до 80 процентов) и лизина ). Входит в состав простетической группы нуклеопротеидов. Являются антогонистом антикоагулянта гепарина. 4) Гистоны – молекуярная масса 10000 – 20000. Основные свойства у гистонов выражены слабее, чем у протаминов поскольку в состав гистонов входит около 20 – 30 процентов основных аминокислот (лизина и аргинина). Выделяют пять видов гистонов (Н1, Н2, Н3, Н4, Н5), которые отличаются друг от друга содержанием лизина и аргинина, (в одних больше аргинина -Н1, в других - лизина – Н2). Входят в состав нуклеопротеидов, участвуют в храненинии и передаче генетической информации. Способны влиять на активность различных генов. 5,6) Глютеллины и проламины – это белки растительного происхождения, много содержится в злаках. В их составе много гидрофобных аминокислотных остатков. 7)Протеиноиды – или, как их называют, белковоподобные вещества, имеют очень бедный аминокислотный состав, очень мало циклических аминокислот, но содержат большое количество гидрофобных аминокислот (аланин, валин, лейцин и другие), например, эластин содержит до 93 процентов таких аминокислот. Протенноиды почти не растворимы в воде и солевых растворах, водно-спиртовых смесях. Трудно расщепляются ферментами желудочно-кишечного тракта. Виды протеноидов: эластин, кератин, коллаген. а) эластин –белок эластических волокон. Его много содержится в стенках больших кровеносных сосудов, в связках. Основная субъединица фибрилл эластина – тропоэластин имеет молекулярную массу 72000 Дальтон. Волокна эластина построены из относительно небольших, почти сферических молекул, соединенных в волокнистые тяжи с помощью жестких поперечных сшивок. Различают два вида сшивок: десмозин и изодесмозин, обе с участием четырех остатков лизина.  R |      R__ __R  N +  | R – б) Кератин – различают альфа- и бэтта-кератин. Типичный пример бэтта-кератина – фиброин шелка и паутины. Полипетидная цепь у них вытянута вдоль одной оси. Соседние цепи сшиваются водородными связями, они антипараллельны. Альфа-кератины – это нерастворимые и плотные белки, входящие в состав волос, ногтей, рогов, шерсти и так далее. Полипептидные цепи альфа кератинов уложены в альфа-спирали, стабилизация которых осуществляется за счет водородных и дисульфидных связей. в) Коллаген – наиболее изученный из фибриллярных белков, это основной компонент соединительной ткани, главный структурный белок всех животных клеток. Около 60 процентов массы всего белка и 6 процентов общей массы тела приходится на коллаген. Его количество в нашей биосфере оценивают в 1 миллиард тонн. Каждое макроволокно соединительной ткани представляет собой агрегат молекул коллагена. Длинна молекулы коллагена 300 нанометров, молярная масса 300000. Структура молекулы коллагена – перекрученная спираль (ее называют тропоколлаген) – это три одинаковые левовращающие цепи (содержат примерно 1000 аминокислотлных остатков) скручены вместе с образованием правовращающей тройной спирали. Каждая цепь имеет гораздо более вытянутую структуру, чем альфа-спираль. Структура тройной спирали обусловлены аминокислотным составом и последовательностью аминокислотных остатков в полипептидных цепочках. Почти одну треть аинокислотных остатков составляет глицин, одна четвертая приходится на пролин и гидроксипролин, остальное – небольшое количество остальных аминокислот, включая гидроксилизин. Перекрученнная структура тройной спирали стабилизирована многочисленными межмолекулярными водородными , дисульфидными и другими связями. Важную роль играют ковалентные связи между цепями, содержащими лизин и гидроксилизин. Таким образом структура обладает жесткостью и почностью (нить коллагна толщиной один мм спосбна выдержать нагрузку сто ньютон (10 кг)). По мере старения организма, число поперечных связей увеличивается, что делает фибриллы коллагена более жесткими и хрупкими, а это приводит к изменению механических свойств хрящей и суставов, делает более ломкими кости, понижает прозрачность роговицы глаза. При кипячении в воде коллаген превращается в желатину – растворимую смесь пептидов. ХАРАКТЕРИСТИКА ОСНОВНЫХ ГРУПП СЛОЖНЫХ БЕЛКОВ. 1) Хромопротеиды – состоят из простого белка, соединенного с окрашенной простетической группой (отсюда и название: chroma - краска). Подразделяются на: а) гемопротеиды – в качестве простетической группы – гем. К этим белкам относятся: гемоглобин, миоглобин, ряд ферментов (каталаза, пероксидаза, цитохромы). Функции многообразны: участвуют в транспорте газов, окислительно-восстановительных реакциях и так далее. б) флаворотеиды – простетическую группу составляют ФАД и ФМН (производные изоаллоксазина). Это некоторые фермнты (флавиновые дегидрогеназы), катализирующие окислительно-восстановительные реакции. 2) Липопротеиды – состоят из простого белка, связанного с каким-либо липидом, представляющим простетическую группу. Это может быть нейтральный жир, свободная жирная кислота, фосфолипиды, холестерин. Липопротеиды входят в состав биомембран, миелиновых оболочек, присутствуют в свободном состоянии в плазме крови. 3) Гликопротеины – их простетическая группа представлена углеводами и их производными (глюкоза,галактоза, манноза,галактозамин, сиаловые кислоты, гликозаминогликаны). Гликопротеиды входя в состав слюны, хрящевой, костной ткани,биомембран, участвуют в иммунологических реакциях, ионном обмене и так далее. 4) Нуклеопротеиды – состоят из белков (которые, в основном, представлены протаминами и гистонами) и нуклеиновых кислот (простетическая группа). Их основная функция – хранение и передача наследственной информации. 5) Фосфопротеиды – в качестве простетической группы выступает фосфорная кислота. Большое количество этих белков содержится в ткани мозга. К фосфопротеидам относят казеин молока. Функции фосфопротеидов многообразны. Они являются донорами фосфатов в клетке, являются источниками пластического и энергетического материала. 6) Металлопротеиды – простетическая группа представлена металлами (цинк, железо, медь, кобальт и другие). К этой группе белков относятся ферритин (выполняет роль депо железа, содержится в печени, селезенке, костном мозге ), трансферрин (переносчик железа), некоторые ферменты (алкогольдегидрогеназа, карбангидраза, СОД и другие). |
