biokhimia_Vosstanovlen (Восстановлен). Предмет и задачи биологической химии. Обмен веществ и энергии, сложная структурная организация, гомеостаз и самовоспроизведение как важнейшие признаки живой материи
 Скачать 2.96 Mb. Скачать 2.96 Mb.
|
Рис. 8-33. Синтез кетоновых тел в митохондриях гепатоцитов. Регуляторный фермент синтеза кетоновых тел (ГМГ-КоА-синтаза) ингибируется свободным КоА. - реакция идёт неферментативно при высокой концентрации кетоновых тел в крови. Окисление кетоновых тел в тканях. Кетоацидоз.В норме концентрация кетоновых тел в крови составляет 1-3 мг/дл (до 0,2 мМ/л), но при голодании значительно увеличивается. Увеличение концентрации кетоновых тел в крови называют кетонемией, выделение кетоновых тел с мочой - кетонурией. Накопление кетоновых тел в организме приводит к кетоацидозу: уменьшению щелочного резерва (компенсированному ацидозу), а в тяжёлых случаях - к сдвигу рН (некомпенсированному ацидозу), так как кетоновые тела (кроме ацетона) являются водорастворимыми органическими кислотами (рК |
| Проводимое вмешательство | Количество холестерола и жиров | Источники питания |
| Снижение потребления общего количества жиров Снижение насыщенных жиров | <30% суточной энергии <7-10% | Уменьшить потребление масла, маргарина, цельного молока, мороженого, жирных сыров, жирного мяса, шоколада |
| Использование пищи с высоким содержанием белка | | Рыба, цыплята и индейка (без шкурки), телятина |
| Использование сложных углеводов, клетчатки, содержащейся во фруктах и овощах | 35-40 г/сут клетчатки и пектинов растений | Фрукты, овощи, бобы и соя, неочищенные зерновые продукты |
| Снижение холестерина в пище | <300 мг/день | Не более 2 яиц в неделю, печень 2 раза в месяц |
| Умеренное увеличение использования масел, содержащих полиеновые жирные кислоты | Мононенасыщенные (10-1 5% энергии) Полиненасыщенные (7-10% энергии) | Подсолнечное, кукурузное, оливковое масло |
захват холестерола из крови для синтеза новых жёлчных кислот. Препараты типа холестирамина называют секвестрантами жёлчных кислот.
Наиболее эффективные препараты, применяемые при лечении атеросклероза, - ингибиторы ГМГ-КоА-редуктазы. Эти препараты - антибиотики, например мевакор, в печени трансформируются в активную форму и эффективно ингибируют регуляторный фермент биосинтеза холестерола. Такие препараты могут практически полностью подавить синтез собственного холестерола в организме. В этих условиях печень увеличивает захват холестерола из крови. Для этого в клетках печени почти вдвое увеличивается синтез белков-рецепторов Л ПНП и, соответственно, увеличивается захват ЛПНП из крови. Таким образом концентрация холестерола в крови даже у больных с гетерозиготной формой семейной гиперхолестеролемии может быть доведена практически до нормы.
Лекарственные препараты - фибраты (клофибрат, фенофибрат) - ускоряют катаболизм ЛПОНП, активируя ЛП-липазу. Эти препараты также активируют окисление жирных кислот в печени, уменьшая тем самым синтез триацилглицеролов и эфиров холестерола и, как следствие, секрецию ЛПОНП печенью. Клофибрат индуцирует синтез ферментов пероксисом, способных окислять жирные кислоты. Фибраты обычно применяют при сочетании гипертриглицеролемии и гиперхолестеролемии. Для эффективного лечения атеросклероза применяют, как правило, комбинированное воздействие нескольких лекарственных препаратов.
АБЕЛЛЯ МЕТОД (L. L. Abell) — один из методов количественного определения общего холестерина в сыворотке крови.
Основан на способности эфирной вытяжки холестерина давать с уксусным ангидридом и серной к-той цветную реакцию (реакция Либерманна — Бурхардта), интенсивность к-рой определяется колориметрически.
78. Общая схема источников поступления и путей расходования аминокислот в тканях. Динамическое состояние белков в организме. Причины необходимости постоянного обновления белков организма. «Незаменимые» аминокислоты.
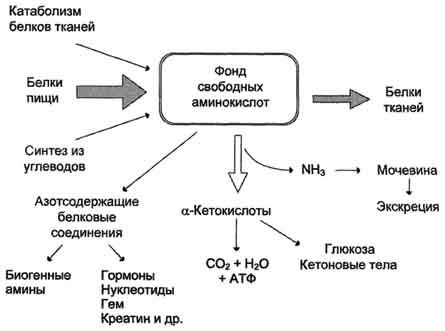
Источники и пути использования аминокислот
ДИНАМИЧЕСКОЕ СОСТОЯНИЕ БЕЛКОВ ОРГАНИЗМА Кажущаяся стабильность химического состава целостного организма является результатом существования определенного равновесия между скоростями синтеза и распада его составляющих. Внедрение в биохимическую и клиническую практику метода меченых атомов позволило доказать, что белки нужны не только растущему, но и сформировавшемуся организму, когда его рост прекратился, т.е. имеются доказательства существования в организме механизма постоянного обновления химических составных частей тела. При нормальных физиологических условиях, как и при патологических состояниях, скорости синтеза и распада специфических веществ определяются, помимо нервно-гормонального влияния, химической природой веществ и внутриклеточной их локализацией. В растущем организме скорость синтеза многих компонентов органов и тканей преобладает над скоростью их распада. Тяжелые изнуряющие болезни, а также голодание, напротив, характеризуются преобладанием скорости катаболизма над скоростью синтеза. Почти все белки тела, включая структурные белки, гемоглобин, белки плазмы и других биологических жидкостей организма, также подвергаются постепенному распаду и синтезу. Например, более половины белков печени, сыворотки крови и слизистой оболочки кишечника подвергается распаду и ресинтезу в течение 10 дней. Медленнее обновляются белки мышц, кожи и мозга.
Незаменимые аминокислоты — необходимые аминокислоты, которые не могут быть синтезированы в том или ином организме, в частности, в организме человека. Поэтому их поступление в организм с пищей необходимо.Незаменимыми для взрослого здорового человека являются 8 аминокислот: валин, изолейцин, лейцин, лизин, метионин, треони́н, триптофан и фенилалани́н;
Для детей незаменимыми также являются аргинин и гистидин.
79. Катаболизм аминокислот. Общие пути распада аминокислот. Трансаминирование аминокислот. Схема реакций, ферменты, роль витамина В6. Биологическое значение трансаминирования. Диагностическое значение определения трансаминаз в сыворотке крови.
Аминокислоты, образующиеся при переваривании белков и поступающие в клетки тканей, подвергаются катаболизму и анаболизму, а также специфическим реакциям, в результате которых синтезируются биологически активные соединения.
Катаболизм большинства аминокислот начинается с Отщепления α-аминогруппы.Аминокислота теряет аминогруппу в результате двух типов реакций: трансаминирования и дезаминирования.
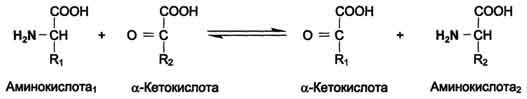
А. Трансаминирование
Трансаминирование - реакция переноса α-аминогруппы с аминокислоты на α-кетокислоту, в результате чего образуются новая кетокислота и новая аминокислота. Константа равновесия для большинства таких реакций близка к единице (Кр1,0), поэтому процесс трансаминирования легко обратим (см. схему А).
Реакции катализируют ферменты аминотрансферазы, коферментом которых служит пиридоксальфосфат (ПФ) - производное витамина В6 (пиридоксина, см. раздел 3) (см. схему Б).
Аминотрансферазы обнаружены как в цитоплазме, так и в митохондриях клеток эукариот. Причём митохондриальные и цитоплазматические формы ферментов различаются по физико-химическим свойствам. В клетках человека найдено более 10 аминотрансфераз, отличающихся по субстратной специфичности. Вступать в реакции трансаминирования могут почти все аминокислоты,за исключением лизина, треонина и пролина.
1. Механизм реакции
Аминотрансферазы - классический пример ферментов, катализирующих реакции, протекающие по механизму типа "пинг-понг" (см. раздел 2). В таких реакциях первый продукт должен уйти из активного центра фермента до того, как второй субстрат сможет к нему присоединиться.
Активная форма аминотрансфераз образуется в результате присоединения пиридоксальфосфата к аминогруппе лизина прочной альдиминной связью (рис. 9-6). Лизин в положении 258 входит в состав активного центра фермента. Кроме того, между ферментом и пиридоксальфосфатом образуются ионные связи с участием заряженных атомов фосфатного остатка и азота в пиридиновом кольце кофермента.
Пиридоксальфосфат в данном случае служит переносчиком аминогрупп. При этом наиболее важную роль играет его альдегидная группа, которая может обратимо присоединять различные амины с образованием шиффовых оснований. Реакции трансаминирования проходят в 2 стадии, во время которых пиридрксальфосфат претерпевает обратимые превращения между свободной альдегидной формой (ПФ) и аминированной формой (пиридоксаминфосфат).
Последовательность реакций трансаминирования представлена ниже.
На первой стадии к пиридоксальфосфату в активном центре фермента с помощью альдиминной связи присоединяется аминогруппа от первого субстрата - аминокислоты. Образуются комплекс фермент-пиридокса-минфосфат и кетокислота - первый продукт реакции. Этот процесс включает промежуточное образование 2 шиффовых оснований.
На второй стадии комплекс фермент-пиридоксаминфосфат соединяется с кетокислотой (вторым субстратом) и снова через промежуточное образование 2 шиффовых оснований передаёт аминогруппу на кетокислоту. В результате фермент возвращается в свою нативную форму, и образуется новая аминокислота - второй продукт реакции. Если альдегидная группа пиридоксальфосфата не занята аминогруппой субстрата, то она образует шиффово основание (альдимин) с ε-аминогруппой радикала лизина в активном центре фермента (см. схему на с. 471).
2. Органоспецифичные аминотрансферазы АНТ и ACT
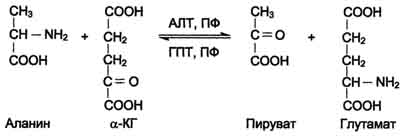
Чаще всего в реакциях трансаминирования участвуют аминокислоты, содержание которых в тканях значительно выше остальных - глутамат, аланин, аспартат и соответствующие им кетокислоты - α-кетоглутарат, пируват и оксалоацетат. Основным донором аминогруппы служит глутамат.
Суммарно эти реакции можно представить в виде схемы:
Акцептором аминогруппы любой аминокислоты, подвергающейся трансаминированию (аминокислота 1), служит α-кетоглутарат. Принимая аминогруппу, он превращается в глутамат, который способен передавать эту группу любой α-кетокислоте с образованием другой аминокислоты (аминокислота 2).
Аминотрансферазы обладают субстратной специфичностью к разным аминокислотам. В тканях человека обнаружено более 10 разных аминотрансфераз.
Наиболее распространёнными ферментами в большинстве тканей млекопитающих являютсяаланинаминотрансфераза (АЛТ), по обратной реакции - глутамат-пируватаминотрансфераза(ГПТ) и аспартатаминотрансфераза (ACT), по обратной реакции - глутамат-оксалоацетатаминотрансфераза (ГОТ).
АЛТ (АлАТ) катализирует реакцию трансаминирования между аланином и α-кетоглутаратом .
Локализован этот фермент в цитозоле клеток многих органов, но наибольшее его количество обнаружено в клетках печени и сердечной мышцы.
ACT (АсАТ) катализирует реакцию трансаминирования между аепартатом и α-кетоглутаратом аналогично предыдущей .
В результате образуются оксалоацетат и глутамат. ACT имеет как цитоплазматическую, так и митохондриальную формы. Наибольшее его количество обнаружено в клетках сердечной мышцы и печени.
Так как наибольшее количество АЛТ и ACT сосредоточено в печени и миокарде, а содержание в крови очень низкое, можно говорить об органоспецифичности этих ферментов.
В результате работы аминотрансфераз аминный азот многих аминокислот переходит в состав глутамата. Есть основания считать, что накопление аминогрупп в форме глутаминовой кислоты происходит в цитозоле. Затем глутамат с помощью транслоказ попадает в митохондрии, где активна специфическая ACT. В результате действия этого фермента глутамат снова превращается в α-кетоглутарат. Последний используется для непрямого дезаминирования аминокислот, содержащихся в митохондриях. Это очень важно, так как только глутамат в тканях млекопитающих наиболее быстро может подвергаться окислительному дезаминированию (см. ниже).
3. Биологическое значение трансаминирования
Реакции трансаминирования играют большую роль в обмене аминокислот. Поскольку этот процесс обратим, ферменты аминотрансферазы функционируют как в процессах катаболизма, так и биосинтеза аминокислот. Трансаминирование -
471
заключительный этап синтеза заменимых аминокислот из соответствующих α-кетокислот, если они в данный момент необходимы клеткам. В результате происходит перераспределение аминного азота в тканях организма. Трансаминирование - первая стадия дезаминирования большинства аминокислот, т.е. начальный этап их катаболизма. Образующиеся при этом кетокислоты окисляются в ЦТК или используются для синтеза глюкозы и кетоновых тел. При трансаминировании общее количество аминокислот в клетке не меняется.
4. Диагностическое значение определения
аминотрансфераз в клинической практике
В клинической практике широко используют определение активности ACT и АЛТ в сыворотке крови для диагностики некоторых заболеваний.
В норме в крови активность этих ферментов очень мала и составляет 5-40 Е/л. При повреждении клеток соответствующего органа ферменты выходят в кровь, где активность их резко повышается. Поскольку ACT и АЛТ наиболее активны в клетках печени, сердца и, в меньшей степени, скелетных мышц, их используют для диагностики болезней этих органов (см. раздел 2). В клетках сердечной мышцы количество ACT значительно превышает количество АЛТ, а в печени - наоборот. Поэтому особенно информативно одновременное измерение активности обоих ферментов в сыворотке крови. Соотношение активностей ACT/АЛТ называют "коэффициент де Ритиса". В норме этот коэффициент равен 1,33±0,42. При инфаркте миокарда активность ACT в крови увеличивается в 8-10 раз, а АЛТ - в 1,5-2,0 раза. Наиболее резко активность ACT увеличивается при некрозе ткани, так как выходит в кровь и цитоплазматическая и митохондриальная формы фермента. При инфаркте миокарда значение коэффициента де Ритиса резко возрастает.
При гепатитах активность АЛТ в сыворотке крови увеличивается в ∼8-10 раз по сравнению с нормой, a ACT - в 2-4 раза. Коэффициент де Ритиса снижается до 0,6. Однако при циррозе печени этот коэффициент увеличивается, что свидетельствует о некрозе клеток, при котором в кровь выходят обе формы ACT.
80. Дезаминирование аминокислот: прямое, непрямое. Виды прямого дезаминирования. Окислительное дезаминирование. Оксидазы L-аминокислот. Глутаматдегидрогеназа. Схема реакции, кофактор, регуляция процесса.
Дезаминирование аминокислот - реакция отщепления α-аминогруппы от аминокислоты, в результате чего образуется соответствующая α-кетокислота (безазотистый остаток) и выделяется молекула аммиака. Дальнейшие превращения продуктов дезаминирования аминокислот представлены на рис. 9-7.
Аммиак токсичен для ЦНС, поэтому в организме человека и млекопитающих он превращается в нетоксичное хорошо растворимое соединение - мочевину. В виде мочевины, а также в виде солей аммония аммиак выводится из организма. Безазотистый остаток используется для образования аминокислот в реакциях трансаминирования,
472
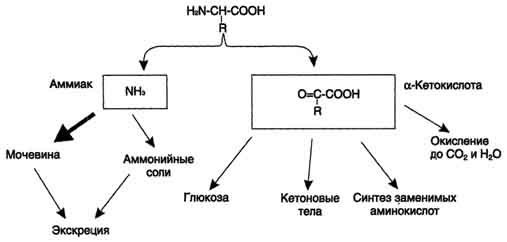
Рис. 9-7. Судьба продуктов дезаминирования аминокислот.
в процессах глюконеогенеза, кето-генеза, в анаплеротических реакциях для восполнения убыли метаболитов ОПК, в реакциях окисления до СО2 и Н2О.
Существует несколько способов дезаминирования аминокислот:
окислительное;
непрямое (трансдезаминирование);
неокислительное;
внутримолекулярное.
1. Окислительное дезаминирование
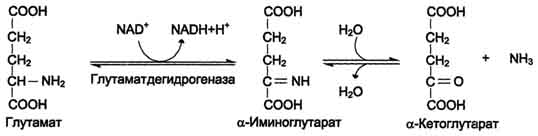
Наиболее активно в тканях происходит дезаминирование глутаминовой кислоты. Реакцию катализирует фермент глутаматдегидрогеназа, коферментом глутаматдегидрогеназы является NAD+. Реакция идёт в 2 этапа. Вначале происходит ферментативное дегидрирование глутамата и образование а-иминоглутарата, затем - неферментативное гидролитическое отщепление иминогруппы в виде аммиака, в результате чего образуется а-кетоглутарат (см. схему ниже).
Окислительное дезаминирование глутамата -
обратимая реакция и при повышении концентрации аммиака в клетке может протекать в обратном направлении, как восстановительное шинирование α-кетоглутарата.
Глутаматдегидрогеназа очень активна в митохондриях клеток практически всех органов, кроме мышц. Этот фермент - олигомер, состоящий из 6 субъединиц (молекулярная масса 312 кД). Глутаматдегидрогеназа играет важную роль, так как является регуляторным ферментом аминокислотного обмена. Аллостерические ингибиторы глутаматдегидрогеназы (АТФ, ГТФ, NADH) вызывают диссоциацию фермента и потерю глутаматдегидрогеназной активности. Высокие концентрации АДф активируют фермент. Таким образом, низкий энергетический уровень в клетках стимулирует разрушение аминокислот и образованиеα-кетоглутарата, поступающего в ЦТК как энергетический субстрат. Глутаматдегидрогеназа может индуцироваться стероидными гормонами (кортизолом).
Схема
Оксидаза L-аминокислот
В печени и почках обнаружен фермент оксидаза L-аминокислот, способный дезаминировать некоторые L-аминокислоты (см. схему в конце стр.).
Коферментом в данной реакции выступает FMN. Однако вклад оксидазы L-аминокислот в дезаминирование, очевидно, незначителен, так как оптимум её действия лежит в щелочной среде (рН 10,0). В клетках, где рН среды близок к нейтральному, активность фермента очень низка.
Оксидаза D-аминокислот также обнаружена в почках и печени. Это FAD-зависимый фермент. Оптимум рН этой оксидазы лежит в нейтральной среде, поэтому фермент более активен, чем оксидаза L-аминокислот. Роль оксидазы D-аминокислот невелика, так как количество D-изомеров в организме крайне мало, потому что в белки пищи и белки тканей человека и животных входят только природные L-аминокислоты. Вероятно, оксидаза D-аминокислот способствует их превращению в соответствующие L-изомеры (рис. 9-8).
81. Непрямое дезаминирование аминокислот. Схема процесса, субстраты, ферменты, кофакторы.
Большинство аминокислот не способно дезаминироваться в одну стадию, подобно Глу. Аминогруппы таких аминокислот в результате трансаминирования переносятся на α-кетоглутарат с образованием глутаминовой кислоты, которая затем подвергается прямому окислительному дезаминированию. Такой механизм дезаминирования аминокислот в 2 стадии получил название трансдезаминирования, или непрямого дезаминирования:
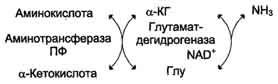
Непрямое дезаминирование аминокислот происходит при участии 2 ферментов: аминотрансферазы (кофермент ПФ) и глутаматдегидрогеназы (кофермент NAD+).
Значение этих реакций в обмене аминокислот очень велико, так как непрямое дезаминирование - основной способ дезаминирования большинства аминокислот. Обе стадии непрямого дезаминирования обратимы , что обеспечивает как катаболизм аминокислот , так и возможность образования практически любой аминокислоты из соответствующей α-кетокислоты .
В мышечной ткани активность глутаматдегидрогеназы низка, поэтому в этих клетках при интенсивной физической нагрузке функционирует ещё один путь непрямого дезаминирования с участием цикла ИМФ-АМФ. Вначале происходит перенос аминогруппы аминокислот на аспартат, затем на инозиновую кислоту (ИМФ) и в завершение - дезаминирование АМФ. Представленная схема отражает последовательность реакций непрямого неокислительного дезаминирования:
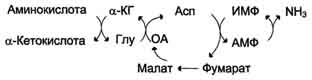
Можно выделить 4 стадии процесса:
трансаминирование с α-кетоглутаратом, образование глутамата;
трансаминирование глутамата с оксалоацета-том (фермент ACT), образование аспартата;
реакция переноса аминогруппы от аспартата на ИМФ (инозинмонофосфат), образование АМФ и фумарата;
гидролитическое дезаминирование АМФ.
Перенос аминогруппы от аспартата и синтез АМФ происходят следующим образом .
Реакция дезаминирования адениловой кислоты происходит под действием фермента АМФ дезаминазы .
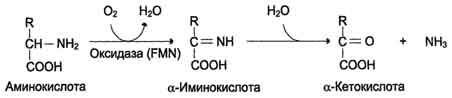
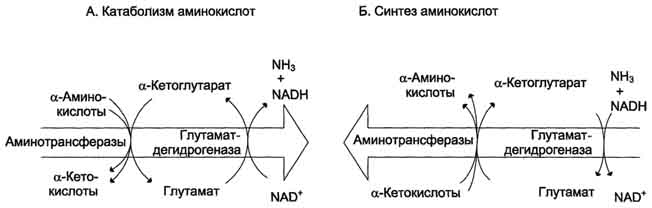
Рис. 9-9. Биологическая роль непрямого дезаминирования. А - при катаболизме почти все природные аминокислоты сначала передают аминогруппу на а-кетоглутарат в реакции трансаминирования с образованием глутамата и соответствующей кетокислоты. Затем глутамат подвергается прямому окислительному дезаминированию под действием глутаматдегидрогена-зы, в результате чего получаются а-кетоглутарат и аммиак; Б - при необходимости синтеза аминокислот и наличии необходимых а-кетокислот обе стадии непрямого дезаминирования протекают в обратном направлении. В результате восстановительного аминирования а-кетоглутарата образуется глутамат, который вступает в трансаминирование с соответствующей а-кетокислотой, что приводит к синтезу новой аминокислоты.
Этот путь дезаминирования преобладает в мышцах при интенсивной работе, в результате которой накапливается молочная кислота. Выделяющийся аммиак предотвращает закисление среды в клетках, вызванное образованием лактата.
3. Неокислительное дезамитровате
В печени человека присутствуют специфические ферменты, катализирующие реакции дезаминирования аминокислот серина, треонина и гистидина неокислительным путём.
Неокислительное дезаминирование серина катализирует сериндегидратаза .
Реакция начинается с отщепления молекулы воды и образования метиленовой группы, затем происходит неферментативная перестройка молекулы, в результате которой образуется иминогруппа, слабо связанная с а-углеродным атомом. Далее в результате неферментативного гидролиза отщепляется молекула аммиака и образуется пируват.
Неокислительное дезаминирование треонина катализирует фермент треониндегидратаза. Механизм реакции аналогичен дезаминированию серина .Эти ферменты пиридоксальфосфатзависимые.
Неокислительное дезаминирование гистидина под действием фермента гистидазы (гистидин-аммиаклиазы) является внутримолекулярным, так как образование молекулы аммиака происходит из атомов самой аминокислоты без участия молекулы воды. Эта реакция происходит только в печени и коже
82. Основные источники аммиака в организме человека. Токсичность аммиака. Роль глутамина и аспарагина в обезвреживании аммиака. Глутаминаза почек, образование и выведение солей аммония.
Основные источники аммиака
| Источник | Процесс | Ферменты | Локализация процесса |
| Аминокислоты | Непрямое дезаминирование (основной путь дезаминирования аминокислот) | Аминотрансферазы, ПФ Глутаматдегидрогеназа, NAD+ | Все ткани |
| | Окислительное дезаминирование глутамата | Глутаматдегидрогеназа, NAD+ | Все ткани |
| | Неокислительное дезаминирование Гис, Сер, Тре | Гистидаза-Серин, треониндегидратазы, ПФ | Преимущественно печень |
| | Окислительное дезаминирование аминокислот (малозначимый путь дезаминирования) | Оксидаза L-аминокислот, FMN | Печень и почки |
| Биогенные амины | Окислительное дезаминирование (путь инактивации биогенных аминов) | Аминооксидазы, FAD | Все ткани |
| АМФ | Гидролитическое дезаминирование | АМФ-дезаминаза | Интенсивно работающая мышца |
Аммиак - токсичное соединение. Даже небольшое повышение его концентрации оказывает неблагоприятное действие на организм, и прежде всего на ЦНС. Так, повышение концентрации аммиака в мозге до 0,6 ммоль вызывает судороги. К симптомам гипераммониемии относят тремор, нечленораздельную речь, тошноту, рвоту, головокружение, судорожные припадки, потерю сознания. В тяжёлых случаях развивается кома с летальным исходом.
Механизм токсического действия аммиака на мозг и организм в целом, очевидно, связан с действием его на несколько функциональных систем.
Аммиак легко проникает через мембраны в клетки и в митохондриях сдвигает реакцию, катализируемую глутаматдегидрогеназой, в сторону образования глугамата:
α-Кетоглутарат + NADH + Н+ + NH3 → Глутамат + NAD+.
Уменьшение концентрации α-кетоглутарата вызывает:
угнетение обмена аминокислот (реакции транса-минирования) и, следовательно, синтеза из них нейромедиаторов (ацетилхолина, дофамина и др.);
гипоэнергетическое состояние в результате снижения скорости ЦТК.
Недостаточность α-кетоглутарата приводит к снижению концентрации метаболитов ЦТК, что вызывает ускорение реакции синтеза оксалоа-цетата из пирувата, сопровождающейся интенсивным потреблением СО2. Усиленное образование и потребление диоксида углерода при гипераммониемии особенно характерны для клеток головного мозга.
Повышение концентрации аммиака в крови сдвигает рН в щелочную сторону (вызываеталкалоз). Это, в свою очередь, увеличивает сродство гемоглобина к кислороду, что приводит к гипоксии тканей, накоплению СО2 и гипоэнергетическому состоянию, от которого главным образом страдает головной мозг.
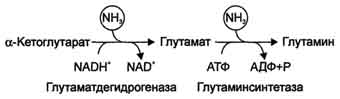
Высокие концентрации аммиака стимулируют синтез глутамина из глутамата в нервной ткани (при участии глутаминсинтетазы):
Глутамат + NH3 + АТФ → Глутамин + АДФ + Н3Р04.
Накопление глутамина в клетках нейроглии приводит к повышению осмотического давления в них, набуханию астроцитов и в больших концентрациях может вызвать отёк мозга. Снижение концентрации глутамата нарушает обмен аминокислот и нейромедиаторов, в частности синтез у-аминомасляной кислоты (ГАМК), основного тормозного медиатора. При недостатке ГАМК и других медиаторов нарушается проведение нервного импульса, возникают судороги.
Ион NH4+ практически не проникает через цитоплазматические и митохондриальные мембраны. Избыток иона аммония в крови способен нарушать трансмембранный перенос одновалентных катионов Na+ и К+, конкурируя с ними за ионные каналы, что также влияет на проведение нервных импульсов.
Связывание (обезвреживание) аммиака
Высокая интенсивность процессов дезаминирования аминокислот в тканях и очень низкий уровень аммиака в крови свидетельствуют о том, что в клетках активно происходит связывание аммиака с образованием нетоксичных соединений, которые выводятся из организма с мочой. Эти реакции можно считать реакциями обезвреживания аммиака. В разных тканях и органах обнаружено несколько типов таких реакций.
Основной реакцией связывания аммиака, протекающей во всех тканях организма, является синтез глутамина под действием глутамин-синтетазы:
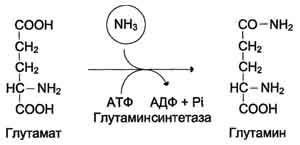
Глутаминсинтетаза локализована в митохондриях клеток, для работы фермента необходим кофактор - ионы Mg2+. Глутаминсинтетаза - один из основных регуляторных ферментов обмена аминокислот и аллостерически ингибируется АМФ, глюкозо-6-фосфатом, а также Гли, Ала и Гис.
Глутамин легко транспортируется через клеточные мембраны путём облегчённой диффузии (для глутамата возможен только активный транспорт) и поступает из тканей в кровь. Основными тканями-поставщикам:и глутамина служат мышцы, мозг и печень. С током крови глутамин транспортируется в кишечник и почки.
В клетках кишечника под действием фермента глутаминазы происходит гидролитическое освобождение амидного азота в виде аммиака:
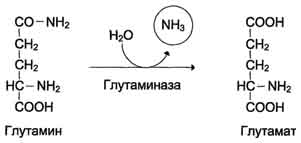
Образовавшийся в реакции глутамат подвергается трансаминированию с пируватом. ос-Аминогруппа глутаминовой кислоты переносится в состав аланина . Большие количества аланина поступают из кишечника в кровь воротной вены и поглощаются печенью. Около 5% образовавшегося аммиака удаляется в составе фекалий, небольшая часть через воротную вену попадает в печень, остальные 90% выводятся почками.
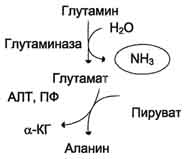
Рис. 9-10. Метаболизм азота глутамина в кишечнике.
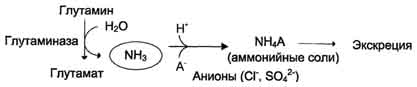
В почках также происходит гидролиз глутамина под действием глутаминазы с образованием аммиака. Этот процесс является одним из механизмов регуляции кислотно щелочного равновесия в организме и сохранения важнейших катионов для поддержания осмотического давления. Глутаминаза почек значительно индуцируется при ацидозе, образующийся аммиак нейтрализует кислые продукты обмена и в виде аммонийных солей экскретируется с мочой (рис. 9-11). Эта реакция защищает организм от излишней потери ионов Na+ и К+, которые также могут использоваться для выведения анионов и утрачиваться. При алкалозе количество глутаминазы в почках снижается.
В почках образуется и выводится около 0,5 г солей аммония в сутки.
Высокий уровень глутамина в крови и лёгкость его поступления в клетки обусловливают использование глутамина во многих анаболических процессах. Глутамин - основной донор азота в организме. Амидный азот глутамина используется для синтеза пуриновых и пиримидиновых
Рис. 9-11. Метаболизм амидного азота глутамина в почках.
нуклеотидов, аспарагина, аминосахаров и других соединений (рис. 9-12).
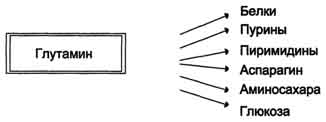
Рис. 9-12. Пути использования глутамина в организме.
Ещё одной реакцией обезвреживания аммиака в тканях можно считать синтез аспарагина под действием аспарагинсинтетазы.
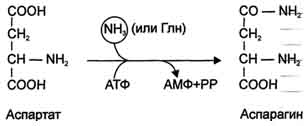
Существуют 2 изоформы этого фермента - глутаминзависимая и аммиакзависимая, которые используют разные доноры амидных групп. Первая функционирует в животных клетках, вторая преобладает в бактериальных клетках, но присутствует и у животных. Однако такой путь обезвреживания аммиака в клетках человека используется редко и к тому же требует больших энергетических затрат (энергию двух макроэргических связей), чем синтез глутамина.
Наиболее значительные количества аммиака обезвреживаются в печени путём синтеза мочевины. В первой реакции процесса аммиак связывается с диоксидом углерода с образованием карбамоилфосфата, при этом затрачиваются 2 молекулы АТФ. Реакция происходит в митохондриях гепатоцитов под действием фермента карбамоилфос-фатсинтетазы I. Карбамоилфосфатсинтетаза II локализована в цитозоле клеток всех тканей и участвует в синтезе гшримидиновых нуклеотидов (см. раздел 10). Карбамоилфосфат затем включается в орнитиновый цикл и используется для синтеза мочевины.
В мозге и некоторых других органах может протекать восстановительное аминирование α-кетоглутарата под действием глутаматдегидрогеназы, катализирующей обратимую реакцию. Однако этот путь обезвреживания аммиака в тканях используется слабо, так как глутаматдегидрогеназа катализирует преимущественно реакцию дезаминирования глутамата. Хотя, если учитывать последующее образование глутамина, реакция выгодна для клеток, так как способствует связыванию сразу 2 молекул NH3.
Из мышц и кишечника избыток аммиака выводится преимущественно в виде аланина. Этот механизм необходим, так как активность глутаматдегидрогеназы в мышцах невелика и непрямое дезаминирование аминокислот малоэффективно. Поэтому в мышцах существует ещё один путь выведения азота. Образование аланина в этих органах можно представить следующей схемой (см. схему ниже).
Аминогруппы разных аминокислот посредством реакций трансаминирования переносятся на пируват, основным источником которого служит процесс окисления глюкозы.
Мышцы выделяют особенно много аланина в силу их большой массы, активного потребления
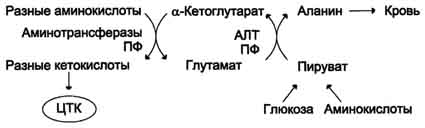
глюкозы при физической работе, а также потому, что часть энергии они получают за счёт распада аминокислот. Образовавшийся аланин поступает в печень, где подвергается непрямому дезаминированию. Выделившийся аммиак обезвреживается, а пируват включается в глюконеогенез. Глюкоза из печени поступает в ткани и там, в процессе гликолиза, опять окисляется до пирувата (рис. 9-13).
Образование аланина в мышцах, его перенос в печень и перенос глюкозы, синтезированной в печени, обратно в мышцы составляют глюкозо-аланиновый цикл, работа которого сопряжена с работой глюкозо-лактатного цикла .
110. Молекулярная структура миофибрилл. Структура и функция основных белков миофибрилл миозина, актина, тропомиозина, тропонина.

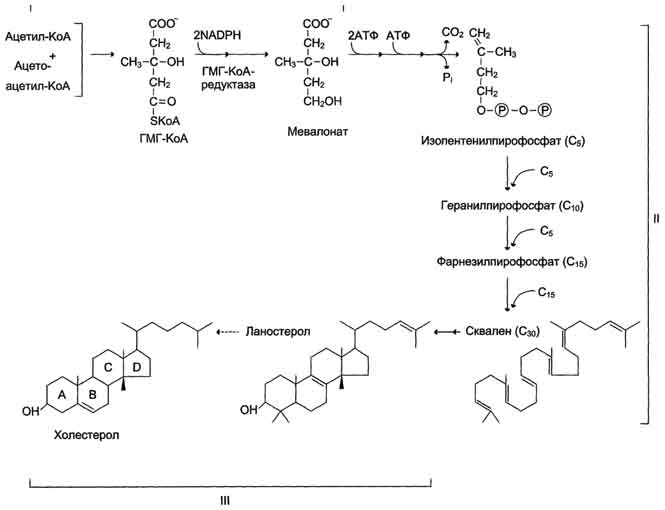
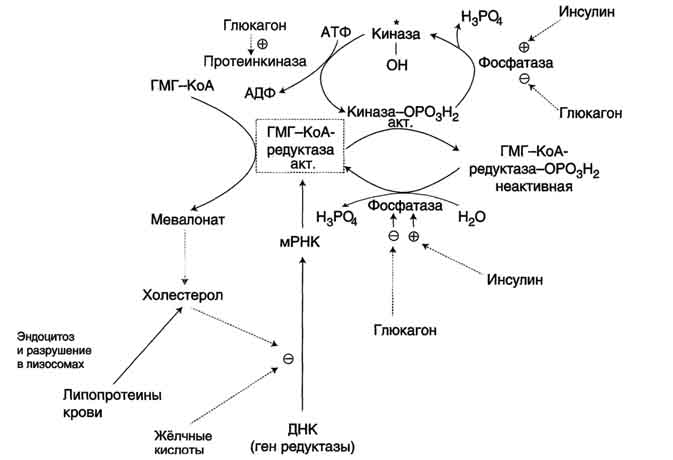
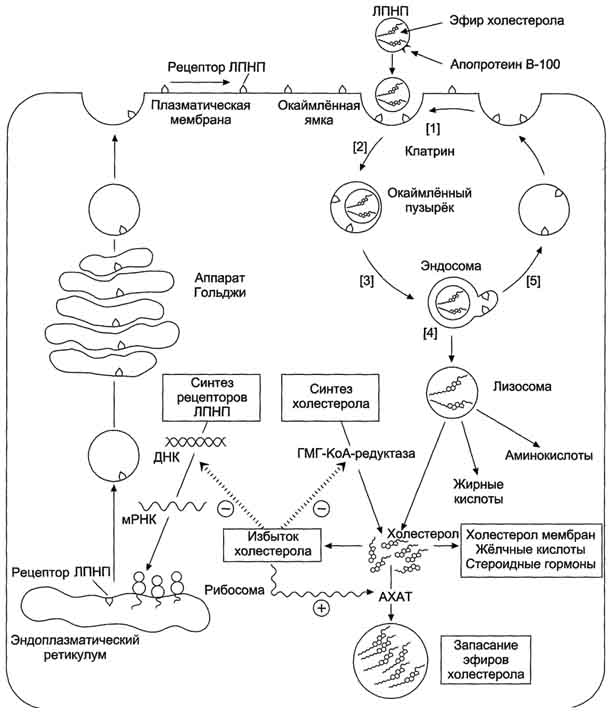
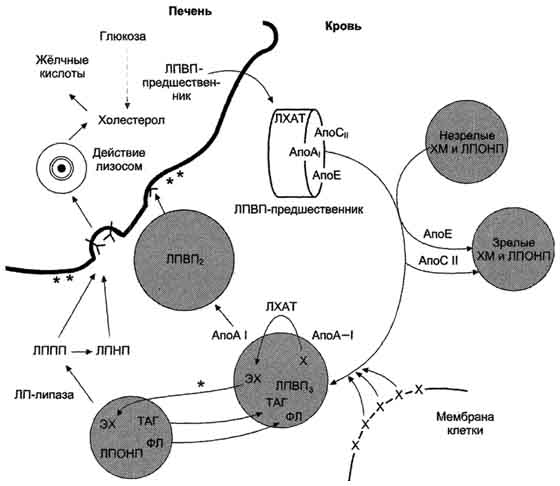
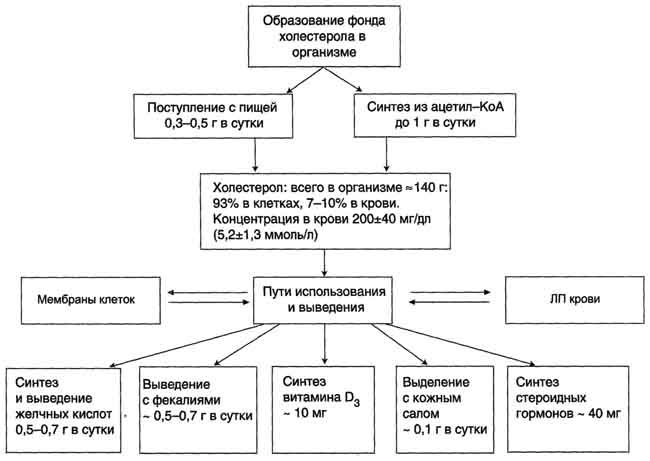 Фонд холестерола в организме, пути его использования и выведения.
Фонд холестерола в организме, пути его использования и выведения.