biokhimia_Vosstanovlen (Восстановлен). Предмет и задачи биологической химии. Обмен веществ и энергии, сложная структурная организация, гомеостаз и самовоспроизведение как важнейшие признаки живой материи
 Скачать 2.96 Mb. Скачать 2.96 Mb.
|
Основные белки миофибрилл
К группе миофибриллярных белков относятся миозин, актин и актомиозин – белки, растворимые в солевых средах с высокой ионной силой, и так называемые регуляторные белки: тропомиозин, тропонин, α- и β-актинин, образующие в мышце с актомиозином единый комплекс. Перечисленные миофибриллярные белки тесно связаны с сократительной функцией мышц Молекулярная масса миозина скелетных мышц около 500000. Молекула миозина (рис. 20.3) имеет сильно вытянутую форму, длину 150 нм. Она может быть расщеплена без разрыва ковалентных связей на субъединицы: две тяжелые полипептидные цепи с мол. массой 205000–210000 и несколько коротких легких цепей, мол. масса которых около 20000. Тяжелые цепи образуют длинную закрученную α-спираль («хвост» молекулы), конец каждой тяжелой цепи совместно с легкими цепями создает глобулу («головка» молекулы), способную соединяться с актином. Эти «головки» выдаются из основного стержня молекулы. Легкие цепи, находящиеся в «головке» миозиновой молекулы и принимающие участие в проявлении АТФазной активности миозина, гетерогенны по своему составу. 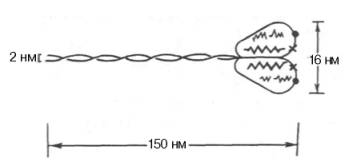 Строение молекулы миозина Актин, составляющий 20% от сухой массы миофибрилл, был открыт Ф. Штраубом в 1942 г. Известны две формы актина: глобулярный актин (G-актин) и фибриллярный актин (F-актин). Молекула G-актина с мол. массой 42000 состоит из одной полипептидной цепочки (глобула), в образовании которой принимают участие 374 аминокислотных остатка. При повышении ионной силы до физиологического уровня G-актин полимеризуется в F-актин (фибриллярная форма). На электронных микрофотографиях волокна F-актина выглядят как две нити бус, закрученных одна вокруг другой (рис. 20.5). Актиомиозин образуется при соединении миозина с F-актином. Актиомиозин, как естественный, так и искусственный, т.е. полученный путем соединения in vitro высокоочищенных препаратов миозина и F-актина, обладает АТФазной активностью, которая отличается от таковой миозина, АТФазная активность миозина значительно возрастает в присутствии стехиометрических количеств F-актина. Фермент актомиозин активируется ионами Mg2+и ингибируется этилендиаминтетраацетатом (ЭДТА) и высокой концентрацией АТФ, тогда как миозиновая АТФаза ингибируется ионами Mg2+, активируется ЭДТА и не ингибируется высокой концентрацией АТФ. Оптимальные значения рН для обоих ферментов также различны. Как отмечалось, кроме рассмотренных основных белков, в миофибриллах содержатся также тропомиозин, тропонин и некоторые другие регуляторные белки.  Структура тонкого филамента. 1 - актин; 2 - тропомиозин; 3 - тропонин С; 4 - тропонин I; 5 - тропонин Т. Тропомиозин был открыт К. Бейли в 1946 г. Молекула тропомиозина состоит из двух α-спиралей и имеет вид стержня длиной 40 нм; его мол. масса 65000. На долю тропомиозина приходится около 4–7% всех белков миофибрилл. Тропонин – глобулярный белок, открытый С. Эбаси в 1963 г.; его мол. масса 80000. В скелетных мышцах взрослых животных и человека тропонин (Тн) составляет лишь около 2% от всех миофибриллярных белков. В его состав входят три субъединицы (Тн-I, Тн-С, Тн-Т). Тн-I (ингибирующий) может ингибировать АТФазную активность, ТН-С (кальцийсвязывающий) обладает значительным сродством к ионам кальция, Тн-Т (тропомиозин-связывающий) обеспечивает связь с тропомиозином. Тропонин, соединяясь с тропомиозином, образует комплекс, названный нативным тропомиозином. Этот комплекс прикрепляется к актиновым филаментам и придает актомиозину скелетных мышц позвоночных чувствительность к ионам Са2+ . Установлено, что тропонин (его субъединицы Тн-Т и Тн-I) способен фосфорилироваться при участии цАМФ-зависимых протеинкиназ. 111. Биохимические механизмы мышечного сокращения и расслабления. Роль ионов кальция и других ионов в регуляции мышечного сокращения. Рассмотрим, к чему сводятся представления о механизме попеременного сокращения и расслабления мышц. В настоящее время принято считать, что биохимический цикл мышечного сокращения состоит из 5 стадий (рис. 20.8): 1) миозиновая «головка» может гидролизовать АТФ до АДФ и Н3РО4 (Pi), но не обеспечивает освобождения продуктов гидролиза. Поэтому данный процесс носит скорее стехиометрический, чем каталитический, характер (см. рис. 20.8, а); 2) содержащая АДФ и Н3РО4 миозиновая «головка» может свободно вращаться под большим углом и (при достижении нужного положения) связываться с F-актином, образуя с осью фибриллы угол около 90° (см. рис. 22.8, б); 3) это взаимодействие обеспечивает высвобождение АДФ и Н3РО4 из актин-миозинового комплекса. Актомиозиновая связь имеет наименьшую энергию при величине угла 45°, поэтому изменяется угол миозина с осью фибриллы с 90° на 45° (примерно) и происходит продвижение актина (на 10–15 нм) в направлении центра саркомера (см. рис. 20.8, в); 4) новая молекула АТФ связывается с комплексом миозин–F-актин (см. рис. 20.8, г); Рис. 20.8. Биохимический цикл мышечного сокращения. Объяснение в тексте. 5) комплекс миозин–АТФ обладает низким сродством к актину, и поэтому происходит отделение миозиновой (АТФ) «головки» от F-актина. Последняя стадия и есть собственно расслабление, которое отчетливо зависит от связывания АТФ с актин-миозиновым комплексом (см. рис. 20.8, д). Затем цикл возобновляется. 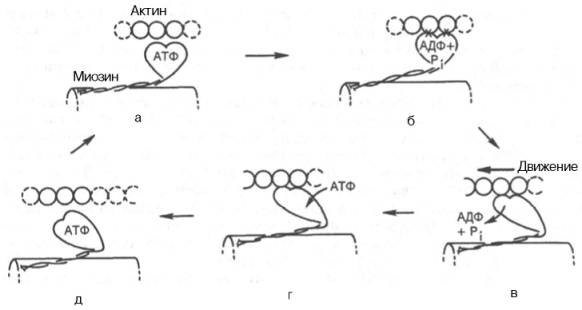 Регуляция сокращения и расслабления мышц. Сокращение любых мышц происходит по общему механизму, описанному ранее. Мышечные волокна разных органов могут обладать различными молекулярными механизмами регуляции сокращения и расслабления, однако всегда ключевая регулятор-ная роль принадлежит ионам Са2+. Установлено, что миофибриллы обладают способностью взаимодействовать с АТФ и сокращаться в его присутствии лишь при наличии в среде определенных концентраций ионов кальция . Наибольшая сократительная активность наблюдается при концентрации ионов Са2+ около 10–6–10–5 М. При понижении концентрации до 10–7 М или ниже мышечные волокна теряют способность к укорочению и развитию напряжения в присутствии АТФ. По современным представлениям, в покоящейся мышце (в миофибрил-лах и межфибриллярном пространстве) концентрация ионов Са2+ поддерживается ниже пороговой величины в результате связывания их структурами (трубочками и пузырьками) саркоплазматической сети и так называемой Т-системой при участии особого Са2+-связывающего белка, получившего название кальсеквестрина, входящего в состав этих структур. Связывание ионов Са2+ разветвленной сетью трубочек и цистерн сарко-плазматической сети не является простой адсорбцией. Это активный физиологический процесс, который осуществляется за счет энергии, освобождающейся при расщеплении АТФ Са2+-зависимой АТФазой саркоплазматической сети . При этом наблюдается весьма своеобразная картина: скорость выкачивания ионов Са2+ из межфибриллярного пространства стимулируется этими же ионами. В целом такой механизм получил название «кальциевая помпа» по аналогии с хорошо известным в физиологии натриевым насосом. Возможность пребывания живой мышцы в расслабленном состоянии при наличии в ней достаточно высокой концентрации АТФ объясняется снижением в результате действия кальциевой помпы концентрации ионов Са2+ в среде, окружающей миофибриллы, ниже того предела, при котором еще возможны проявление АТФазной активности и сократимость акто-миозиновых структур волокна. Быстрое сокращение мышечного волокна при его раздражении от нерва (или электрическим током) является результатом внезапного изменения проницаемости мембран и как следствие выхода из цистерн и трубочек саркоплазматической сети и Т-системы некоторого количества ионов Са2+ в саркоплазму. Как отмечалось, «чувствительность» актомиозиновой системы к ионам Са2+ (т.е. потеря актомиозином способности расщеплять АТФ и сокращаться в присутствии АТФ при снижении концентрации ионов Са2+ до 10–7 М) обусловлена присутствием в контрактильной системе (на нитях F-акти-на) белка тропонина, связанного с тропомиозином. В тропонин-тропомио-зиновом комплексе ионы Са2+ связываются именно с тропонином. В молекуле тропонина при этом происходят конформационные изменения, которые, по-видимому, приводят к сдвигу всего тропонин-тропомиози-нового стержня и деблокировке активных центров актина, способных взаимодействовать с миозином с образованием сократительного комплекса и активной Mg2+-АТФазы. В продвижении актиновых нитей вдоль миозиновых, по данным Э. Хаксли, важную роль играют временно замыкающиеся между нитями поперечные мостики, которые являются «головками» миозиновых молекул. Итак, чем большее число мостиков прикреплено в данный момент к акти-новым нитям, тем больше сила мышечного сокращения. Наконец, если возбуждение прекращается, содержание ионов Са2+ в саркоплазме снижается (кальциевая помпа), то циклы прикрепление–освобождение прекращаются, т.е. «головки» миозиновых нитей перестают прикрепляться к актиновым нитям. В присутствии АТФ мышца расслабляется и ее длина достигает исходной. Если прекращается поступление АТФ (аноксия, отравление дыхательными ядами или смерть), то мышца переходит в состояние окоченения. Почти все поперечные мостики толстых (миозиновых) нитей присоединены при этом к тонким актиновым нитям, следствием чего и является полная неподвижность мышцы. 112. Саркоплазматические белки. Миоглобин, его строение и функции. Карнозин и анзерин. Особенности энергетического обмена в мышцах; роль креатинфосфата. Белки, входящие в состав саркоплазмы, относятся к протеинам, растворимым в солевых средах с низкой ионной силой. Принятое ранее подразделение саркоплазматических белков на миоген, глобулин X, миоальбумин и белки-пигменты в значительной мере утратило смысл, поскольку существование глобулина X и миогена как индивидуальных белков в настоящее время отрицается. Установлено, что глобулин X представляет собой смесь различных белковых веществ со свойствами глобулинов. Термин «миоген» также является собирательным понятием. В частности, в состав белков группы миогена входит ряд протеинов, наделенных ферментативной активностью: например, ферменты гликолиза. К числу саркоплазмати-ческих белков относятся также дыхательный пигмент миоглобин и разнообразные белки-ферменты, локализованные главным образом в митохондриях и катализирующие процессы тканевого дыхания, окислительного фосфорилирования, а также многие стороны азотистого и липидного обмена. Недавно была открыта группа саркоплазматических белков – пар-вальбумины, которые способны связывать ионы Са2+. Их физиологическая роль остается еще неясной. Миоглоби́н — Белок, содержащийся в клетках скелетных мышц и в миокарде, обеспечивающий в них депонирование кислорода. Молекула миоглобина образована единичной полипептидной цепью и железосодержащим гемом, сходна по строению и функциям с гемоглобином крови. Миоглобин связывает кислород (образуется оксимиоглобин) и является основным его поставщиком для скелетных мышц. При гипоксии (например, при интенсивной физической нагрузке) кислород высвобождается из комплекса с миоглобином и поступает в митохондрии миоцитов, где осуществляется синтез АТФ. Выводится миоглобин в неизмененном виде с мочой, поэтому его концентрация также зависит от функции почек. При любом повреждении, некрозе, лизисе ткани скелетной мускулатуры или миокарда миоглобин поступает в кровь. При инфаркте миокарда выраженность гипермиоглобинемии находится в прямой зависимости от размеров очага некроза. Это один из самых ранних маркеров инфаркта миокарда (обнаруживается уже через 2 часа после приступа, увеличение концентрации может быть 10-кратным), предполагается, что быстрое поступление в кровь связано с относительно малыми размерами молекулы, этим же объясняется и быстрое выведение его почками из крови. Миоглобин - неспецифический маркёр инфаркта миокарда, поэтому диагноз должен подтверждаться более специфичными для поражения миокарда маркёрами. Подобно гемоглобину, миоглобин высокотоксичен при его нахождении в свободном состоянии в плазме крови: крупные молекулы миоглобина могут закупоривать канальцы почек и приводить к их некрозу; конкурируя с гемоглобином эритроцитов за связывание с кислородом в лёгких и не выполняя функцию отдавания кислорода тканям, свободный миоглобин ухудшает кислородное снабжение тканей и приводит к развитию тканевой гипоксии. Самоотравление организма свободным миоглобином и как следствие острая почечная недостаточность и тканевая гипоксия — одна из главных причин смерти при синдроме длительного сдавливания (крэш-синдром), встречающемся при тяжелых травмах со сдавлением или размозжением значительных количеств мышечной ткани. Карнозин (Carnosine или beta-alanyl-L-histidine) - дипептид, состоящий из бета-аланина и гистидина. Наибольшая концентрация карнозина в организме определяется в мозге и мышцах. Карнозин был впервые обнаружен в составе мышечного экстракта русским ученым-биохимиком Владимиром Сергеевичем Гулевичем в 1900 г. Анзерин – дипептид, состоящий из двух аминокислот – метилгистидина и бета-аланина; был обнаружен в 1929 Натальей Толкачевской, ученицей В.С. Гулевича, в составе мышц гуся Anser anser. Анзерин – метилированное производное карнозина, вместе с которым обнаруживается только в мышечной и нервной тканях позвоночных животных и человека (в основном, в скелетной мускулатуре). В 1954 С.Е. Северин, ученик В.С. Гулевича, впервые описал биологическую функцию карнозина и анзерина – их способность устранять мышечное утомление и обеспечивать многократное увеличение работоспособности изолированной мышцы в экспериментальных условиях. Позже была обнаружена протекторная способность этих соединений и относительно нейронов головного мозга (1994–1996), а также их антиоксидантная активность. Положительное действие карнозина и родственных ему анзерина и офидина, основано на способности этих соединений служить внутриклеточным буфером протонов (снижение кислотности), активных форм кислорода (антиоксидантные свойства) и тяжелых металлов. Буферные свойства, существенно более выраженные у анзерина (и еще более – у офидина), позволяет этим соединениям снимать мышечную усталость, восстанавливать работоспособность организма, оптимизировать метаболические процессы в клетках, замедлять дегенерацию нейронов головного мозга при старческой или патологической (болезнь Альцгеймера) деменции. В качестве пищевой добавки для повышения содержания карнозина и анзерина в мышцах принимается бета-аланин, т.к. карнозин и анзерин пищи под действием пищеварительных ферментов быстро распадаются на составляющие их бета-аланин и гистидин, и в дальнейшем в мышцах происходит новообразование карнозина. При этом в мышцах человека в норме наблюдается дефицит только бета-аланина; гистидин содержится в достаточных количествах. Однако вегетарианцы могут испытывать дефицит и гистидина тоже, но для восполнения дефицита гистидина им рекомендуется принимать не гистидин наряду с аланином, а побольше белка! Энергетический обмен в мышечной ткани 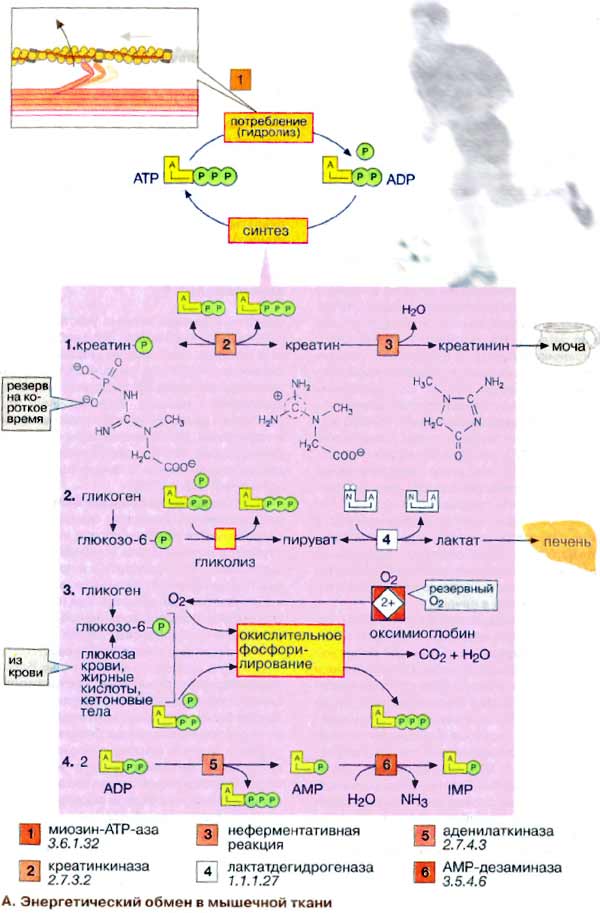 Важнейшей функцией мышечного волокна является сократительная. Процесс сокращения и расслабления связан с потреблением АТФ (АТР), гидролиз которого катализирует миозин-АТФ-аза [1] (см. рис. 325). Важнейшей функцией мышечного волокна является сократительная. Процесс сокращения и расслабления связан с потреблением АТФ (АТР), гидролиз которого катализирует миозин-АТФ-аза [1] (см. рис. 325).Однако небольшой запас АТФ, имеющийся в мышцах, расходуется менее чем за 1 с после стимуляции. Потребности работающей мышцы в АТФ удовлетворяются за счет следующих ферментативных реакций: 1. Резерв в виде креатинфосфата. Быстрая регенерация АТФ может быть достигнута за счет переноса фосфатной группы креатинфосфата на АДФ (ADP) в реакции, катализируемой креатинкиназой [2]. Однако и этот мышечный резерв «высокоэргического фосфата» расходуется в течение нескольких секунд. В спокойном состоянии креатинфосфат вновь синтезируется из креатина. При этом фосфатная группа присоединяется по гуанидиновой группе креатина (N-гуанидино-N-метилглицина). Креатин, который синтезируется в печени, поджелудочной железе и почках, в основном накапливается в мышцах. Здесь креатин медленно циклизуется за счет неферментативной реакции [3] с образованием креатинина, который поступает в почки и удаляется из организма (см. рис. 317). 2 Анаэробный гликолиз. В мышечной ткани наиболее важным долгосрочным энергетическим резервом является гликоген (см. рис. 159). В покоящейся ткани содержание гликогена составляет до 2% от мышечной массы. При деградации под действием фосфорилазы гликоген легко расщепляется с образованием глюкозо-6-фосфата, который при последующем гликолизе превращается в пируват. При большой потребности в АТФ и недостаточном поступлении кислорода пируват за счет анаэробного гликолиза восстанавливается в молочную кислоту (лактат), которая диффундирует в кровь (цикл Кори, см. рис. 331). 3. Окислительное фосфорилирование. В аэробных условиях образующийся пируват поступает в митохондрии, где подвергается окислению. Окислительное фосфорилирование (см. с. 143) - наиболее эффективный и постоянно действующий путь синтеза АТФ. Однако этот путь реализуется при условии хорошего снабжения мышц кислородом. Наряду с глюкозой, образующейся при расщеплении мышечного гликогена, для синтеза АТФ используются и другие "энергоносители", присутствующие в крови: глюкоза крови, жирные кислоты и кетоновые тела. 4. Образование инозинмонофосфата [ИМФ (IMP)]. Другим источником быстрого восстановления уровня АТФ является конверсия АДФ в АТФ и АМФ (AMP), катализируемая аденилаткиназой (миокиназой) [5]. Образовавшийся АМФ за счет дезаминирования частично превращается в ИМФ (инозинмонофосфат) (см. рис. 191), что сдвигает реакцию в нужном направлении. Из всех способов синтеза АТФ наиболее продуктивным является окислительное фосфорилирование. За счет этого процесса обеспечиваются потребности в АТФ постоянно работающей сердечной мышцы (миокарда). Вот почему для успешной работы сердечной мышцы обязательным условием является достаточное снабжение кислородом (инфаркт миокарда — это следствие перебоев в поступлении кислорода). В высокоактивных (красных) скелетных мышцах источником энергии для рефосфорилирования АДФ служит окислительное фосфорилирование в митохондриях. В обеспечении этих мышц кислородом принимает участие миоглобин (Mb) - близкий гемоглобину белок, обладающий свойством запасать кислород. В малоактивных скелетных мышцах, лишенных красного миоглобина и поэтому белых, главным источником энергии для восстановления уровня АТФ является анаэробный гликолиз. Такие мышцы сохраняют способность к быстрым сокращениям, однако они могут работать лишь короткое время, поскольку при гликолизе образование АТФ идет с низким выходом. Спустя некоторое время мышцы истощаются в результате изменения рН в мышечных клетках. Расщепление гликогена контролируется гормонами (см. рис. 123). Процесс гликогенолиза стимулируется адреналином (через b-рецепторы) за счет образования цАМФ и активации киназы фосфорилазы. Активация фосфорилазы наступает также при увеличении концентрации ионов Са2+ во время мышечного сокращения. 113. Химический состав нервной ткани. Миелиновые мембраны: особенности состава и структуры. 1. ХИМИЧЕСКИЙ СОСТАВ НЕРВНОЙ ТКАНИ. Химический состав нервной ткани сложен и неоднороден, как в целом и сама нервная ткань. Отличия в химическом составе носят в основном количественный характер. В сером веществе 77 -81% воды, в белом-70%. Содержание белков в нервной ткани меньше, чем в некоторых других тканях (печень, мышцы). Их больше в сером веществе и меньше в периферических нервах. В нервной ткани содержится больше сложных белков: ЛИПОПРОТЕИНЫ (миелиновые оболочки), ФОСФОПРОТЕИНЫ, НУКЛЕОПРОТЕИНЫ (ДНП, РНП), ГЛИКОПРОТЕИНЫ (нейрокератин), En. Наибольший интерес представляют нейроспецифические белки: 1. белок S-100 (растворим в 100% растворе (NH4)2SO4). Он повышается в ткани мозга в эксперименте при обучении и эмоциональном воздействии. Считают, что этот белок отвечает за формирование зависимостей (алкогольной, наркотической). ПРОПРОТЕИН - антитело к белку S-100, понижает его содержание в ткани мозга. 2. Белок 14-3-2 играет важную роль в формировании памяти. 3. НЕЙРОПЕПТИДЫ - играют роль нейромедиаторов и гормонов. Пептиды памяти, боли, сна. Не белковые азотистые соединения те же самые, что и в других тканях, но отличаются по количественному составу. В нервной ткани много свободных аминокислот, г.о. дикарбоновых (ГЛУ, ГЛН, ACП, АСН), ГАМК, ароматические аминокислоты, ЦАМФ и ЦГМФ. Углеводов незначительное количество: 1. резервные углеводы - гликоген (0,1 %) 2. глюкоза (1 -4мкмоль/л) 3. гексозофосфаты 4. триозофосфаты 5. ПВК 6. молочная кислота. ЛИПИДОВ в сером веществе 25%, в белом веществе 50%. 1. ФОСФОЛИПИДЫ (до 50%) - ПЛАЗМОГЕН АЦЕТАЛЬФОСФАТИДЫ. 2. ГЛИКОЛИПИДЫ - ЦЕРЕБРОЗИДЫ, ГАНГЛИОЗИДЫ. 3. ВЖК - в основном непредельные, содержащие по 4 - 5 двойных связей. 4. Холестерин (25%) в свободном виде. Мозг даже называют депо холестерина. 5. Нейтральные жиры - в незначительном количестве в головном, но в большом количестве в периферических нервах. Минеральные вещества представлены катионами калия, натрия, кальция, магния, железа, меди, цинка, в качестве анионов выступают анионы белков и фосфаты. Миелиновая оболочка — электроизолирующая оболочка, покрывающая аксоны многих нейронов. Миелиновую оболочку образуют глиальные клетки: в периферической нервной системе — Шванновские клетки, в центральной нервной системе —олигодендроциты. Миелиновая оболочка формируется из плоского выроста тела глиальной клетки, многократно оборачивающего аксон подобно изоляционной ленте. Цитоплазма в выросте практически отсутствует, в результате чего миелиновая оболочка представляет собой, по сути, множество слоёв клеточной мембраны. Миелин прерывается только в области перехватов Ранвье, которые встречаются через правильные промежутки длиной примерно 1 мм. В связи с тем, что ионные токи не могут проходить сквозь миелин, вход и выход ионов осуществляется лишь в области перехватов. Это ведёт к увеличению скорости проведения нервного импульса. Таким образом, по миелинизированным волокнам импульс проводится приблизительно в 5—10 раз быстрее, чем по немиелинизированным. Из вышесказанного становится ясным, что миелин и миелиновая оболочка являются синонимами. Обычно термин миелин употребляется в биохимии, вообще при упоминании его молекулярной организации, а миелиновая оболочка — в морфологии и физиологии. Химический состав и структура миелина, произведённого разными типами глиальных клеток, различны. Цвет миелинизированных нейронов — белый, отсюда название «белого вещества» мозга. Приблизительно на 70—75 % миелин состоит из липидов, на 25—30 % — из белков. Такое высокое содержание липидов отличает миелин от других биологических мембран. Склерозы, аутоиммунные заболевания, связанные с разрушением миелиновой оболочки аксонов в некоторых нервах, приводит к нарушению координации и равновесия. 114. Энергетический обмен в нервной ткани. Значение аэробного распада глюкозы. 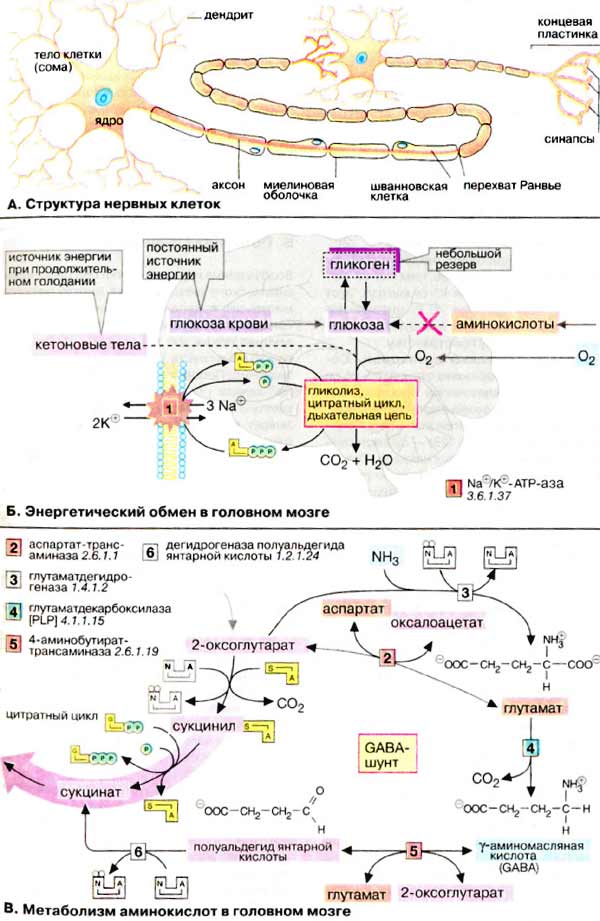 Энергетический обмен головного мозга Головной мозг хорошо снабжается кровью и имеет интенсивный энергетический обмен. Хотя головной мозг составляет около 2% массы тела, при спокойном состоянии организма он утилизирует около 20% поглощенного кислорода и 60% глюкозы, которая полностью окисляется до СО2 и Н2О в цитратном цикле и путем гликолиза. В клетках головного мозга практически единственным источником энергии, который должен поступать постоянно, является глюкоза. Только при продолжительном голодании клетки начинают использовать дополнительный источник энергии — кетоновые тела (см. рис. 305). Запасы гликогена в клетках головного мозга незначительны. Жирные кислоты, которые в плазме крови транспортируются в виде комплекса с альбумином, не достигают клеток головного мозга из-за гематоэнцефалического барьера. Аминокислоты не могут служить источником энергии для синтеза АТФ (АТР), поскольку в нейронах отсутствует глюконеогенез. Зависимость головного мозга от глюкозы означает, что резкое падение уровня глюкозы в крови, например, в случае передозировки инсулина у диабетиков, может стать опасным для жизни. В клетках центральной нервной системы наиболее энергоемким процессом, потребляющим до 40% производимого АТФ, является функционирование транспортной Na+/К+-АТФ-азы (Na+/K+-«насоса») клеточных мембран [1] (см. рис. 221). Активный транспорт ионов Na+ и К+ компенсирует постоянный поток ионов через ионные каналы. Кроме того, АТФ используется во многих биосинтетических реакциях. 115. Медиаторы нервной системы: ацетилхолин, катехоламины, серотонин, γ-аминомасляная кислота, глицин, глутамат, гистамин. Физиологически активные пептиды мозга. Ацетилхолин (лат. Acetylcholinum) — нейромедиатор, осуществляющий нервно-мышечную передачу, а также основной нейромедиатор в парасимпатической нервной системе. Четвертичное аммониевое основание. В организме очень быстро разрушается специализированным ферментом — ацетилхолинэстеразой. Ацетилхолину принадлежит также важная роль как медиатор ЦНС. Он участвует в передаче импульсов в разных отделах мозга, при этом малые концентрации облегчают, а большие — тормозят синаптическую передачу. Изменения в обмене ацетилхолина могут привести к нарушению функций мозга. Недостаток его во многом определяет клиническую картину такого опасного нейродегенеративного заболевания, как болезнь Альцгеймера. Некоторыецентральнодействующие антагонисты ацетилхолина (см. Амизил) являются психотропными препаратами (см. также Атропин). Передозировка антагонистов ацетилхолина может вызвать нарушения высшей нервной деятельности (оказывать галлюциногенный эффект и др.). Катехоламины — физиологически активные вещества, выполняющие роль химических посредников и «управляющих» молекул (медиаторов и нейрогормонов) в межклеточных взаимодействиях у животных и человека, в том числе в их мозге; производныепирокатехина. К катехоламинам относятся, в частности, такие нейромедиаторы, как адреналин, норадреналин, дофамин (допамин). Адреналин часто, особенно в западной литературе, называют «эпинефрин» (то есть «вещество надпочечников»). Соответственно, норадреналин ча сто называют «норэпинефрин». Все высшие формы поведения человека связаны с нормальной жизнедеятельностью катехоламинергических клеток - нервных клеток, синтезирующих катехоламины и использующих их в качестве медиатора. От активности синтеза и выделения катехоламинов зависят такие сложные процессы, как запоминание и воспроизведение информации, сексуальное поведение, агрессивность и поисковая реакция, уровень настроения и активность в жизненной борьбе, скорость мышления, эмоциональность, уровень общего энергетического потенциала и т.д. Чем активнее идет синтез и выделение катехоламинов в количественном отношении, тем выше настроение, общий уровень активности, сексуальность, скорость мышления, да и просто работоспособность. Самый высокий уровень катехоламинов (на единицу массы тела) у детей. Дети отличаются от взрослых прежде всего очень высокой эмоциональностью и подвижностью, способность к быстрому переключению мышления с одного объекта на другой. У детей исключительно хорошая память, всегда хорошее настроение, высокая обучаемость и колоссальная работоспособность. С возрастом синтез катехоламинов как в центральной нервной системе, так и на периферии замедляется. Тому есть разные причины: это и старение клеточных мембран, и исчерпание генетических резервов, и общее снижение синтеза белка в организме. В результате снижения скорость мыслительных процессов, уменьшается эмоциональность, снижается настроение. С возрастом все эти явления усугубляются: снижается эмоциональность, настроение, нередки случаи депрессии. Причина этого в одном - в возрастном снижении синтеза катехоламинов в организме. Высокое содержание в нервной системе дофамина усиливает все сексуальные рефлексы и повышает чувствительность клеток к половым гормонам, что способствует высокому анаболизму. Самым высоким содержанием дофамина в ЦНС отличаются подростки. Их настроение носит на себе налет эйфории, а поведение отличается выраженной гиперсексуальностью. Любые тренировки, даже неправильные с методической точки зрения, в подростковом возрасте дают хороший анаболический эффект. Возрастное падение содержания дофамина вызывает возрастную депрессию (снижение настроения), падение сексуальной активности (у мужчин) и замедление скорости анаболических реакций. Катехоламины увеличивают нервно-мышечную проводимость, повышают быстроту реакции и скорость мышления. Даже поверхностное знакомство с обменом катехоламинов в организме помогает нам сделать вывод, что катехоламины являются ключевым звеном как в умственной, так и в физической работоспособности, как в скорости, так и в качестве мышления. Творческие способности, способность к абстрактному и художественному мышлению, к анализу и синтезу напрямую зависит от катехоламинового обмена. Серотони́н, 5-гидрокситриптамин, 5-НТ — один из основных нейромедиаторов. По химическому строению серотонин относится к биогенным аминам, классу триптаминов. Серотонин играет роль нейромедиатора в ЦНС. Серотонинергические нейроны группируются в стволе мозга: в варолиевом мосту и ядрах шва. От моста идут нисходящие проекции в спинной мозг, нейроны ядер шва дают восходящие проекции к мозжечку, лимбической системе, базальным ганглиям, коре. При этом нейроны дорсального и медиального ядер шва дают аксоны, различающиеся морфологически, электрофизиологически, мишенями иннервации и чувствительностью к некоторым нейротоксичным агентам, например, метамфетамину. Серотонин облегчает двигательную активность, благодаря усилению секреции субстанции Р в окончаниях сенсорных нейронов путем воздействия на ионотропные и метаботропные рецепторы. Серотонин наряду с дофамином играет важную роль в механизмах гипоталамической регуляции гормональной функции гипофиза. Стимуляция серотонинергических путей, связывающих гипоталамус с гипофизом, вызывает увеличение секреции пролактина и некоторых других гормонов передней доли гипофиза — действие, противоположное эффектам стимуляции дофаминергических путей. Серотонин также участвует в регуляции сосудистого тонуса. γ-Аминомасляная кислота (ГАМК, GABA) — аминокислота, важнейший тормозной нейромедиатор центральной нервной системы человека и млекопитающих. Аминомасляная кислота является биогенным веществом. Содержится в ЦНС и принимает участие в нейромедиаторных и метаболических процессах в мозге. γ-Аминомасляная кислота выполняет в организме функцию ингибирующего медиатора центральной нервной системы. При выбросе ГАМК в синаптическую щель происходит активация ионных каналов ГАМКA- и ГАМКC-рецепторов, приводящая к ингибированию нервного импульса. Лиганды рецепторов ГАМК рассматриваются как потенциальные средства для лечения различных расстройств психики и центральной нервной системы, к которым относятся болезни Паркинсона и Альцгеймера, расстройства сна (бессонница, нарколепсия), эпилепсия. Установлено, что ГАМК является основным нейромедиатором, участвующим в процессах центрального торможения. Под влиянием ГАМК активируются также энергетические процессы мозга, повышается дыхательная активность тканей, улучшается утилизация мозгом глюкозы, улучшается кровоснабжение. Действие ГАМК в ЦНС осуществляется путём её взаимодействия со специфическими ГАМКергическими рецепторами, которые в последнее время подразделяют на ГАМК-А- и ГАМК-Б-рецепторы и др. В механизме действия целого ряда центральных нейротропных веществ (снотворных, противосудорожных, судорожных и др.) существенную роль играет их агонистическое илиантагонистическое взаимодействие с ГАМК-рецепторами. Бензодиазепины потенцируют действие ГАМК. Наличие ГАМК в ЦНС было обнаружено в середине 50-х годов, вскоре был осуществлен её синтез[кто?]. В конце 60-х годов под названием «Гаммалон» ГАМК была предложена для применения в качестве лекарственного средства за рубежом, затем — под названием «Аминалон» — в России. По экспериментальным данным, ГАМК при введении в организм плохо проникает через гематоэнцефалический барьер, однако есть свидетельства того, что ГАМК транспортируется в мозг с помощью специфических мембранных транспортеров GAT2 и BGT-1 (PMID: 1159850). При применении ГАМК для лечебных целей при наличии церебральной патологии установлено, что она улучшает динамику нервных процессов в головном мозге, мышление, память, оказывает мягкое психостимулирующее действие. Гамма-аминомасляная кислота снимает возбуждение и оказывает успокаивающее действие, ее можно принимать также как транквилизатор, но без риска развития привыкания. Эту аминокислоту используют в комплексном лечении эпилепсии и артериальной гипертензии. Так как она оказывает релаксирующее действие, ее применяют при лечении нарушений половых функций. Гамма-аминомасляную кислоту назначают при синдроме дефицита внимания. Избыток гамма-аминомасляной кислоты, однако, может увеличить беспокойство, одышку, дрожание конечностей. Глицин также является нейромедиаторной аминокислотой, проявляющей двоякое действие. Глициновые рецепторы имеются во многих участках головного мозга и спинного мозга. Связываясь с рецепторами (кодируемые генами GLRA1, GLRA2, GLRA3 и GLRB), глицин вызывает «тормозящее» воздействие на нейроны, уменьшают выделение из нейронов «возбуждающих» аминокислот, таких как глутаминовая кислота, и повышают выделение ГАМК. Также глицин связывается со специфическими участками NMDA-рецепторов и, таким образом, способствует передаче сигнала от возбуждающих нейротрансмиттеров глутамата и аспартата.[1] В спинном мозге глицин приводит к торможению мотонейронов, что позволяет использовать глицин в неврологической практике для устранения повышенного мышечного тонуса. Глутамат — наиболее распространенный возбуждающий нейротрансмиттер в нервной системе позвоночных[2]. В химических синапсах глутамат запасается в пресинаптических пузырьках (везикулах). Нервный импульс запускает высвобождение глутамата из пресинаптического нейрона. На постсинаптическом нейроне глутамат связывается с постсинаптическими рецепторами, такими, как, например, NMDA-рецепторы, и активирует их. Благодаря участию последних в синаптической пластичности, глутамат вовлечен в такие когнитивные функции, как обучение и память[3]. Одна из форм синаптической пластичности, называемая долговременной потенциацией, имеет место в глутаматергических синапсах гиппокампа, неокортекса и в других частях головного мозга. Глутамат участвует не только в классическом проведении нервного импульса от нейрона к нейрону, но и в объемной нейротрансмиссии, когда сигнал передается в соседние синапсы путем суммации глутамата, высвобожденного в соседних синапсах (так называемоая экстрасинаптическая или объемная нейротрансмиссия)[4]}} В дополнение к этому, глутамат играет важную роль в регуляции конусов роста и синаптогенеза в процессе развития головного мозга, как это было описано Марком Мэтсоном. Транспортёры[5] глутамата обнаружены на нейрональных мембранах и мембранах нейроглии. Они быстро удаляют глутамат из внеклеточного пространства. При повреждении мозга или заболеваниях они могут работать в противоположном направлении вследствие чего глутамат может накапливаться снаружи клетки. Этот процесс приводит к поступлению большого количества ионов кальция в клетку через каналы NMDA-рецепторов, что в свою очередь вызывает повреждение и даже гибель клетки — что получило название эксайтотоксичности. Механизмы клеточной смерти при этом включают:
Эксайтотоксичность, обусловленная повышенным высвобождением глутамата или его сниженным обратным захватом, возникает при ишемическом каскаде и ассоциирована с инсультом, а также наблюдается при таких заболеваниях, как боковой амиотрофический склероз, латиризм, аутизм, некоторые формы умственной отсталости, болезнь Альцгеймера[6].[7] В противоположность этому, снижение высвобождения глутамата наблюдается при классической фенилкетонурии, приводящей к нарушению экспрессии глутаматных рецепторов[8] Глутаминовая кислота участвует в реализации эпилептического припадка. Микроинъекция глутаминовой кислоты в нейроны вызывает спонтанную деполяризацию и этот паттерн напомиает пароксизмальную деполяризацию во время судорог. Эти изменения в эпилептическом очаге приводят к открытию вольтаж-зависимых кальциевых каналов, что снова стимулирует выбром глутамата и дальнейшую деполяризацию. Роли глутаматной системы в настоящее время отводится большое место в патогенезе таких психических расстройств как шизофрения и депрессия. Одной из наиболее активно изучаемых теорий этиопатогенеза шизофрении в настоящее время является гипотеза NMDA-рецепторной гипофункции: при применении антагонистов NMDA-рецепторов, таких, как фенциклиин, у здоровых добровольцев в эксперименте появляются симптомы шизофрении. В связи с этим предполагается, что гипофункция NMDA-рецепторов является одной из причин нарушений в дофаминергической передаче у больных шизофренией. Были также получены данные о том, что поражение NMDA-рецепторов иммунно-воспалительным механизмом («антиNMDA-рецепторный энцефалит») имеет клинику острой шизофрении. В этиопатогенезе эндогенной депрессии, считается, играет роль избыточная глутаматергическая нейротрансмиссия, подтверждением чему является эффективность диссоциативного анестетика кетамина при однократном применении при резистентной к лечению депрессии в эксперименте. Гистамин является одним из эндогенных факторов (медиаторов), участвующих в регуляции жизненно важных функций организма и играющих важную роль в патогенезе ряда болезненных состояний. В обычных условиях гистамин находится в организме преимущественно в связанном, неактивном состоянии. При различных патологических процессах (анафилактический шок, ожоги, обморожения, сенная лихорадка, крапивница и аллергические заболевания), а также при поступлении в организм некоторых химических веществ количество свободного гистамина увеличивается. «Высвободителями» («либераторами») гистамина являются d-тубокурарин, морфин, йодсодержащие рентгеноконтрастные препараты, высокомолекулярные соединения (декстран и др.) и другие лекарственные средства. Свободный гистамин обладает высокой активностью: он вызывает спазм гладких мышц (включая мышцы бронхов), расширение капилляров и понижение артериального давления; застой крови в капиллярах и увеличение проницаемости их стенок; вызывает отёк окружающих тканей и сгущение крови. В связи с рефлекторным возбуждением мозгового вещества надпочечников выделяется адреналин, суживаются артериолы и учащаются сердечные сокращения. Гистамин вызывает усиление секреции желудочного сока. Некоторые количества гистамина содержатся в ЦНС, где, как предполагают, он играет роль нейромедиатора (или нейромодулятора). Не исключено, что седативноедействие некоторых липофильных антагонистов гистамина (проникающих через гематоэнцефалический барьер противогистаминных препаратов, например,димедрола) связано с их блокирующим влиянием на центральные гистаминовые рецепторы. |
