Ответы БХ. Предмет, разделы и задачи биологической химии. Вклад русских и зарубежных учёных в развитие биологической химии
 Скачать 329.13 Kb. Скачать 329.13 Kb.
|
Часть заключенной в питательных веществах химической энергии преобразуется в другие биологически полезные формы – электрическую, осмотическую, механическую. Основная часть энергии выделяется в виде тепла. 30), простетическими группами которых служат флавинадениннуклеотид (ФАД) или флавинмононуклеотид (ФМН).во-первых, они обмениваются с окружающей средой веществом и энергией; во-вторых, способны в течение определенного времени удерживать свои основные параметры, но вместе с тем под влиянием внешней среды переходить из одного стационарного состояния в другое в пределах колебаний жизненно важных констант, допустимых для сохранения жизни; в-третьих, благодаря наличию в организме множества градиентов (диффузионные, температурные) и потенциалов (химические, электрические) и возникающих вследствие их действия потоков (диффузионные, тепловые, метаболические, энергетические) создаются условия для неравновесного распределения вещества и энергии между живыми системами и окружающей средой. Общая характеристика обмена веществ и энергии в живых системах. Основные этапы метаболизма. Специфический – проходит ферментативное пищеварение ферментами гидролазами. Из сложных веществ, поступающих с пищей образуются мономеры. Общий путь катаболизма – на этом этапе из множества мономеров образуются более простые соединения, количество которых не велико (пируват и ацетил-КоА). Заключительный этап катаболизма – на этом этапе извлекается основная масса энергии, образуются вода и углекислый газ. Общая характеристика биологического окисления. Его значение в организме животных. Ферменты дыхательной цепи. Их строение, функции в клетке. Обеспечения энергией важнейших процессов организма Синтеза ключевых метаболитов Регуляции обмена веществ Устранения вредных продуктов обмена Детоксикация ксенобиотиков Пиридинзависимые дегидрогеназы (=150), для которых коферментами служат НАД или НАД О. Флавинзависимые дегидрогеназы ( Цитохромы, в простетической группе которых входит порфириновое кольцо с железом. Цитохромоксидазы. Организация дыхательной цепи: Всего цепь переноса электронов включает в себя около 40 разнообразных белков, которые организованы в 4 больших мембраносвязанных мульферментных комплекса. Также существует еще один комплекс, участвующий не в переносе электронов, а синтезирующий АТФ. Строение ферментативных комплексов дыхательной цепи: 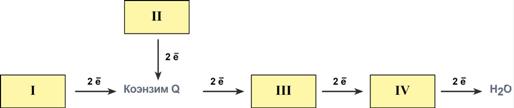 1 комплекс. НАД Н-КоQ-оксидоредуктаза. Этот комплекс также имеет рабочее название НАД Н-дегидрогеназа, содержит ФМН, 22 белковых молекулы, из них 5 железосерных белков с общей молекулярной массой до 900 кДа. Функция. Принимает электроны от НАД Н и передает их на коэнзим Q (убихинон). Переносит 4 иона Н+ на наружную поверхность внутренней митохондриальной мембраны. 2 комплекс. ФАД-зависимые дегидрогеназы. Данный комплекс как таковой не существует, его выделение условно. Он включает в себя ФАД-зависимые ферменты, расположенные на внутренней мембране – например, ацил-SКоА-дегидрогеназа (окисление жирных кислот), сукцинатдегидрогеназа (цикл трикарбоновых кислот), митохондриальная глицерол-3-фосфат-дегидрогеназа (челночный механизм переноса НАД Н в митохондрию). Функция. Восстановление ФАД в окислительно-восстановительных реакциях. Обеспечение передачи электронов от ФАД Н2 на железосерные белки внутренней мембраны митохондрий. Далее эти электроны попадают на коэнзим Q. 3 комплекс. КоQ-цитохром с-оксидоредуктаза. По-другому данный комплекс называется цитохром с редуктаза. В его составе имеются цитохром b и цитохром c1, 2 железо-серных белка. Всего в нем насчитывается 11 полипептидных цепей общей молекулярной массой около 250 кДа. Функция. Принимает электроны от коэнзима Q и передает их на цитохром с. Переносит 2 иона Н+ на наружную поверхность внутренней митохондриальной мембраны. 4 комплекс. Цитохром с-кислород-оксидоредуктаза. В этом комплексе находятся цитохромы, а и а3, он называется также цитохромоксидаза, всего содержит 6 полипептидных цепей. В комплексе также имеется 2 иона меди. Функция. Принимает электроны от цитохрома с и передает их на кислород с образованием воды. Переносит 4 иона Н+ на наружную поверхность внутренней митохондриальной мембраны. 5 комплекс. Пятый комплекс – это фермент АТФ-синтаза, состоящий из множества белковых цепей, подразделенных на две большие группы: одна группа формирует субъединицу Fо (произносится со звуком "о", а не "ноль" т.к. олигомицин-чувствительная) – ее функция каналообразующая, по ней выкачанные наружу протоны водорода устремляются в матрикс. другая группа образует субъединицу F1 – ее функция каталитическая, именно она, используя энергию протонов, синтезирует АТФ. Упрощенно считают, что для синтеза 1 молекулы АТФ необходимо прохождение через АТФ-синтазу приблизительно 3-х ионов Н+, и еще один ион H+ используется для транспорта неорганического фосфата в матрикс митохондрии.
Ферменты (энзимы) – вещества белковой природы, присутствующие во всех живых клетках и выполняющие роль катализаторов биохимических процессов. По своему составу ферменты делятся на: 1) простые – состоят только из аминокислот; 2) сложные – состоят из 2-х частей: – из белковой, которая называется апоферментом и – небелковой части – кофактора. Комплекс апофермента и кофактора называется холоферментом. Ни апофермент, ни кофактор по отдельности не способны катализировать реакцию. Функционально активен только их комплекс. По своей химической природе кофакторы могут быть представлены как органическими, так и неорганическими соединениями. Органические кофакторы представлены моно- и динуклеотидами (АТФ, НАД, ФАД и др.), витаминами и их производными. В качестве кофакторов в работе некоторых ферментов участвуют пептиды (например, глутатион). Неорганические кофакторы представлены ионами металлов (чаще всего ионами железа, меди, марганца, цинка и т.д.). Ионы металлов как кофакторы либо непосредственно участвуют в акте катализа, либо образуют моферменты присутствуют во всех живых клетках и способствуют превращению одних веществ (субстратов) в другие (продукты). Ферменты - выступают в роли катализаторов практически во всех биохимических реакциях, протекающих в живых организмах — ими катализируется более 4000 разных биохимических реакций. Ферменты - играют важнейшую роль во всех процессах жизнедеятельности, направляя и регулируя обмен веществ организма. Подобно всем катализаторам, ферменты ускоряют как прямую, так и обратную реакцию, понижая энергию активации процесса. Химическое равновесие при этом не смещается ни в прямую, ни в обратную сторону. Свойства ферментов:
Отличие ферментов от неорганических катализаторов. 1 Ферменты обладают высокой эффективностью в снижении энергии активации, колоссально увеличивая тем самым скорость химических реакций. 2. Осуществляют свою функцию в условиях измеренной температуры, низкого давления и значение рН близким к нейтральным (действует в мягких условиях) 3. Не дают побочных продуктов реакций. 4. Ферменты чувствительны к изменению условий, в которых они функционируют (среда организма).
По строению ферменты делятся на простые (однокомпонентные) и сложные (двухкомпонентные). Простой фермент состоит только из белковой части; в состав сложного фермента входит белковая и небелковая составляющие. Иначе сложный фермент называют холоферментом - активная форма фермента. Белковую часть в его составе называют апоферментом, а небелковую - коферментом. Примеры:
Коферменты — это вещества органической природы, сложной структуры (алифатические и ароматические производные, нуклеотиды, гетероциклы). Они, как правило, непосредственно участвуют в каталитической реакции как переносчики отделенных химических группировок. Для осуществления катализа необходим полноценный комплекс апобелка и кофактора, по отдельности катализ они осуществить не могут. Кофактор входит в состав активного центра, участвует в связывании субстрата или в его превращении. Как многие белки, ферменты могут быть мономерами, т.е. состоят из одной субъединицы, и полимерами, состоящими из нескольких субъединиц. Активный центр - комбинация аминокислотных остатков (обычно 12-16), обеспечивающая непосредственное связывание с молекулой субстрата и осуществляющая катализ. Аминокислотные радикалы в активном центре могут находиться в любом сочетании, при этом рядом располагаются аминокислоты, значительно удаленные друг от друга в линейной цепи. Аллостерические центры — такие участки молекулы фермента вне его активного центра, которые способны связываться слабыми типами связей (значит — обратимо) с тем или иным веществом (лигандом). Это связывание приводит к такой конформационной перестройке молекулы фермента, которая распространяется и на активный центр, облегчая либо затрудняя (замедляя) его работу. Соответственно такие вещества называются аллостерическими активаторами, или аллостерическими ингибиторами данного фермента. Аллостерические центры найдены не у всех ферментов.
В названии большинства ферментов содержится суффикс "аза", присоединённый к названию субстрата реакции, например, уреаза, сахараза, липаза, нуклеаза или к названию химического превращения определённого субстрата, например, лактатдегидрогеназа, аденилатциклаза, фосфоглюкомутаза, пируваткарбоксилаза. Согласно российской классификации ферментов (КФ), названия ферментов пишутся слитно. Однако в употреблении сохранился ряд тривиальных, исторически закреплённых названий ферментов, которые не дают представления ни о субстрате, ни о типе химического превращения, например, трипсин, пепсин, ренин, тромбин. Классификацию ферментов проводят по их действию. Ферменты разделяются на 6 классов:
Проферменты «Рождающий фермент» – это предшественники ферментов. Биологическая роль – роль предварительной готовности к воздействию. Изоферменты – ферменты, катализирующие одну и ту же реакцию, но в различных тканях и органах с разным типом обмена. Они отличаются друг от друга по ряду физико-химических свойств. (лактатдегидрогеназа – фермент, катализирующий из лактата пируват. Он имеет 5 изоформ, 1 и 2 – активнее в тканях с аэробным обменом, 4 и 5 эффективнее в анаэробном обмене, 3 – эффективна в промежуточной среде). Мультиферментный комплекс – это ряд ферментов катализирующие последовательные реакции какого-либо процесса. Продукт 1 является субстратом для 2 и так далее.
Аллостерические центры — такие участки молекулы фермента вне его активного центра, которые способны связываться слабыми типами связей (значит — обратимо) с тем или иным веществом (лигандом). Это связывание приводит к такой конформационной перестройке молекулы фермента, которая распространяется и на активный центр, облегчая либо затрудняя (замедляя) его работу. Соответственно такие вещества называются аллостерическими активаторами, или аллостерическими ингибиторами данного фермента. Существует два типа подобных ингибиторов - конкурентные и неконкурентные. Конкурентный ингибитор конкурирует с субстратом за связывание с активным центром. Это происходит потому, что ингибитор и субстрат имеют сходные структуры. В отличие от субстрата связанный с ферментом конкурентный ингибитор не подвергается ферментативному превращению. Более того, образование EI уменьшает число молекул свободного фермента, и скорость реакции снижается. Неконкурентное обратимое ингибирование не может быть ослаблено или устранено повышением концентрации субстрата, так как эти ингибиторы присоединяются к ферменту не в активном центре, а в другом месте. Связывание приводит к изменению конформации фермента и нарушению комплементарности к субстрату. Неконкурентные ингибиторы могут обратимо связываться как со свободным ферментом, так и с комплексом ES. Наиболее важными неконкурентными ингибиторами являются образующиеся в живой клетке промежуточные продукты метаболизма, способные обратимо связываться с определенными участками ферментов (аллостерические центры) и изменять их активность, что является одним из способов регуляции метаболизма. |
