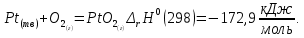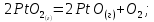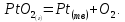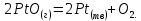отчет по практике. Производство неконцентрированной азотной кислоты. Стадия окисления аммиака. Мощность 380 тыс тг
 Скачать 1.63 Mb. Скачать 1.63 Mb.
|
|
Реакции (10) и (11) протекают в основном на стенках аппарата до поступления на катализатор при перегреве аммиачно-воздушной смеси (АВС). Реакция разложения оксида азота (II) может протекать сразу после появления NO в газе, но скорость этой реакции намного меньше скоростей реакции (9)-(11). Поэтому увеличение времени контактирования сверх оптимального всегда будет приводить к снижению выхода NO. Для протекания реакции (13) благоприятные условия создаются при времени контактирования меньше оптимального. Эта реакция более вероятна после появления NO и при наличии в газах значительных концентраций аммиака.  Таким образом, для окисления аммиака до оксида азота (II) необходимо применять не только активный, но и селективный по отношению к реакции (9) катализатор, а также подбирать такие технологические условия (температуру, линейную скорость газа, содержание аммиака в аммиачно-воздушной смеси, давление и т.д.), при которых обеспечивается максимальный выход NO [4]. Таким образом, для окисления аммиака до оксида азота (II) необходимо применять не только активный, но и селективный по отношению к реакции (9) катализатор, а также подбирать такие технологические условия (температуру, линейную скорость газа, содержание аммиака в аммиачно-воздушной смеси, давление и т.д.), при которых обеспечивается максимальный выход NO [4]. Катализаторы процесса окисления аммиака С целью получения полуфабриката – оксида азота (II), и исключения протекания других реакций процесс окисления аммиака проводят с участием активного и селективного катализатора. Общепринятым катализатором является платина, проявляющая высокую каталитическую активность в реакции (9) и обеспечивающая в температурном интервале 600-1000°С до 99% выход оксида азота (10) при продолжительности реакции около 1·10-4 с. При этом она имеет низкую температуру инициирования реакции (195-200°С), имеет хорошую пластичность, ковкость и тягучесть. С целью снижения разрушения платины при температурах конверсии под воздействием реакционной смеси и значительного количества «ядов» исходный катализатор изготовляют в смеси (в виде сплавов) с металлами платиновой группы. К ним относятся родий, палладий, рутений, и осьмий. В настоящее время в качестве катализатора процесса окисления аммиака служат сплавы платины с родием, палладием также с рутением. Это объясняется близостью их свойств. Они обладают высокой температурой плавления (˃1500°С), легко поддаются механической обработке, а палладий и платина – и сварке. При использовании в качестве катализаторов сплавов в них сохраняются свойства, присущие чистой платине: увеличение выхода оксида азота (II) при повышении температуры. В настоящее время в азотной промышленности в качестве катализатора широко применяются сплавы платины с 7-10% родия [2]. Добавление к платине Ru и Rh резко изменяет механические свойства сплава, причем введение до 1,0 мас.% рутения увеличивает прочность сплава в два раза. Таким образом, металлы платиновой группы с точки зрения их влияния на прочность сплавов с Pt можно расположить в последовательности Ru˃Rh˃Pd. Ранее платиноидные катализаторы процесса окисления аммиака выпускались в виде сеток с диаметром проволоки 0,092 мм, размером стороны ячейки 0,22 мм, числом ячеек 1024 шт./см2 (ГОСТ 3193-74). Масса 1 м2 сетки – 876 г/м2.  В настоящее время разработаны вязанные катализаторы с более сложным плетением. В настоящее время разработаны вязанные катализаторы с более сложным плетением. С целью восстановления активности катализаторных сеток последние через 1400-3000 ч работы подвергаются регенерации. Регенерация платиновых сеток производится промывкой дистиллированной водой в кварцевых ваннах, оснащенных водяной рубашкой. После промывки дистиллированной водой производится обезжиривание платиновых сеток этиловым спиртом с последующей прокалкой в пламени азотоводородной смеси или водорода [4]. Термодинамические расчеты изменения свободной энергии показывают, что приведенные реакции (9-11) при температуре 1173 К имеют следующие значения константы равновесия: 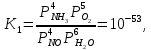 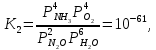 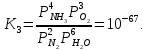 Практически все они могут считаться необратимыми. При нормированных условиях наибольшую термодинамическую вероятность имеет реакция (11). Таким образом, процесс окисления аммиака может привести лишь к образованию элементного, а затем молекулярного азота. Однако направление реакции и ее конечный продукт в данном случае определяется селективностью катализатора. Поэтому, изменяя катализатор и условия проведения процесса, можно изменить и состав продуктов реакции [2]. Механизм окисления аммиака на платиновых катализаторах  Для осуществления реакции необходимо, чтобы реагирующая система прошла через состояние с повышенной энергией, то есть, через энергетический барьер, определяемый энергией активации. Энергетическое состояние экзотермической реакции окисления NH3 определяется соотношением, приведенным на рисунке 2. Для осуществления реакции необходимо, чтобы реагирующая система прошла через состояние с повышенной энергией, то есть, через энергетический барьер, определяемый энергией активации. Энергетическое состояние экзотермической реакции окисления NH3 определяется соотношением, приведенным на рисунке 2.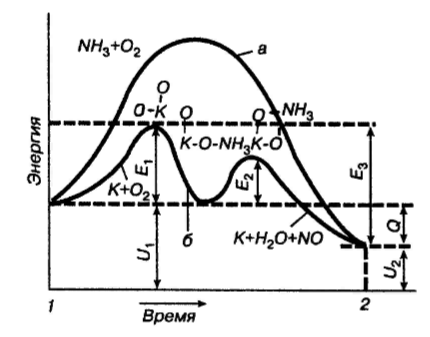 Рис.2. Энергетическое состояние экзотермической реакции окисления аммиака: 1 и 2 – исходное и конечное состояния; К - катализатор; Е1, Е2, Е3 – энергии активации исходных, промежуточных и конечных продуктов; U1 и U2 – внутренняя энергия в начальном и конечном состояниях; Q – тепловой эффект реакции (кривая а соответствует процессу гомогенного окисления аммиака, кривая б – процессу гетерогенного окисления). Процесс контактного окисления аммиака начинается со стадии активированной адсорбции кислорода на поверхности катализатора К с образованием промежуточного соединения: 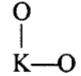 Затем происходит активированная адсорбция аммиака, требующая меньшей энергии активации. При этом образуется переходный комплекс: 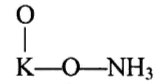 с последующей перегруппировкой его в комплекс: 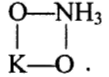 Учеными было предложено несколько механизмов процесса каталитического окисления аммиака. Согласно с адсорбционно-химической теории катализа, процесс окисления представляется следующим образом. Кислород и аммиак диффундируют из газовой смеси к поверхности катализатора. При стехиометрическом отношении O2:NH3 = 5:4 скорость процесса определяется диффузией кислорода и аммиака к поверхности катализатора. Вследствие высокой температуры контактирования ковалентная связь между атомами этих газов ослаблена, в результате чего образуется пероксидный комплекс катализатор-кислород. В последующей стадии активированной адсорбции аммиака образуется новый комплекс катализатор-кислород-аммиак (рис. 2). Далее происходит перераспределение электронных связей, и атомы азота и водорода соединяются с кислородом [4]: 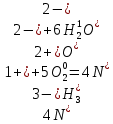 Механизм процесса окисления аммиака на поверхности платины схематично представлен на рисунке 3. 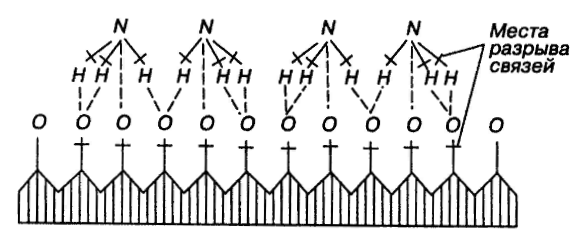 Рис.3. Схема процесса окисления аммиака на поверхности платины Примечание: сплошными линиями обозначены ранее возникшие связи, пунктирными – вновь образующиеся  Адсорбированный кислород не входит в кристаллическую решетку платины, незначительное его количество находится в растворенном состоянии, часть адсорбированного кислорода образует непосредственно с платиной непрочные связи. Вследствие высокого химического сродства водорода к кислороду молекулы аммиака ориентируются основанием к поверхности катализатора с последующим образованием молекулы воды и NO. Такие стойкие химические соединения обладают малой адсорбционной способностью и поэтому удаляются с поверхности катализатора. Освободившиеся на ней связи распределяются на ближайшие молекулы кислорода, вновь адсорбированные на поверхности катализатора. Адсорбированный кислород не входит в кристаллическую решетку платины, незначительное его количество находится в растворенном состоянии, часть адсорбированного кислорода образует непосредственно с платиной непрочные связи. Вследствие высокого химического сродства водорода к кислороду молекулы аммиака ориентируются основанием к поверхности катализатора с последующим образованием молекулы воды и NO. Такие стойкие химические соединения обладают малой адсорбционной способностью и поэтому удаляются с поверхности катализатора. Освободившиеся на ней связи распределяются на ближайшие молекулы кислорода, вновь адсорбированные на поверхности катализатора.Влияние технологических факторов на эффективность окисления аммиака до оксида азота (II) На эффективность окисления аммиака до оксидов азота в производстве азотной кислоты существенное влияние оказывают следующие факторы [1]: содержание аммиака в аммиачно-воздушной смеси (АВС); давление; температура; линейная скорость газа; время контактирования; нагрузка по аммиаку, приходящаяся на единицу поперечного сечения сетки в 1 с (СУН). Влияние содержания аммиака в АВС на выход NO. Содержание аммиака в аммиачно-воздушной смеси оказывает влияние на: выход оксида азота (II), температуру нитрозного газа на выходе с катализаторных сеток, пределы взрывамости аммиачно-воздушной смеси. Согласно уравнению (9), соотношение: [O2] : [NH3] = 5 : 4 = 1,25. Тогда, содержание аммиака в АВС составит: 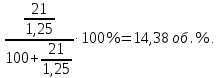  Поэтому, согласно расчетам, теоретический выход NO может быть представлен на рисунке 4 в виде прямой 1 [4]. Поэтому, согласно расчетам, теоретический выход NO может быть представлен на рисунке 4 в виде прямой 1 [4].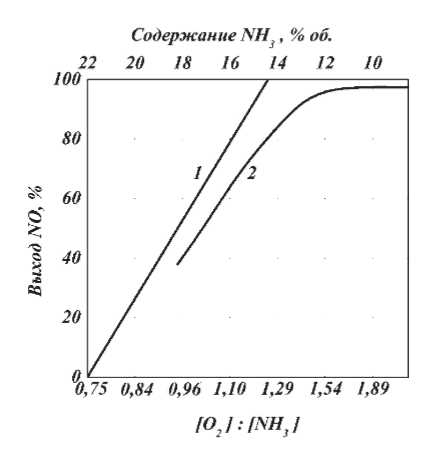 Рис.4. Зависимость выхода NO от соотношения [O2] : [NH3] в АВС: 1-теоретический выход NO; 2- выход NO в реальных условиях при 900°С Однако, согласно практическим данным при соотношении [O2] : [NH3] = =1,25 выход NO достаточно низок (рис.4). Для увеличения выхода NO требуется избыток кислорода. Максимально возможной концентрацией аммиака в АВС в случае использования воздуха, при которой достигаются высокие выходы NO, является 11-11,5 об.% и [O2] : [NH3] ≈ 1,7, причем это характерно для температур 870-900°С (рис.4). Соотношение [O2] : [NH3]=0,75 (концентрация аммиака в АВС= 22 об.%) соответствует стехиометрии реакции: 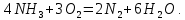 Следовательно, соотношение [O2] : [NH3] = 1,25 (концентрация NH3 в АВС = 14,4 об.%) соответствует уравнению реакции: 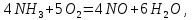 и соответствие [O2] : [NH3]= 2 (концентрация аммиака в АВС = 9,5 об.%) соответствует:   Как видно из рисунка 4, резкое снижение степени конверсии наступает Как видно из рисунка 4, резкое снижение степени конверсии наступает  при соотношении [O2] : [NH3] меньше 1,7 и содержании аммиака в аммиачно-воздушной смеси, равном 11,0 об.%. Когда соотношение [O2] : [NH3] становится больше 2 степени конверсии повышается незначительно. Таким образом, увеличение содержания аммиака в АВС и, следовательно уменьшение соотношения кислорода к аммиаку [O2] : [NH3] при одинаковой температуре должны приводить к снижению выхода NO. В связи с этим для получения высоких выходов NO необходим примерно 30%-ный избыток кислорода против стехиометрического количества, что связано с необходимостью постоянного покрытия поверхности платинового катализатора кислородом. при соотношении [O2] : [NH3] меньше 1,7 и содержании аммиака в аммиачно-воздушной смеси, равном 11,0 об.%. Когда соотношение [O2] : [NH3] становится больше 2 степени конверсии повышается незначительно. Таким образом, увеличение содержания аммиака в АВС и, следовательно уменьшение соотношения кислорода к аммиаку [O2] : [NH3] при одинаковой температуре должны приводить к снижению выхода NO. В связи с этим для получения высоких выходов NO необходим примерно 30%-ный избыток кислорода против стехиометрического количества, что связано с необходимостью постоянного покрытия поверхности платинового катализатора кислородом. Однако повышение содержания аммиака в смеси вызывает соответствующее увеличение температуры, имеющей гораздо большее значение, чем фактор изменения соотношения [O2] : [NH3] (рис.5). При выборе температуры конверсии необходимо учитывать другой фактор, влияющий на экономические показатели процесса, - потери дорогостоящей платины, которые возрастают с повышением температуры. С учетом этого рекомендуются следующие температуры (таблица 6) [4]: Таблица 6 Рекомендуемые температуры конверсии аммиака
Нижний и верхний пределы взрывоопасности аммиачно-воздушно-кислородных смесей при 20°С и 0,1 МПа приведены на рисунке 6. Пределы взрываемости аммиачно-воздушных смесей зависят от: давления в системе; температуры в системе; наличия в АВС примесей горючих газов и водяных паров; размеров реактора;  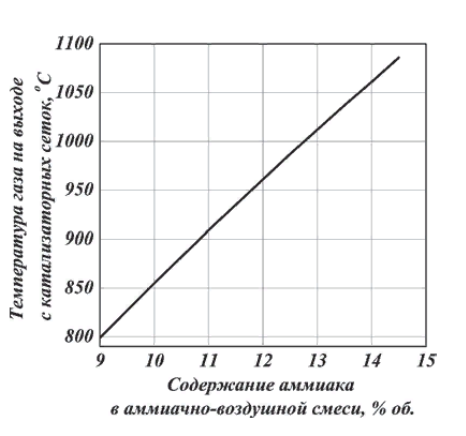 Рис.5. Зависимость расчетной температуры нитрозного газа от содержания в АВС (степень окисления аммиака до NO 93,5% (остальное количество аммиака окисляется до N2); температура АВС, поступающей в контактный аппарат, °С; теплопотери отсутствуют) С увеличением давления нижний предел взрывоопасности аммиачно-кислородных смесей снижается. Если при 0,1013 МПа он равен 13,5 об.%, то при 1,96 МПа (20 атм) он составляет всего 10 об.%. Нижний предел взрывоопасности аммиачно-воздушных смесей в области давлений 0,1-2 МПа не изменяется и соответствует концентрации аммиака 15 об.%. Скорость распространения взрыва составляет от 0,3 до 0,5 м/с. Примеси горючих газов увеличивают силу и скорость распространения взрыва. Содержание большого количества водяных паров сужает границы воспламенения аммиачных смесей. Так, аммиачно-кислородные смеси, содержащие 10% паров воды, не взрывоопасны. С увеличением размеров реактора, в котором происходит окисление, и при повышении температуры сухой смеси газов ее пределы взрываемости расширяются. Аммиачно-воздушные и аммиачно-кислородные смеси могут взрываться от соприкосновения с пламенем, от электрических и других искр. Взрывы аммиачных смесей с воздухом или кислородом приводят к большим разрушениям, поэтому одним из важнейших параметров процесса окисления является состав газовой смеси, направляемой в контактный аппарат [4]. 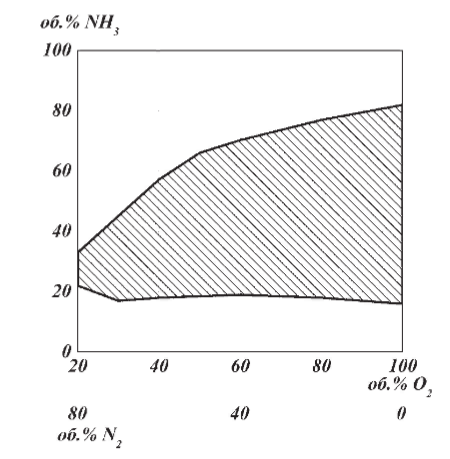 Рис.6. Пределы взрываемости аммиака в смесях O2 - N2 при 20°С и 0,1 МПа  Влияние температуры на выход NO Влияние температуры на выход NO Температура окисления аммиака оказывает существенное влияние: на выход оксида азота (II); потери дорогостоящей платины; пределы взрываемости аммиачно-воздушной смеси; проскок аммиака в нитрозные газы. Из всех технологических факторов температура оказывает наиболее значительное влияние на выход оксида азота (II). В большинстве случаев при повышении температуры степень конверсии возрастает, причем обычно существует оптимальная температура, при которой достигается максимальный выход NO. Для чистой платины эта температура оставляет около 900-920°С. Снижение степени конверсии при температурах выше 900°С объясняют тем, что газ на входе в слой катализатора необходимо нагревать до более высоких температур. В результате этого возможно протекание побочных реакций (12)-(16), приводящих к уменьшению выхода NO [2]. Влияние давления на выход NO Реакция (9) идет с уменьшением числа моль, поэтому согласно принципу Ле-Шателье повышение давления смещает равновесие в сторону исходных ве-  ществ. Как правило, выход оксид азота (II) при проведении процесса конверсии под давлением несколько ниже, чем в сравнимых условиях при атмосферном давлении. Однако высокие выходы NO можно получить и при давлениях вплоть до 3,6 МПа. Основным условием при этом является повышение температуры конверсии. Например, для получения степени конверсии на уровне 98% под давлением 1,57 МПа необходимо повысить температуру до 980-1000°С, что неизбежно приведет к потерям катализатора (рисунок 7) [2]. ществ. Как правило, выход оксид азота (II) при проведении процесса конверсии под давлением несколько ниже, чем в сравнимых условиях при атмосферном давлении. Однако высокие выходы NO можно получить и при давлениях вплоть до 3,6 МПа. Основным условием при этом является повышение температуры конверсии. Например, для получения степени конверсии на уровне 98% под давлением 1,57 МПа необходимо повысить температуру до 980-1000°С, что неизбежно приведет к потерям катализатора (рисунок 7) [2].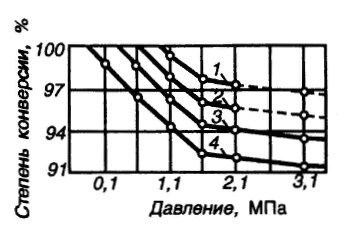 Рис.7. Зависимость степени конверсии аммиака от давления и температуры при оптимальной продолжительности процесса катализа: 1 - при 1010 °С; 2 – при 980 °С; 3 – при 950 °С; 4 – при 900 °С Влияние линейной скорости газа и нагрузки по аммиаку, приходящейся на единицу поперечного сечения сетки в 1 с (СУН) на выход NO. Влияние линейной скорости газа равноценно влиянию времени контактирования вследствие одновременного протекания ряда параллельных и последовательных реакций (12)-(16), приводящих к снижению выхода NO. Поэтому с практической точки зрения важно свести к минимуму влияние этих процессов, оптимизировав время контактирования. Продолжительность реакции окисления аммиака составляет 10-4-10-5 с. Нагрузку по аммиаку, приходящаяся на единицу поперечного сечения сетки в 1 с, - так называемая секундная удельная напряженность (СУН) – объединяет два фактора: количество реагирующего аммиака и линейную скорость газа. Из данных на рис.8 видно, что большинство промышлен-  ных установок работает при СУН, равной 0,06-0,18 кг NH3 /(м2·с), что соответствует линейным скоростям газа в рабочих условиях 1,0-1,5 м/с. При этом обеспечивается получение устойчивой степени конверсии на уровне 96-97%. ных установок работает при СУН, равной 0,06-0,18 кг NH3 /(м2·с), что соответствует линейным скоростям газа в рабочих условиях 1,0-1,5 м/с. При этом обеспечивается получение устойчивой степени конверсии на уровне 96-97%.Особенностью зависимости выхода оксида азота (II) от СУН является резкое его возрастание при снижении напряженности менее 0,15 кг/(м2·с). По мере снижения СУН выход NO стремится к 100% и, наоборот, увеличение ее более 0,2 кг NH3 /(м2·с) изменяет выход NO незначительно. При этом требуемое увеличение числа сеток непропорционально возрастанию удельной напряженности. При снижении линейной скорости газа или СУН одновременно уменьшаются удельные потери катализатора и увеличивается продолжительность безостановочного пробега сеток (рис.8). 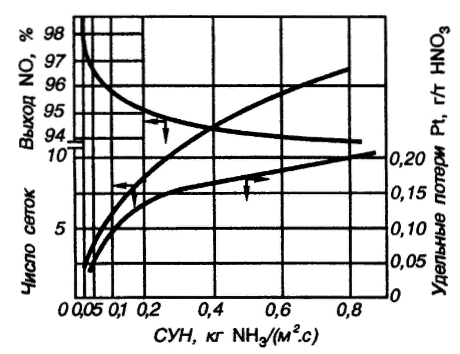 Рис.8. Зависимость выхода NO от числа сеток (d = 0,09 мм) и удельных потерь от СУН катализатора (t = 820 – 900°C, p = 0,101 – 0,98 МПа)  Таким образом, выход оксида азота (II) при проведении процесса окисления аммиака на платиновом катализаторе зависит практически от всех технологических факторов, из которых наибольшее влияние оказывает температура. Влияние давления на выход оксида азота незначительно, но с его повышением более резко проявляется влияние других факторов – напряженности, соотношения [O2] : [NH3], предкатализа и другие. При соблюдении оптимальных технологических условий выход оксида азота (II) при конверсии аммиака под атмосферным давлением может достигать 99%, в системах под давлением до 1 МПа – 96,5 - 97% [4]. Таким образом, выход оксида азота (II) при проведении процесса окисления аммиака на платиновом катализаторе зависит практически от всех технологических факторов, из которых наибольшее влияние оказывает температура. Влияние давления на выход оксида азота незначительно, но с его повышением более резко проявляется влияние других факторов – напряженности, соотношения [O2] : [NH3], предкатализа и другие. При соблюдении оптимальных технологических условий выход оксида азота (II) при конверсии аммиака под атмосферным давлением может достигать 99%, в системах под давлением до 1 МПа – 96,5 - 97% [4].Причины потерь платиноидного катализатора. Способы снижения вложений и потерь платиноидного катализатора. При окислении аммиака под воздействием высоких температур, окислительной среды и примесей, поступающих с газом, происходит изменение структуры катализаторных сеток, в частности разрыхление их поверхностного слоя, увеличение размеров кристаллов и так далее (рис.9). Изменение структуры катализатора приводят к потерям его массы. Механизм потерь платиноидного катализатора заключается в том, при высоких температурах в кислородсодержащей среде происходит окисление металлов платиновой группы. Окисление платины происходит по реакции [4]:
В объеме газа пары PtO2 могут разлагаться:
В свою очередь, оксид платины способен к разложению:
Температура плавления PtO2 составляет 450°С, а кипения -477°С, температура плавления PtO около 507°С, то есть, образуясь при температурах конверсии (800-920°С), эти соединения должны возгоняться. При последующем же охлаждении газа в нем обнаруживается в основном металлическая платина. Для снижения потерь платиноидного катализатора разработаны два способа его улавливания: химическое связывания (для улавливания соединений платины, находящихся при температурах конверсии в газовой фазе PtO и PtO2);  механическая фильтрация (для улавливания частицы катализатора, уносимых с поверхности за счет его механического разрушения, а также металлической платины, образующейся в результате разложения PtO и PtO2 при охлаждении газа). механическая фильтрация (для улавливания частицы катализатора, уносимых с поверхности за счет его механического разрушения, а также металлической платины, образующейся в результате разложения PtO и PtO2 при охлаждении газа).Первый способ улавливания осуществляется по двум направлениям: связыванием паров платиноидов различными металлами (золотом, палладием, серебром) за счет внедрения атомов платины в кристаллическую решетку сплава с образованием твердых растворов; использованием оксидов некоторых металлов (кальция, стронция и бария), устойчивых в условиях конверсии и обладающих свойством взаимодействовать с парами благородных металлов.  Рис.9. Структура тканой катализаторной сетки после эксплуатации на агрегате УКЛ-7 в течение 2920 ч.  Описание технологической схемы Описание технологической схемыТехнологический процесс получения неконцентрированной азотной кислоты по схеме АК-72 (рис.10) состоит из следующих стадий: подготовка и сжатие воздуха; подготовка газообразного аммиака; подготовка аммиачно-воздушной смеси; конверсия аммиака; утилизация тепла производства; охлаждение нитрозного газа низкого давления; промывка и сжатие нитрозного газа; охлаждение нитрозного газа высокого давления; абсорбция оксидов азота; каталитическая очистка выхлопных газов от остаточных оксидов азота; рекуперация энергии очищенного выхлопного газа; хранение и выдача продукционной кислоты; оборотное водоснабжение. |